
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Плотность и давление паров растворов. Законы Рауля.
Неэлектролиты – это вещества, растворы которых не проводят электрический ток. В растворенном состоянии они сохраняют молекулярную структуру, как правило, это органические соединения (спирт, глюкоза, камфора, бензол и т. д.) Некоторые свойства растворов зависят от числа частиц (атомов, молекул, ионов) в нем и не зависят от его состава. Такими свойствами, которые называются коллигативными, обладают разбавленные растворы неэлектролитов, концентрация которых не более чем 0,2 моль/л. К коллигативным свойствам относятся понижение давления пара, понижение температуры замерзания, повышение температуры кипения растворителя в присутствии в нем растворенного вещества, осмотическое давление. Жидкость обладает свойством испаряться и если сосуд открытый, то частички пара будут улетать, пока вся жидкость не испарится. Если сосуд закрыть крышкой, то молекулы пара, ударяясь о поверхность жидкости, могут поглотиться жидкостью, снова переходя в жидкое состояние. И наступит момент, когда установится равновесие процессов испарения жидкости и конденсации пара: Пар, находящийся в равновесии со своей жидкостью, называется насыщенным паром, а давление этого пара называется давлением насыщенного пара Давление насыщенного пара постоянно при данной температуре и не зависит от количества взятой жидкости и количества пара над жидкостью. Если растворим в воде нелетучее вещество (например, сахар), то получим раствор. При этом испаряться будет только вода, превращаясь в пар, а нелетучий сахар не будет испаряться. Молекулы нелетучего растворенного компонента препятствуют улетучиванию из раствора молекул растворителя (какая-то часть поверхности просто занята ими). Давление насыщенного пара растворителя (воды) над водным раствором сахара (Р) всегда будет меньше, чем давление насыщенного пара (Р0) растворителя (вода) над чистым растворителем (чистой водой), то есть Р< Р0. Разность между этими величинами (Р0 – Р) принято называть понижением давления пара над раствором (или понижением давления пара раствора). Отношение величины этого понижения к давлению насыщенного пара над чистым растворителем называется относительным понижением давления пара над раствором: Французский ученый Рауль в 1887 г. сформулировал закон (I закон Рауля): относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества, то есть:
Любая жидкость (чистый растворитель или раствор) закипает при той температуре, при которой давление насыщенного пара над этой жидкостью становится равным внешнему (атмосферному) давлению. Так, чистая вода кипит при 100°С, так как при этой температуре давление водяного пара равно внешнему давлению (одной атмосфере или 1,013·105 Па). Растворы (сахар в воде) кипят при более высокой температуре, чем чистая вода, так как давление насыщенного водяного пара над раствором меньше, чем над чистой водой (Р < Ро по I закону Рауля), поэтому раствор надо дополнительно нагреть, чтобы увеличить давление насыщенного пара до атмосферного давления. Повышение температуры кипения раствора (Δt кип) прямо пропорционально моляльной концентрации раствора (С m), то есть:
Любая жидкость (чистый растворитель или раствор) замерзает при той температуре, при которой давление насыщенного пара над жидкостью (например, над жидкой водой) будет равно давлению пара над твердой фазой (например, твердой водой, то есть льдом), то есть установится равновесие между жидкой фазой и твердой фазой. Чтобы давление пара над раствором стало равным давлению пара надо льдом, раствор надо дополнительно охладить. Поэтому растворы замерзают при более низкой температуре, чем чистая вода (или другой растворитель). Понижение температуры замерзания раствора (Δt зам) прямо пропорционально моляльной концентрации раствора (С m), то есть:
Таким образом, можно сформулировать II закон Рауля: повышение температуры кипения (понижение температуры замерзания) раствора по сравнению с температурой кипения (замерзания) растворителя пропорционально моляльной концентрации растворенного вещества. В двух приведенных выше формулах встречались такие величины как КЭ (эбуллиоскопическая константа) и КК (криоскопическая константта). Физический смысл эбулиоскопической и криоскопической постоянных определяется следующим образом. Их числовые значения показывают, на сколько градусов выше кипит и на сколько градусов ниже замерзает одномолялъный раствор (содержащий 1 моль растворенного вещества в 1000 г растворителя) по сравнению с температурами кипения и замерзания чистого растворителя.
Эбулиоскопическая и криоскопическая константы не зависят от природы растворенного вещества, а являются характеристиками растворителя. Их значения для различных растворителей приведены в химических справочниках.
|
||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 50; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.81.240 (0.005 с.) |
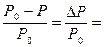 χ.
χ.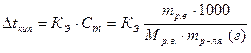 .
.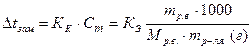 .
.


