
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ограниченная растворимость в двух и трех частных бинарных системах.
В данной части мы рассмотрим только изотермические сечения Т-х диаграмм (рисунок 3).
а)
б)
в)
Рис. 3. Изотермические сечения объемных диаграмм, образованных тремя жидкостями с ограниченной растворимостью в одной (а), в двух (б) и трех (в) частных бинарных системах.
На рисунке 3(а) представлено изотермическое сечение для системы с ограниченной взаимной растворимостью в одной бинарной системе. На рисунке 3(б) представлено изотермическое сечение для системы с ограниченной взаимной растворимостью в двух бинарных системах. На рисунке 3(в) представлено изотермическое сечение для системы с ограниченной взаимной растворимостью в трех бинарных системах. Как видно из рисунков, неограниченная растворимость может приводить к возникновению одной, двух или трех двухфазных областей на изотермических сечениях объемной дианраммы.
Слайд 2
УЧЕНИЕ О РАСТВОРАХ Растворы – это гомогенные системы, состоящие из растворенных веществ, растворителя и продуктов их взаимодействия. Основные параметры состояния раствора – это давление, температура, концентрация. Идеальный раствор - раствор, образование которого, при любом соотношении компонентов, не сопровождается тепловым эффектом (∆Нраст=0), а также сжатием или расширением системы (т. е. объем раствора обладает свойством аддитивности). Vр-ра= V1 +V2, (1) где V1 и V2 - соответственно объемы первого и второго компонентов до образования раствора. Для соблюдения этих условий надо, чтобы силы взаимодействияв растворе между однородными и разнородными молекулами были одинаковыми, что, естественно, ни в одном действительносуществующем растворе не выполняется. Раствор называется бесконечно разбавленным, если концентрация растворенного вещества в нем бесконечно мала. В таком растворе взаимодействие между молекулами растворенного вещества отсутствует, так как они разделены бесконечно большим объемом растворителя.
В практике бесконечно разбавленныерастворы не встречаются, но к ним близки по свойствам растворы газов в жидкости, с которой они химически не взаимодействуют. Состав растворов обычно выражают в весовых процентах, в молях растворенного вещества на литр раствора (молярность) или на килограмм растворителя (моляльность), а также в мольных долях. Формулы для расчета различных концентраций приведены в таблице 9.
Способы выражения концентраций Таблица 9
Для пересчета концентраций можно использовать следующие соотношения (индекс 1 относится к растворителю, 2 – к растворенному веществу, Mi – молекулярная масса, г/моль; ρ – плотность раствора, г/см3):
Среднюю молекулярную массу раствора рассчитывают по формуле:
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 85; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.213.128 (0.006 с.) |






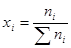

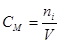
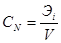
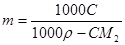 ,
, 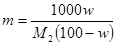 ;
;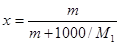 ,
, 
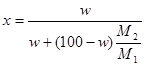 ;
;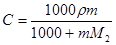 ,
, 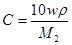 .
. (2)
(2)


