Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Протеогликаны и гликозаминогликаны. Большие и малые протеогликаны. Синтез протеогликанов. Распад протеогликанов и гликозаминогликанов. Мукополисахаридозы.
Протеогликаны и гликозаминогликаны Протеогликаны - класс сложных белков внеклеточного матрикса. Они состоят из различных стержневых (коровых) белков, к которым через N- и О-гликозидные связи присоединены олигосахариды, связанные с цепями гликозамингликанов.
Разные протеогликаны отличаются размерами молекул, относительным содержанием белка и набором гликозаминогликанов. Протеогликаны в больших количествах представлены в дентине, пульпе, цементе, тканях периодонта, слизистых оболочках полости рта. Часть протеогликанов - серглицин, матриксный протеогликан хряща, декорин, версикан и др. находятся в растворимом состоянии и локализуются во внеклеточном матриксе. Другие протеогликаны, например, синдекан, представлены трансмембранными интегральными белками. Синдекан имеет внеклеточный трансмембранный и цитоплазматический домены и взаимодействует с актиновым цито- скелетом. Снаружи на клеточной поверхности синдекан связывается с фибронектином и другими компонентами внеклеточного матрикса. В связывании протеогликанов со специфическими белками участвуют молекулы гликозаминогликанов. Их отрицательно заряженные группы взаимодействуют с положительно заряженными радикалами аминокислот лизина и аргинина, расположенными в определённых областях белковой молекулы. Таким способом связываются высокосульфатированные гликозаминогликаны с фибронектином. Протеогликаны выполняют функции рецепторов при сборке межклеточного матрикса, облегчают клеточное прикрепление и регулируют процессы роста клеток. Они также могут образовывать комплексы с некоторыми белками, например, факторами роста. В образовавшихся комплексах белки защищены от протеолитических ферментов. Эти комплексы выполняют функцию резервуаров, и только в случае необходимости фактор роста освобождается из них и приобретает способность проявлять свою биологическую активность. Гликозаминогликаны относятся к гетерополисахаридам. Это линейные структуры, построенные из повторяющихся дисахаридных единиц. Молекула дисахарида состоит из уроновой кислоты и аминосахара, аминогруппа которого обычно ацетилирована. Наличие сульфатных и карбоксильных групп в гликозаминогликанах придает им большой отрицательный заряд и способность связывать воду. Благодаря высокой плотности отрицательного заряда на своей поверхности они связывают катионы Ca2+, Na+, К+ и таким образом принимают участие в минеральном обмене.
Все гликозаминогликаны делят на 2 группы: сульфатированные и несульфатированные. К несульфатированным гликозаминогликанам относится гиалуроновая кислота. Сульфатированные гликозаминогликаны в свободном виде не встречаются; будучи связаны с небольшим количеством белка, они образуют протеогликаны. Структура дисахаридных единиц, входящих в состав гликозаминогликанов. Большие протеогликаны К большим протеогликанам относят белки с большой мол. массой, содержащие свыше 100 цепей гликозаминогликанов. В эту группу входят агрекан, версикан, нейрокан, бревикан и др. Их особенностью является способность связываться с коллагенами, гиалуроновой кислотой и образовывать протеогликановые агрегаты. В цементе, пульпе зуба, слизистой оболочке, костной ткани и коже присутствует большой хондроитинсульфатсодержащий протеогликан - версикан, мол. масса которого около 1000 кДа. Стержневой белок версикана состоит из аминокислотных последовательностей, содержащих остатки глу-гли-фен. Благодаря большому содержанию сульфата, глута- миновой кислоты и связи с гиалуроновой кислотой версикан в гидратированном состоянии занимает значительное по объёму пространство. Для матрикса хрящевой ткани характерно присутствие другого большого протеогликана - агрекана (см. хрящевую ткань). Малые протеогликаны Малые протеогликаны имеют небольшой коровый белок, к которому присоединены 1 или 2 цепи гликозаминогликанов. Среди малых протеогликанов различают протеогликаны, богатые лейцином, протеогликаны, ассоциированные с клетками, и протеогликаны базальных мембран. Синтез протеогликанов Синтез протеогликанов начинается с биосинтеза корового белка на полирибосомах. Уже в процессе трансляции белка в шероховатой эндоплазматической сети происходит связывание трисахаридов через амидные группы остатков аспарагина. В качестве донора олигосахаридов выступают долихол-связанные олигосахариды с высоким содержанием маннозы. После присоединения N-сцепленных олигосахаридов стержневой белок подвергается ксилозилированию и фосфорилированию. УДФ-ксилозатрансфераза, осуществляющая перенос остатков ксилозы на гидроксильную группу стержневого белка, является одним из ключевых ферментов биосинтеза протеогликанов. Дальнейшие процессы образования цепей гликозаминогликанов происходят в аппарате Гольджи. Полисахаридные цепи гликозаминогликанов синтезируются путём последовательного присоединения моносахаридов, донорами которых обычно являются соответствующие УДФ - сахара. На мембранах аппарата Гольджи локализованы гликозилтрансферазы, при участии которых белковая молекула и подвергается гликозилированию.
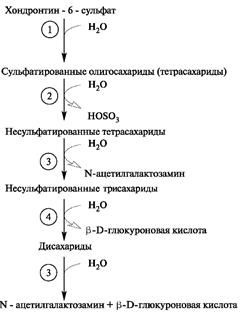
УДФ-галактозилтрансфераза I переносит на ксилозу первый остаток галактозы, УДФ-галактозилтрансфераза II - второй остаток галактозы, а завершается формирование связующего трипептида присоединением к нему остатка глюкуроновой кислоты. Эту реакцию катализирует УДФ-глюкуронилтрансфераза I. Дальнейший синтез полисахаридной цепи осуществляется последовательным присоединением N-ацетилгалактозамина (или N-ацетилглюкозамина, галактозы) и глюкуроновой (или идуроновой) кислоты. На синтез гликозаминогликанов влияют соматотропин и ретиноевая кислота, которые активируют включение сульфата в молекулы. Напротив, синтез гиалуроновой кислоты и сульфатированных гликозаминогликанов тормозят глюкокортикоиды и половые гормоны. Распад протеогликанов Распад протеогликанов - физиологический процесс, заключающийся в регулярном обновлении внеклеточных и внутриклеточных макромолекул. В деградации протеогликанов участвуют протеиназы и гликозидазы. Вначале коровый и связующие белки подвергаются воздействию свободных радикалов и в межклеточном матриксе гидролизуются матриксными металлопротеиназами - коллагеназой, желатиназой, стромелизином. Протеиназы расщепляют коровый белок, а гликозидазы гидролизуют цепи гликозаминогликанов и олигосахаридов. Все протеогликаны, содержащие цепи хондроитинсульфата, дерматансульфата, гепарансульфата и кератансульфата, первоначально расщепляются на фрагменты. Затем фрагменты протеогликанов захватываются бластными клетками и подвергаются внутриклеточной деградации. Эти фрагменты могут также с лимфой и кровью перено- ситься в печень. В гепатоцитах происходит их дальнейший гидролиз, в котором участвуют аспартильные, сериновые и другие протеиназы. Распад гликозаминогликанов Гликозаминогликаны отличаются высокой скоростью обмена: период полужизни (Т1/2) многих из них составляет от 3 до 10 сут и только для кератансульфата Т1/2 «120 сут. В разрушении полисахаридных цепей участвуют экзо- и эндогликозидазы (гиалуронидаза, (3-глюку- ронидаза, (3-галактозидаза, (3-идуронидаза) и сульфатазы. Из внеклеточного пространства по механизму эндоцитоза гликозаминогликаны поступают в клетку, где эндоцитозные пузырьки сливаются с лизосомами. Активные лизосомальные ферменты обеспечивают полный постепенный гидролиз гликозаминогликанов до мономеров. Расщепление интактных гликозаминогликанов в клетках начинается с их распада на фрагменты под действием эндогексозаминидаз и эндоглюкуронидазы. Образовавшиеся в реакциях гидролиза олигосахариды подвергаются последовательным действиям экзогликозидаз и сульфатаз, которые отщепляют мономеры с невосстанавливающегося конца. Так, гидролиз фрагментов хондроитинсульфата, содержащих на невосстанавливающем конце остаток N-ацетилгалактозамина, инициируется сульфатазой, а за ней в процесс включается β-N-ацетилгалактозаминидаза, а затем (3-глюкуронидаза. В итоге образуется неорганический сульфат и моносахариды.
Мукополисахаридозы - тяжёлые наследственные заболевания, обусловленые дефектами гидролаз, участвующих в катаболизме гликозаминогликанов. В лизосомах тканей, для которых характерен синтез наибольшего количества гликозаминогликанов, накапливаются не полностью разрушенные гликозаминогликаны и с мочой выделяются их олигосахаридные фрагменты. Существует несколько типов мукополисахаридозов, вызванных дефектами разных ферментов, участвующих в расщеплении гликозаминогликанов. Мукополисахаридозы проявляются нарушениями умственного развития у детей, поражениями сердечно-сосудистой системы, деформациями костного скелета, значительно выраженными в челюстнолицевой области, гипоплазией твёрдых тканей зубов, помутнением роговицы глаз, снижением продолжительности жизни. В настоящее время эти болезни не поддаются лечению, поэтому при подозрении на носительство дефектных генов необходимо проводить пренатальную диагностику. В этих случаях определяют активность лизосомальных гидролаз.
|
|||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 367; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.174.239 (0.007 с.) |