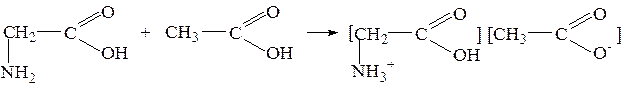Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ряд дополнительных вопросов.Стр 1 из 10Следующая ⇒
Ковалентная связь Ионная связь Металлическая связь Водородная связь Ковалентная связь возникает при образовании общих электронных пар. Ковалентная связь возникает только у неметаллов и бывает 3-х видов: ковалентная неполярная, ковалентная полярная и ковалентная связь с донорно-акцепторным механизмом. Ковалентная неполярная связь образуется между атомами неметаллов с одинаковой электроотрицательностью (Э.О.), то есть между атомами одного химического элемента Cl2 H2 P N2 Ковалентная полярная связь возникает между атомами неметаллов с разной электроотрицательностью. HCl H2O BF3 Донорно-акцепторная связь присутствует в ионе аммония NH4+ Ионная связь образуется между атомами металла и неметалла. Данный вид связи характерен для всех оксидов металлов (ZnO, Na2O, Fe2O3, CaO), для всех солей, так как там присутствуют связи «металл – неметалл» (CaCl2, NaF, CuSO4, Ag3PO4). Металлическая связь характерна для всех простых металлов (K, Ba, Mn, Pb и т.д.) Водородная связь в большинстве случаев образуется между молекулами, то есть, преимущественно, является межмолекулярной связью. Водородная связь – это связь, образующаяся между атомом водорода H одной молекулы и сильно электроотрицательным элементом другой молекулы. Водородная связь образуется между молекулами галогенводородов (HCl, HBr, HI), воды H2O, спиртов, минеральных и органических (карбоновых) кислот. По виду частиц, которые существуют в веществе, кристаллическую решётку разделяют на 4 типа: Атомная кристаллическая решётка Ионная кристаллическая решётка Металлическая кристаллическая решётка Взаимодействие кислотных и амфотерных оксидов с солями, правило. Кислотные оксиды способны реагировать с кислородосодержащими солями, при этом только менее летучий оксид (твердый оксид) может вытеснить более летучий оксид (газообразный, жидкий или твердый). t CaCO3 + SiO2 = CaSiO3 + CO2↑ Амфотерные оксиды, проявляя свойства кислотных оксидов, могут реагировать с кислородосодержащими солями, при этом вытесняя более летучий кислотный оксид из соли: t
CaCO3 + ZnO = CaZnO2 + CO2↑
Какие ме относят к щелоч. и щелочнозем. Щелочные – металлы 1 группы главной подгруппы (все) Щелочноземельные – только Ca, Sr, Ba
Как неме реагируют с конц серной, конц и разб азотной к-той. Реакции H2SO4(к) с неметаллами протекает по следующим схемам: H2SO4(к) + Неме = Кислота + SO2↑ + H2O Или, H2SO4(к) + Неме + H2O = Кислота + SO2↑ При взаимодействии разбавленной азотной кислоты HNO3 с неметаллами, как правило, образуется соответствующая для неметалла кислородосодержащая кислота, оксид азота NO, также возможно образование воды: 0 +1 +5 -2 +1 +6 -2 +2 -2 S + 2HNO3 = H2SO4 + 2NO↑ 0 +1 +5 -2 +1 -2 +1 +5 -2 +2 -2 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑ При взаимодействии концентрированной азотной кислоты HNO3 с неметаллами, как правило, образуется соответствующая для неметалла кислородосодержащая кислота, оксид азота NO2, также возможно образование воды: 0 +1 +5 -2 +1 +6 -2 +4 -2 +1 -2 S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O 0 +1 +5 -2 +1 +5 -2 +4 -2 +1 -2 P + 5HNO3 = H3PO4 + 5NO2↑ + H2O
Как из одной соли получить другую соль (что добавить). Условия протекания обмен реакций, что такое обмен реакции, между какими классами веществ. Какие соли могут реагировать между собой. С чем только могут реагировать нерастворимые соли? Чтобы из одной соли получить другую соль, часто необходимо добавить другую соль, или кислоту, основание, но так, чтобы выполнялось условие протекания обмен реакций – газ осадок вода или слабый электролит Нужно получить NaNO3 из NaCl NaCl + AgNO3 = NaNO3 + AgCl↓ Обмен реакции протекают между солями кислотами и гидроксидами 2 соли могут реагировать между собой только если они обе растворимые иначе они не смогут обмениваться ионами так как не смогут распадаться на них. Нерастворимые соли могут раствориться только в сильных кислотах. 19. Что такое средние, кислые, основные соли, знать примеры. Средние NaCl K2CO3 Кислые NaHSO3
Основные CuOHCl Правило гидролиза.
1. Если соль образована сильной кислотой и слабым гидроксидом, то гидролиз протекает по катиону, среда кислая (pH <7). 2. Если соль образована слабой кислотой и сильным гидроксидом, то гидролиз протекает по аниону, среда щелочная (pH >7). 3. Если соль образована слабой кислотой и слабым гидроксидом, то гидролиз протекает по катиону и аниону, среда нейтральная или близкая к нейтральной (pH =7). 4. Если соль образована сильной кислотой и сильным гидроксидом, то гидролиз не протекает, среда нейтральная (pH =7). Если соль не растворима в воде, то гидролиз также не протекает, среда нейтральная (pH =7).
Правило электролиза.
Электролиз – это химическая реакция вещества под действием электрического тока.
Правило катода: 1. Если электролит содержит катионы металлов, стоящих в ряду напряжения до Al, то на катоде протекает процесс восстановления воды и выделение газа водорода Н2: 2Н2О + 2ē = Н2 + 2ОН- Если электролит содержит катионы водорода Н+(кислоты), то на катоде также образуется газ водород Н2. 2. Если электролит содержит катионы металлов, стоящих в ряду напряжения от Al до Н, то на катоде протекают одновременно процессы восстановления воды и катионов металла, образуется газ водород Н2 и соответствующий металл: 2Н2О + 2ē = Н2 + 2ОН- Pb 2+ + 2ē = Pb 3. Если электролит содержит катионы металлов, стоящих в ряду напряжения после Н, то на катоде наблюдается восстановление катионов металла, образуется соответствующий металл: Cu 2+ + 2ē = Cu
Правило анода: 1. Если кислотный остаток содержит атомы кислорода (О), то на аноде протекает процесс окисления воды с выделением газа кислорода О2: 2Н2О - 4ē = О2 + 4Н+ Также на аноде образуется газ О2, если анионами являются гидроксид-ионы ОН-. 2. Если кислотный остаток является бескислородным, то на аноде протекает процесс окисления аниона с образованием соответствующего неметалла: 2 Cl - - 2ē = Cl 2
Правило катода (для расплавов): На катоде протекает процесс восстановление катионов с образованием соответствующего металла независимо от его положения в ряду напряжения: Na + +1ē = Na Правило анода (для расплавов): 1. Если кислотный остаток является кислородосодержащим, то на аноде протекает процесс окисления аниона с выделением газа кислорода О2: 2 NO 3 - -2ē = 2 NO 2 + O 2 2. Если кислотный остаток является бескислородным, то на аноде протекает процесс окисления аниона с образованием соответствующего неметалла: S2- - 2ē = S Температура. При увеличении температуры скорость реакции всегда возрастает. Катализаторы и ингибиторы. Катализаторы и ингибиторы – это вещества, ускоряющие и замедляющие скорость реакции. Катализаторы ускоряют реакцию, ингибиторы – замедляют. Окисление толуола. Окисление аренов протекает только по углеводородным радикалам.


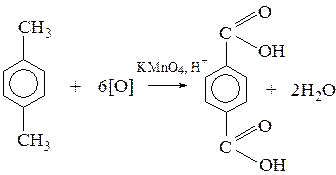
Реакции по аминогруппе 1) Взаимодействие с минеральными (неорганическими кислотами)
2) Взаимодействие с карбоновыми кислотами
Написать формулы гомологических рядов алканов, алкенов, алкинов, диенов, аренов, одноатомных и многоатомных спиртов, альдегидов, карбоновых кислот, аминов, сложных и простых эфиров, углеводов. Кто из них является изомерами. CnH2n+2 – алканы CnH2n – алкены и циклоалканы CnH2n-2 – алкины и диены CnH2n-6 – арены CnH2n+2О – одноатомные предельные спирты и простые эфиры CnH2nО – альдегиды и кетоны CnH2nО2 – карбоновые кислоты и сложные эфиры Cn (H2О) n – углеводы CnH2n+1NH2 – амины Аминокислоты изомерны нитро алканам
Кто такие гомологи. Гомологи – это вещества, относящиеся к одному классу, отличающиеся на одну или несколько –СН2 – групп. Гомологи входят в один класс соединений
Среда |
Индикатор | |||||||||||||||||||
| лакмус | фенолфталеин | метилоранж | |||||||||||||||||||
| нейтральная | фиолетовый | бесцветный | оранжевый | ||||||||||||||||||
| кислая | красный | бесцветный | красный | ||||||||||||||||||
| щелочная | синий | малиновый | желтый | ||||||||||||||||||
Знать формулы веществ: бензол, толуол, кумол, стирол, бензойная кислота, бензальдегид, бензиловый спирт, бензаналь, ацетальдегид, формальдегид, муравьиный альдегид, уксусная кислота, ацетон, изопрен, ацетилен, этилен, муравьиная кислота, щавелевая кислота, анилин, аланин, глицин, глюкоза, этиленгликоль, глицерин.
|
|
|
|
|

|
|

|
 бензиловый спирт
бензиловый спирт
|
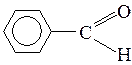
|
|
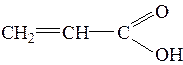
|
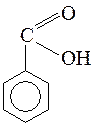
|
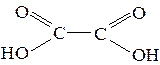
Знать формулы веществ: аммиак, едкий натр, едкое кали, гашеная и негашеная известь, сода, хлорная вода, угарный, веселящий газ, сернистый газ, бурый газ, серный ангидрид, олеум, пирит или серный колчедан, мрамор (известняк, мел), гипс, медный купарос, кварц (речной песок), какие бывают селитры, железная окалина.
NH3 аммиак
NaOH едкий натр
|
|
KOH едкое кали
CaO негашеная известь
Ca(OH)2 гашеная известь
CaCO3 мрамор (известняк, мел)
Na2CO3 сода
Cl2 + H2O хлорная вода
CO угарный газ
N2O веселящий газ
SO2 сернистый газ
NO2 бурый газ
SO3 серный ангидрид
SO3 растворенный в конц серной кислоте - олеум
FeS2 пирит или серный колчедан
CaSO4 . 2H2O гипс
CuSO4 . 5H2O медный купарос
SiO2 кварц (речной песок)
Fe3O4 железная окалина
NaNO3 – чилийская селитра
Al2O3 – корунд
Образование кислых солей фосфорной кислоты.
В зависимости от соотношения фосфорной кислоты или оксида фосфора могут получаться разные типы солей.
P2O5 + 6KOH = 2K3PO4 + 3H2O
P2O5 + 2KOH + Н2О = 2KН2PO4
P2O5 + 4KOH = 2K2НPO4 + H2O
H3PO4 + 3КOH = К3PO4 + 3H2O
H3PO4 + 2KOH = K2HPO4 + 2H2O
H3PO4 + KOH = KH2PO4 + H2O
97. Окислительные и восстановительные свойства пероксида водорода.
H2O2 как окислитель:
+1 -1 0 +1 -1 +2 -1 +1 -2
H2O2 + Zn + 2HCl = ZnCl2 + 2H2O
+1 -1 +1 +3 -2 +1 +5 -2 +1 -2
H2O2 + KNO2 = KNO3 + H2O
+1 -1 +2 +6 -2 +1 -2 +1 +1 +7 -2 +1 +6 -2 +1 -2
5H2O2 + 2MnSO4 + 6KOH = 2KMnO4 + 2K2SO4 + 8H2O
+1 -1 +3 -1 +1 -2 +1 +1 +6 -2 +1 -1 +1 -2
3H2O2 + 2CrCl3 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
H2O2 как восстановитель:
+1 -1 +1 +5 -2 0 +1 +5 -2 0
H2O2 + 2AgNO3 = 2Ag↓ + 2HNO3 + O2↑
+1 -1 +1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
5H2O2 + 2KMnO4 + 6HCl = 2KCl + 2MnCl2 + 5O2↑+ 8H2O
+1 -1 +1 +6 -2 +1 +6 -2 +1 +6 -2 +3 +6 -2 0 +1 -2
3H2O2 + K2Cr2O7 + 4H2SO4 = K2SO4 + Cr2(SO4)3 + 3O2↑ + 7H2O
Ряд дополнительных вопросов.
78. Формулы кислородных кислот хлора, какие сильные а какие слабые
79. Какой неметалл используют для обезвреживания ртути.
80. Взаимодействие солей меди и серебра, оксида и гидроксида меди и серебра с раствором аммиака, образование комплексных соединений.
81. Взаимодействие Al и Zn с растворами щелочей, образование комплексных соединений.
82. Взаимодействие оксидов Al и Zn с твердыми щелочами при нагревании и в растворе
83. Какими металлами является Be и Mg
84. Гидролиз карбида кальция и алюминия, взаимодействие карбидов с кислотами
85. Может ли реагировать Cu и CuCl2, FeCl3 и Fe
86. Как реагируют между собой CuCl2 и KI, FeCl3 и KI
87. Идет ли реакция Cu(NO3)2 и H2S
88. Взаимодействие Si и SiO2 со щелочами, с HF.
89. Хим свойства азота. Взаимодействие с активными металлами. Гидролиз и взаимодействие с кислотами нитридов.
90. Разложение при нагревании солей NH4NO3 и NH4NO2.
91. Взаимодействие хлора со щелочами при нагревании и на холоде
92. Горение и каталитическое окисление аммиака
93. Разложение и взаимодействие со щелочами солей аммония.
94. Взаимодействие бурого газа NO2 с водой и щелочами
95. Взаимодействие фосфата кальция с углем и оксидом кремния при нагревании. Получение фосфора.
96. Образование кислых солей фосфорной кислоты.
97. Окислительные и восстановительные свойства пероксида водорода.
|
|
98. Разложение пероксида водорода.
99. Взаимодействие серы со щелочами.
100. Восстановительные свойства сероводорода, его взаимодействие с SO2, H2SO4.
101. Полное и неполное горение сероводорода, окисление сульфидов.
102. Взаимодействие конц серной кислоты с галогенидами, получение газообразного хлороводорода
103. Обугливание конц серной кислоты глюкозы
104. Разложение (NH4)2Cr2O7 – реакция «вулканчика»
105. Переход хроматов в дихроматы и наоборот. Качественные при этом признаки.
106. Разложение хлоратов и перхлоратов.
107. Разложение перманганата калия
108. Взаимодействие перманганата калия и оксида марганца (4) с соляной кислотой.
109. Взаимодействие оксидов кремния и углерода с магнием при нагревании.
110. Взаимодействие железной окалины с соляной кислотой и конц серной кислотой.
Ответы.
1. В периодах слева направо уменьшается радиус атома, нарастают окислительные и неметаллические свойства и электроотрицательность, соответственно, уменьшаются восстановительные и металлические свойства.
В группах сверху вниз нарастают восстановительные и металлические свойства, увеличивается радиус атома, соответственно, уменьшаются окислительные и неметаллические свойства и электроотрицательность
2. По номеру периода можно определить число энергетических уровней в элементе, по номеру группы – его высшую валентность и число электронов на внешнем уровне, также максимальную положительную степень окисления. Например, азот N, находится в пятой группе, его максимальная валентность V, число внешних электронов 5, если он отдаст все пять электронов с внешнего уровня, его максимальная степень окисления будет равна +5, также ему не хватает до завершения внешнего уровня взять 3 электрона, тогда его степень окисления будет равна -3, или отдать 5 электронов, тогда степень окисления будет +5
3. Окислитель – тот кто берет электроны, Восстановитель – тот кто отдает электроны. Окислитель берет электроны и восстанавливается тем самым (восстановление процесс принятия электронов). Восстановитель отдает электроны тем самым он окисляется (окисление процесс отдачи электрона) Легче запомнить кто такой окислитель и восстановитель а процессы характерные им имеют противоположные названия.
Окислители берут электроны и степень окисления их понижается засчет отрицательного заряда электронов, а восстановители отдают электроны и повышают свою степень окисления, так как они отдают минусы
Металлы – только восстановители, и имеют поэтому только положительные степени окисления, а неметаллы могут быть и окислителями и восстановителями, поэтому могут иметь как положительные та и отрицательные степени окисления, кроме фтора, так как фтор – только окислитель, и он самый сильный окислитель.
4. Виды химических связей:
Ковалентная связь
Ионная связь
Металлическая связь
Водородная связь
Ковалентная связь возникает при образовании общих электронных пар. Ковалентная связь возникает только у неметаллов и бывает 3-х видов: ковалентная неполярная, ковалентная полярная и ковалентная связь с донорно-акцепторным механизмом.
Ковалентная неполярная связь образуется между атомами неметаллов с одинаковой электроотрицательностью (Э.О.), то есть между атомами одного химического элемента Cl2 H2 P N2
Ковалентная полярная связь возникает между атомами неметаллов с разной электроотрицательностью. HCl H2O BF3
Донорно-акцепторная связь присутствует в ионе аммония NH4+
Ионная связь образуется между атомами металла и неметалла. Данный вид связи характерен для всех оксидов металлов (ZnO, Na2O, Fe2O3, CaO), для всех солей, так как там присутствуют связи «металл – неметалл» (CaCl2, NaF, CuSO4, Ag3PO4).
Металлическая связь характерна для всех простых металлов (K, Ba, Mn, Pb и т.д.)
Водородная связь в большинстве случаев образуется между молекулами, то есть, преимущественно, является межмолекулярной связью. Водородная связь – это связь, образующаяся между атомом водорода H одной молекулы и сильно электроотрицательным элементом другой молекулы. Водородная связь образуется между молекулами галогенводородов (HCl, HBr, HI), воды H2O, спиртов, минеральных и органических (карбоновых) кислот.
По виду частиц, которые существуют в веществе, кристаллическую решётку разделяют на 4 типа: