
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие металлов с «царской водкой» ⇐ ПредыдущаяСтр 2 из 2
«Царской водкой» называется смесь концентрированных азотной и соляной кислот. Она применяется для окисления и перевода в растворимое состояние золота, платины и других благородных металлов. Соляная кислота в царской водке затрачивается на образование комплексного соединения окисленного металла. Из сравнения полуреакций видно, что при образовании комплексных соединений золота и платины окислительно-восстановительный потенциал уменьшается, что делает возможным их окисление азотной кислотой. Уравнения реакций золота и платины с «царской водкой» записываются так: Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O С «царской водкой» не взаимодействуют три металла: вольфрам, ниобий и тантал. Их окисляют смесью концентрированной азотной кислоты с фтороводородной, так как фтороводородная кислота образует более прочные комплексные соединения, чем соляная. Уравнения реакций при этом таковы: W + 2HNO3 + 8HF = H2[WF8] + 2NO + 4H2O 3Nb + 5HNO3 + 21HF = 3H2[NbF7] + 5NО + 10H2O 3Ta + 5HNO3 + 24HF = 3H3[TaF8] + 5NO + 10H2O В некоторых учебных пособиях встречается другое объяснение взаимодействия благородных металлов с «царской водкой». Считают, что в этой смеси между HNO3 и HCl происходит катализируемая благородными металлами реакция, в которой азотная кислота окисляет соляную по уравнению: HNO3 + 3HCl = NOCl + 2H2O Хлорид нитрозила NOCl непрочен и разлагается по уравнению: NOCl = NO + Cl(атомарный) Таким образом, окислителем металла является атомарный (т.е. очень активный) хлор в момент выделения. Поэтому продуктами взаимодействия царской водки с металлами являются соль (хлорид), вода и оксид азота (II): Au + HNO3 + 3HCl = AuCl3 + NO + 2H2O 3Pt + 4HNO3 + 12HCl = 3PtCl4 + 4NO + 8H2O, а комплексные соединения образуются при последующих реакциях: HCl + AuCl3 = H[AuCl4]; 2HCl + PtCl4 = H2[PtCl6] Получение водорода
Промышленные методы 1. Конверсия метана: СH4(г) + 2H2O(г) = 4H2+ CO2 2. Электролиз водных растворов шелочей: 2H2O = H2 + O2 3. Взаимодействие водяного пара с раскаленным углем: 2H2O + С = 2H2 + CO2 4. Взаимодействие водяного пара с железными стружками: H2O + Fe = H2+ FeO
Лабораторные методы Zn + 2HCl = ZnCl2 + H2 2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6]+3H2 Химические свойства В ковалентных соединениях степень окисления +1 (HCl, HBr) В ионных соединениях степень окисления -1 (NaH, CaH2) При обыч. условиях малоактивен
2H2 + O2 =2H2O H2 + F2 =2HF H2 + S(или Se) (нагревание)= H2S (H2Se) 3. Химия фтора Газообразный фтор исключительно активен в химических реакциях. Он взаимодействует со всеми металлами и неметаллами и с большинством сложных веществ. Высочайшая химическая активность фтора объясняется двумя причинами: 1) Молекула фтора непрочная, а связи атомов фтора с другими элементами, наоборот, очень прочны, поэтому для реакций фтора характерны большие отрицательные значения энергии Гиббса, т.е. они термодинамически очень вероятны; 2) реакции с участием фтора характеризуются низкими значениями энергии активации, поэтому они идут с большими скоростями. Во всех реакциях фтор – окислитель, окисляющий все элементы до максимальных степеней окисления: S + 3F2 = SF6; P4 + 10F2 = P4F10 2H2O + 2F2 = 4HF + O2; 2NH3 + 3F2 = 6HF + N2 Среди многочисленных соединений фтора большое значение имеет фтороводород, который получают из флюорита при 300 оС по реакции: СаF2 + H2SO4(конц) = CaSO4 + 2HF Фтороводород неограниченно растворяется в воде, образуя с молекулами Н2О водородные связи, и диссоциирует на ионы как слабая кислота. Фтороводородная кислота взаимодействует с оксидами и основаниями с образованием фторидов. С кремнийсодержащими веществами она взаимодействует с образованием газообразного тетрафторида кремния: SiO2 + 4HF = SiF4 + 2H2O Фтороводородная кислота образует кислые соли KHF2, NaHF2 и др. Это необычное свойство объясняется прочными водородными связями между её молекулами и существованием димеров H2F2. Фториды – соединения химических элементов с фтором (-1). Фториды металлов – кристаллические вещества с ионной связью. В воде растворимы только фториды щелочных металлов, при растворении они частично гидролизуются по аниону. Фториды неметаллов – газы или жидкости с молекулярной структурой. Они очень разнообразны по свойствам: некоторые из них очень инертны (CF4, NF3, SF6), другие легко разлагаются водой: SiF4 + 3H2O = H2SiO3 + 4HF У фторидов, образованных элементами одного периода, наблюдается такая же закономерность изменения свойств, как у оксидов, т. е. от основных к амфотерным и далее к кислотным.
Добавление фтороводородной кислоты к HNO3 приводит к тому, что эта смесь окисляет даже те вещества (Si, B, W, Ta, Nb), которые устойчивы к действию «царской водки», например: W + 2HNO3 + 8HF = H2WF8 + 2NO + 4H2O Фтор получают электролизом расплавленных фторидов калия или натрия; при этом происходит выделение фтора на аноде (2F– - 2e = F2). Химическое окисление невозможно, так как не существует более сильных, чем фтор, окислителей. Галогены, простые вещества
Хлор – жёлто-зелёный газ, тяжелее воздуха, ядовит, его вдыхание приводит к удушью и смерти. Хлор – сильный окислитель, окисляющий большинство металлов и неметаллов и многие сложные соединения: 2Fe + 3Cl2 = 2FeCl3; K2MnO4 + Cl2 = KMnO4 + KCl Хлор растворяется в воде (до 1 % при 20 0С), этот раствор называется хлорной водой. В хлорной воде хлор обратимо диспропорционирует:
Cl2 + H2O Образующаяся хлорноватистая кислота (НСlО) неустойчива и разлагается с образованием атомарного кислорода (НСlO = HCl + O), благодаря которому хлорная вода обесцвечивает органические красители, окисляет многие неорганические вещества. В растворах щелочей равновесие реакции диспропорционирования смещается вправо, и она протекает практически необратимо: Cl2 + 2NaOH(холодный раствор) = NaCl + NaClO + H2O; 3Cl2 + 6NaOH(горячий раствор) = 5NaCl + NaClO3 + 3H2O Хлор получают в промышленности электролизом хлорида натрия. Для лабораторных целей в небольшом количестве хлор получают химическим путем, проводя реакции в вытяжном шкафу: 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O; 10KCl + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5Cl2 + 6K2SO4 + 8H2O Бром – красно-коричневая жидкость, переходящая в пар при +59 оС. Пары брома ядовиты: они вызывают, как и хлор, удушье. Бром окисляет многие простые вещества, разрушает древесину и резину. Растворяется в воде лучше хлора (до 4 %), раствор называется бромной водой. В бромной воде бром диспропорционирует подобно хлору. Бром получают из бромидов, действуя на них окислителями, в том числе хлором, который вытесняет бром: 2KBr + Cl2 = 2KCl + Br2; 2NaBr + MnO2 + 2H2SO4 = Br2 + MnSO4 + Na2SO4 + 2H2O Йод – темно-фиолетовое кристаллическое вещество. Он легко переходит в парообразное состояние, минуя жидкое (сублимируется). Фиолетовые пары йода ядовиты. Йод хорошо растворяется в спирте, этот раствор используется как лекарственное средство (йодная настойка). Растворимость йода в воде невелика (0,028 г в 100 г Н2О). По окислительной способности йод уступает другим галогенам, но тем не менее он окисляет многие металлы и соединения, разрушает резину. У йода заметно выражены восстановительные свойства: например, он окисляется азотной кислотой: 3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2O Йод получают из золы морских водорослей, где он присутствует в виде иодидов натрия и калия, вытеснением хлором. В лабораториях его получают теми же способами, что и бром. Галогеноводороды
Хлор взаимодействует с водородом на свету; реакция протекает со взрывом по механизму неразветвленной цепной реакции: Cl2 = 2Cl×; Cl× + H2 = HCl + H×; H× + Cl2 = HCl + Cl× и т.д. Бром взаимодействует с водородом при 600 оС; эта реакция также является цепной. Взаимодействие йода с водородом (при 500 оС в присутствии платинового катализатора) является обратимым процессом: Н2 + I2 Хлороводород НCl, бромоводород НВr и йодоводород НI – газы, хорошо растворяющиеся в воде; их растворы являются сильными кислотами. Окислительная способность этих кислот невелика: они окисляют только те металлы, которые в ряду напряжений расположены до водорода:
Мg + 2HCl = МgCl2 + H2; Zn + 2HCl = ZnCl2 + H2, кроме свинца и таллия, на поверхности которых образуется защитный слой нерастворимых солей – галогенидов свинца(II) и таллия(I). Восстановительные свойства галогеноводородных кислот возрастают от HCl к HI. Например, раствор йодоводородной кислоты при хранении темнеет вследствие окисления кислородом воздуха с образованием йода: 4НI + O2 = 2I2 + 2H2O, а раствор соляной кислоты к действию кислорода воздуха устойчив. Концентрированные серная и азотная кислоты окисляют бромоводородную и йодоводородную кислоты и не окисляют соляную кислоту: 6HBr + H2SO4 = 3Br2 + S + 4H2O HI + 6HNO3 = HIO3 + 6NO2+ 3H2O Хлороводород в промышленности получают из водорода и хлора. В лабораториях (раньше и в промышленности) используют реакцию между концентрированной серной кислотой и поваренной солью: 2NaCl + H2SO4(конц) = Na2SO4 + 2HCl (отсюда название «соляная кислота») Для получения бромоводорода используются реакции: PBr3 + 3H2O = H3PO3 + 3HBr SO2 + Br2 + 2H2O = H2SO4 + 2HBr Иодоводород синтезируют из водорода и йода и используют для получения иодидов металлов и йодопроизводных органических веществ.
Оксосоединения галогенов Оксиды хлора, брома и йода – термодинамически неустойчивые соединения с положительными значениями энергии Гиббса образования, поэтому они не образуются из простых веществ и их получают из более сложных соединений, например: 4HClO4 + P4O10 = 4HPO3 + 2Cl2O7; 2NaClO2 + Cl2 = 2NaCl + 2ClO2 Оксиды галогенов легко взрываются (с разложением на галоген и кислород), и их химия является химией взрывчатых веществ. Оксиды с нечетными степенями окисления галогенов при взаимодействии с водой образуют соответствующие кислоты. Оксиды с четными степенями окисления содержат в молекулах неспаренный электрон, поэтому они соединяются в димеры. Из всех оксидов галогенов наибольшее практическое значение имеет диоксид хлора ClO2 (Cl2O4), который более устойчив, чем другие оксиды, и применяется как эффективный отбеливатель тканей. Кислоты галогенов удобно рассматривать в сравнении. Например, сила кислот одного и того же галогена при увеличении его степени окисления возрастает: HClO (очень слабая) – HClO2 (слабая) – НСlО3 (сильная) – НСlО4 (очень сильная). В ряду кислот, образованных различными галогенами в одной и той же степени окисления, сила кислот в подгруппе уменьшается: НСlО (К = 5·10-8) – HBrO (К = 2·10-9) – HIO (K = 2·10-11).
Все кислоты являются окислителями, но окислительные свойства при увеличении степени окисления галогена уменьшаются, что объясняется увеличением прочности анионов кислот и что, в свою очередь, связано с увеличением числа валентных электронов атома галогена, принимающих участие в образовании химических связей. Таким образом, наиболее сильными окислителями являются наиболее слабые кислоты НСlО, НВrО и НIО. Например, хлорноватистая кислота окисляет многие простые и сложные вещества до максимальных степеней окисления: 3HClO + S + H2O = H2SO4 + 3HCl; 2MnSO4 + 5HClO + 3H2O = 2HMnO4 + 5HCl + 2H2SO4 При взаимодействии кислородосодержащих кислот с галогеноводородными кислотами образуются галогены – простые вещества (реакция контрдиспропорционирования): HCl + HClO = Cl2 + H2O; 5HCl + HClO3 = Cl2 + 3H2O Устойчивость кислот увеличивается с увеличением степени окисления галогена. Так, НСlО и НСlО2 устойчивы только в очень разбавленных растворах, НСlО3 устойчива в растворах до 30 – 40 %, а НСlО4 получают даже в безводном состоянии. Разложение неустойчивых кислот происходит параллельно по типу диспропорционирования и внутримолекулярного окисления-восстановления: 3HClO = 2HCl + HClO3 (диспропорционирование); 4HClO3 = HCl + HClO4 (диспропорционирование); 2HClO = 2HCl + O2 (внутримолекулярное окисление-восстановление); 8HClO3 = 4HClO4 + 2Cl2 + 3O2 + 2H2O (внутримолекулярное окисление-восстановление). Соли кислородосодержащих кислот галогенов обладают большей устойчивостью, чем кислоты. Наибольшее практическое значение имеют гипохлориты, хлораты и перхлораты. Гипохлориты получают электролизом или диспропорционированием хлора в щелочах. Например, при взаимодействии хлора с холодным раствором гидроксида кальция получают смесь хлорида и гипохлорита кальция: 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O. Эту смесь называют белильной известью, а также хлорной известью, и её формулу записывают в виде СаОСl2. Белильную известь применяют для дезинфекционной обработки туалетов, выгребных ям и животноводческих помещений, для дезодорации воды в бассейнах, для отбеливания тканей. Хлорат калия КСlО3, называемый бертолетовой солью, получают взаимодействием хлора с горячими растворами гидроксида или карбоната калия: 3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O 3Cl2 + 3K2CO3 = KClO3 + 5KCl + 3CO2 Это соединение устойчиво к нагреванию до 400 0С. При 400 – 550 0С оно разлагается по механизму диспропорционирования: 4КСlО3 = 3КСlО4 + КСl, а при 550 – 600 0С происходит его разложение по механизму внутримолекулярного окисления-восстановления: 2КСlО3 = 2КСl + 3О2 Разложение бертолетовой соли ускоряют (катализируют) оксиды марганца(IV), железа(III) и другие катализаторы со снижением температуры разложения до 200 0С. С фосфором, серой, угольной пылью и органическими веществами бертолетова соль взаимодействует при комнатной температуре со взрывом при ударе или растирании. Бертолетова соль является сильным окислителем, в особенности, в расплавленном состоянии в смеси со щелочами; в этих условиях она окисляет многие природные устойчивые соединения:
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O Крупными потребителями бертолетовой соли являются спичечная промышленность, пиротехника и производство взрывчатых веществ. В химической промышленности и в химических анализах её применяют для окисления и перевода в растворимую форму наиболее инертных соединений. Перхлораты получают из хлоратов при нагревании в отсутствии катализаторов, когда идет только реакция диспропорционирования: 4Mg(ClO3)2 = 3Mg(ClO4)2 + MgCl2 Перхлораты применяются в качестве окислителей и взрывчатых веществ; перхлорат магния (ангидрон) используется как осушитель газов. Кислород
Сера
Сера – распространенный химический элемент. Она в больших количествах встречается в самородном виде и в соединениях: сульфатах (Na2SO4·10H2O – мирабилит, СаSO4·2H2O – гипс), сульфидах (PbS – галенит, ZnS – сфалерит, CuS – ковелин, Сu2S – халькозин и др.), а также в виде газообразного сероводорода в природном газе некоторых месторождений и в некоторых минеральных источниках. Сера существует в виде восьмиатомных молекул S8, образующих молекулярные кристаллы трех аллотропических модификаций: a-серу (сера ромбическая), b-серу (сера моноклинная) и g-серу (структура неизвестна). Сера плавится при 115 0С и кипит при 445 0С. В парáх при повышении температуры появляются молекулы S6, S4 и при 800 0С – S2; при 1000 0С молекулы S2 распадаются на атомы. Селен также существует в виде нескольких модификаций. Сера и селен – неметаллы. Теллур также относится к неметаллам, но по внешнему виду он похож на металл, но хрупок. Полоний – металл, по физическим свойствам близкий к свинцу. Сера при взаимодействии с металлами является окислителем Zn + S = ZnS; 2Al + 3S = Al2S3, а при взаимодействии с сильными окислителями – восстановителем: S + 6HNO3 = H2SO4 + NO2 + 2H2O С водой сера не взаимодействует, а в щелочах при нагревании диспропорционирует по уравнению: 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O Получение серы сводится к выплавлению её из пустой породы в местах залегания с помощью нагретой воды под давлением. Кроме того, серу получают из сероводорода, содержащегося в природных газах, окислением при недостатке кислорода (при избытке кислорода образуется SO2): 2H2S + O2 = 2S¯ + 2H2O Применяют серу, в основном, для получения серной кислоты и вулканизации резины. Халькогеноводороды Сероводород, Н2S, – сильно ядовитый газ с неприятным запахом. Он образуется при взаимодействии водорода с серой при 150 0С, при обработке сульфида железа(II) и сульфидов других металлов соляной кислотой, при гидролизе сульфидов амфотерных металлов: H2 + S = H2S; FeS + 2HCl = FeCl2 + H2S; Al2S3 + 6H2O = 2Al(OH)3¯ + 3H2S. Молекулы сероводорода, подобно молекулам воды, полярны, однако водородные связи, в отличие от Н2О, между ними не возникают, поэтому сероводород очень летуч и малорастворим в воде. Концентрация его насыщенного водного раствора, называемого сероводородной водой, составляет при 20 0С около 0,4 %. В растворе сероводород – слабая кислота, диссоциирующая в две ступени: H2S H+ + HS-; К1 = 1,0·10-7 HS- H+ + S2-; К2 = 2,5·10-13 Сероводород является восстановителем. В зависимости от условий он может окисляться по следующим полуреакциям: H2S - 2e = S + 2H+; jo = 0,14 В HS- - 2e = S + H+; jo = - 0,06 В H2S + 4H2O - 8e = SO42- + 10H+; jo = 0,30 В Из сравнения стандартных окислительно-восстановительных потенциалов видно, что наиболее вероятно окисление сероводорода до серы, хотя не исключено и более глубокое окисление до серной кислоты: 3H2S + K2Cr2O7 + 4H2SO4 = 3S¯ + Cr2(SO4)3 + K2SO4 + 7H2O 3H2S + 4HClO3 = 3H2SO4 + 4НСl Сероводород применяется для получения серы, различных сульфидов и в органических синтезах (тиофены, меркаптаны). Сероводород – сильный яд. При его вдыхании может мгновенно наступить обморочное состояние или даже смерть от паралича дыхания. Соединения серы с более электроположительными элементами (металлами и некоторыми неметаллами) называются сульфидами. Свойства сульфидов, образованных элементами одного периода, изменяются от основных к кислотным. Основные свойства проявляют сульфиды типичных (щелочных и щелочноземельных) металлов, а кислотные – неметаллов. Первые при растворении в воде образуют щелочную среду вследствие обратимого гидролиза, а вторые разлагаются водой нацело с образованием двух кислот: Na2S + H2O NaHS + NaOH; SiS2 + 3H2O = H2SiO3 + 2H2S Сульфиды некоторых амфотерных металлов (Al2S3, Cr2S3, Fe2S3) гидролизуются необратимо с образованием малорастворимых оснований и сероводорода: Cr2S3 + 6H2O = 2Cr(OH)3 + 3H2S При взаимодействии основных сульфидов с кислотными образуются сульфосоли (или тиосоли): Na2S + SiS2 = Na2SiS3 – сульфосиликат (тиосиликат) натрия По отношению к воде и растворам других веществ сульфиды подразделяются на четыре группы: 1. Растворимые в воде – это сульфиды щелочных и щелочноземельных металлов и аммония. 2. Нерастворимые в воде, но растворимые в кислотах со слабой окислительной способностью (соляная, разбавленная серная и т.п.). Это сульфиды ZnS, FeS, MnS. Их растворение объясняется протеканием реакций: ZnS + H2SO4 = ZnSO4 + H2S 3. Растворимые в кислотах – окислителях (азотная, хлорноватая, концентрированная серная и т.п.). Это сульфиды тяжелых металлов: Cu2S, CuS, PbS, HgS, Ag2S, Bi2S3, MoS2, CdS, PtS и др. Их растворение объясняется окислением серы, входящей в состав сульфида, до серной кислоты: CuS + 10HNO3 = Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O У некоторых сульфидов вместе с серой происходит окисление металла до его высшей степени окисления: MoS2 + 18HNO3 = H2MoO4 + 2H2SO4 + 18NO2 + 6H2O 4. Растворимые в растворах сульфидов первой группы. Это сульфиды неметаллов и сильно амфотерных металлов: As2S3, As2S5, Sb2S3, Sb2S5, P2S3, P2S5, CS2, SiS2, GeS, GeS2, SnS2, B2S3. Их общее название сульфоангидриды. Их растворение объясняется образованием растворимых сульфосолей: 3(NH4)2S + Sb2S3 = 2(NH4)3SbS3 – ортотиостибит аммония Соответствующие сульфосолям сульфокислоты не существуют. Если на раствор сульфосоли подействовать кислотой со слабой окислительной способностью, то образующаяся по обменной реакции сульфокислота мгновенно разлагается на сульфид и сероводород: 2(NH4)3SbS3 + 6HCl = 6NH4Cl + Sb2S3¯ + 3H2S Различная растворимость сульфидов используется для разделения химических элементов. Кроме того, сульфиды применяются в качестве люминофоров, пигментов, полупроводников, в химических синтезах, в кожевенном производстве, для борьбы с вредителями сельскохозяйственных культур и т.д. Оксиды халькогенов
Диоксид серы синтезируют непосредственным сжиганием серы на воздухе или длительным отжигом сульфидов: 4FeS2 + 11O2 = 2Fe2O3 + 8SО2. Диоксиды селена и теллура образуются при обработке простых веществ диоксидом азота, концентрированной HNO3: Se + NO2 SeO2 + NO Однако в результате такой же обработки серы образуются производные S(VI): SO2 + NO2 SO3 + NO и S + 6HNO3 H2SO4 + 6NO2 + 2H2O. PoO2 можно получить слабым нагреванием (250оС) металла на воздухе. Физические свойства диоксидов халькогенов ЭО2 представлены в табл.7. С увеличением размера атома Э халькогена возрастает длина связи Э-О и усиливается межмолекулярное взаимодействие: при стандартных условиях SО2 - газ, а SеО2, TeО2 и РоО2 - твердые вещества. SО2 хорошо растворяется в воде (39.3 объема в 1 объеме Н2О при 20оС, то есть около 10% по массе) с образованием гидратов SО2. nH2O. Раствор имеет кислую реакцию, но в индивидуальном виде H2SO3 не выделена из-за ее термодинамической неустойчивости. Твердый диоксид селена также хорошо растворим в воде, и при этом образуется селенистая кислота SeO2 + H2O = H2SeO3. TeО2 и РоО2 в воде не растворяются в силу высокой энергии кристаллической решетки. В щелочной среде TeО2 образует теллуриты металлов TeО2 + 2OH + H2O. TeО2 легко растворяется в разбавленной HCl: TeO2+ 6HCl
РоО2 с щелочами взаимодействует лишь при сплавлении, а в реакциях с кислотами проявляет основные свойства: РоО2 + 2H2SO4 Po(SO4)2 + 2 H2O Восстановительные свойства SО2 обусловлены присутствием в его молекуле неподеленной электронной пары (см. § 10.1). SО2 взаимодействует с окислителями различной силы (свободные галогены, хлорная, бромная и иодная вода; растворы KMnO4, H2SeO3 и др.), образуя различные производные S(VI): I2 + SO2 + 2H2O = 2HI +H2SO4, H2SeO3 + 2SO2 + H2O Se + 2H2SO4. Реакция с F2 начинается около 200оС с образованием SF6: SO2 + 5F2 SF6 + 2ОF2. При повышении температуры (300-500оС) протекает вторичный процесс: 2SO2+ 2OF2 SO2F2 + SOF2. В зависимости от соотношений реагентов возможно образование ряда оксофторидов серы: SOF2, SOF4 и SF5OF. Диоксид серы фотохимически реагирует с Cl2: SO2 + Cl2 + hnu.lc.gif (53 bytes) SO2Cl2. Первичным процессом служит фотохимическая диссоциация молекулы Cl2 на два радикала Cl.. Важнейший процесс для химической промышленности и экологии - окисление SO2кислородом до SO3: SO2+1/2O2 SO3, в технике осуществляется при повышенной температуре с использованием катализатора V2O5+ К2O. При отсутствии воды выше 210оС диоксид серы реагирует с NO2 с образованием нитрозилдисерной кислоты (NO)2S2O7: 2NO2 2NO + О2, 2SO2 + О2 2SO3, 2SO3 + NO2 + NO (NO)2S2O7. В присутствии следов воды на стенках колбы обнаруживаются Н2SO4 и NOНSO4: 3NO2 + 2SO2 + H2O 2NOHSO4 + NO. Нитрозилсерная кислота разлагается: 2NOHSO4 + Н2О 2H2SO4 + NO + NO2. Ранее этот процесс использовался для получения серной кислоты. При взаимодействии с более слабыми окислителями SО2 может окисляться до других степеней окисления. Например, при пропускании SО2 через взвесь MnO2 в воде 2SO2 + MnO2 = MnS2O6, образуется дитионат MnS2O6, производное серы(V). Окислительные свойства SО2 проявляются при взаимодействии с сильными восстановителями, например, H2S: 2 H2S(г) + SО2(г) =3S + 2H2O(г). С этим процессом связано образование свободной серы при вулканических процессах. Взвесь пыли металлического цинка в воде восстанавливает SO2 до производных серы (III) - дитионитов и дитионистой кислоты: Zn + 2SO2 = ZnS2O4 или 2NaHSO3 + SO2 + Zn = ZnSO3 + Na2S2O4 + H2O. Наличие неподеленной электронной пары в молекуле SO2 обусловливает не только восстановительные, но и комплексообразующие свойства, в частности, образование гидратов. Молекула SO2 служит нейтральным лигандом в многочисленных комплексах с переходными металлами, например: [Fe2(CO)8(mu.lc.gif (62 bytes) - SO2)], [{ Fe(C5H5)(CO)2} 2 SO2] и [RuCl(NH3)4(SO2)]Cl. Их образование протекает по донорно-акцепторному механизму, при этом молекула SO2 может присоединяться (координироваться) к атому металла через атом серы или атом кислорода и действовать как концевой (однодентатный) или мостиковый (бидентатный) лиганды. Диоксид SеO2 менее термодинамически стабилен, чем SO2 и ТеO2. Он легко восстанавливается аммиаком, гидразином, водным раствором SO2 до красного Sе. Сравнить восстановительные свойства SeO2 и TeO2, более слабые по сравнению с SO2, можно с помощью диаграммы Фроста. РоО2 легко растворяется в галогеноводородных кислотах НХ, образуя соли РоХ4, и не участвует в окислительно-восстановительных реакциях с НХ Количественный расчет Нужно считать. Больше ничего не поможет)
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 3268; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.151.153 (0.118 с.) |
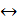 HСl + HClO
HСl + HClO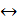 2НI
2НI H2TeCl6 +2H2O. Аналогичные соединения известны и у других элементов: H2PbCl6, H2TiCl6, H2PtCl6.
H2TeCl6 +2H2O. Аналогичные соединения известны и у других элементов: H2PbCl6, H2TiCl6, H2PtCl6.


