
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие металлов с водойСтр 1 из 2Следующая ⇒
Образование молекулы водорода из двух атомов водорода
При взаимодействии, когда электронная плотность концентрируется в пространстве между ядрами, образуется связывающая сигма – орбиталь (σ). Эта комбинация имеет более низкую энергию, чем исходные атомы. При взаимодействии, когда электронная плотность концентрируется за пределами межъядерной области, образуется разрыхляющая сигма – орбиталь (σ*). Эта комбинация имеет более высокую энергию, чем исходные атомы.
Образование молекулы гелия He2 При сближении двух атомов гелия. В этом случае тоже происходит взаимодействие 1s-орбиталей и образование и σ*-орбиталей, при этом два электрона занимают связывающую орбиталь, а другие два электрона – разрыхляющую. σ *— орбиталь дестабилизирована в такой же мере, насколько стабилизирована σ –орбиталь, поэтому два электрона, занимающие σ*— орбиталь, дестабилизируют молекулу He2. NB! Чем больше разница в заполненности связывающей и разрыхляющей орбиталей, тем молекула более прочная.
Номенклатура неорганических соединений
Формирование названий кислородсодержащих кислот Название центрального атома + суффикс (- н, - оват, - ист, - оватист) + окончание -ая + слово – кислота H2SO4 – серная кислота; H2SO3 – сернистая кислота; HNO3 – азотная кислота; HClO4 – хлорная кислота; HClO3 – хлорноватая кислота; HClO2 – хлористая кислота; HNO2 – азотистая кислота; HClO – хлорноватистая кислота. Кислоты диссоциируют в воде на катион водорода H+ и на анион. Максимальное число ионов водорода, образованных из одной молекулы кислоты, определяют ее основность. Многоосновные кислоты диссоциируют ступенчато, последовательно отщепляя один ион водорода за другим. Первый ион водорода отщепляется от молекулы достаточно легко, а каждый последующий – труднее, чем предыдущий. Способность многоосновных кислот к ступенчатой диссоциации объясняет их склонность к образованию кислых солей. Кислоты, имеющие состав HnЭОn (или содержащие максимально возможное количество атомов водорода), называются ортокислотами:
H3AsO3 – ортомышьяковистая кислота; H3AsO4 – ортомышьяковая кислота. Ортокислоты за вычетом одного (или нескольких) моль воды называются метакислотами: HAsO2 – метамышьяковистая кислота; НРО3 – метафосфорная кислота.
Взаимодействие простых веществ с водой, кислотами, щелочами
Промышленные методы 1. Конверсия метана: СH4(г) + 2H2O(г) = 4H2+ CO2 2. Электролиз водных растворов шелочей: 2H2O = H2 + O2 3. Взаимодействие водяного пара с раскаленным углем: 2H2O + С = 2H2 + CO2 4. Взаимодействие водяного пара с железными стружками: H2O + Fe = H2+ FeO
Лабораторные методы Zn + 2HCl = ZnCl2 + H2 2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6]+3H2 Химические свойства В ковалентных соединениях степень окисления +1 (HCl, HBr) В ионных соединениях степень окисления -1 (NaH, CaH2) При обыч. условиях малоактивен 2H2 + O2 =2H2O H2 + F2 =2HF H2 + S(или Se) (нагревание)= H2S (H2Se) 3. Химия фтора Газообразный фтор исключительно активен в химических реакциях. Он взаимодействует со всеми металлами и неметаллами и с большинством сложных веществ. Высочайшая химическая активность фтора объясняется двумя причинами:
1) Молекула фтора непрочная, а связи атомов фтора с другими элементами, наоборот, очень прочны, поэтому для реакций фтора характерны большие отрицательные значения энергии Гиббса, т.е. они термодинамически очень вероятны; 2) реакции с участием фтора характеризуются низкими значениями энергии активации, поэтому они идут с большими скоростями. Во всех реакциях фтор – окислитель, окисляющий все элементы до максимальных степеней окисления: S + 3F2 = SF6; P4 + 10F2 = P4F10 2H2O + 2F2 = 4HF + O2; 2NH3 + 3F2 = 6HF + N2 Среди многочисленных соединений фтора большое значение имеет фтороводород, который получают из флюорита при 300 оС по реакции: СаF2 + H2SO4(конц) = CaSO4 + 2HF Фтороводород неограниченно растворяется в воде, образуя с молекулами Н2О водородные связи, и диссоциирует на ионы как слабая кислота. Фтороводородная кислота взаимодействует с оксидами и основаниями с образованием фторидов. С кремнийсодержащими веществами она взаимодействует с образованием газообразного тетрафторида кремния: SiO2 + 4HF = SiF4 + 2H2O Фтороводородная кислота образует кислые соли KHF2, NaHF2 и др. Это необычное свойство объясняется прочными водородными связями между её молекулами и существованием димеров H2F2. Фториды – соединения химических элементов с фтором (-1). Фториды металлов – кристаллические вещества с ионной связью. В воде растворимы только фториды щелочных металлов, при растворении они частично гидролизуются по аниону. Фториды неметаллов – газы или жидкости с молекулярной структурой. Они очень разнообразны по свойствам: некоторые из них очень инертны (CF4, NF3, SF6), другие легко разлагаются водой: SiF4 + 3H2O = H2SiO3 + 4HF У фторидов, образованных элементами одного периода, наблюдается такая же закономерность изменения свойств, как у оксидов, т. е. от основных к амфотерным и далее к кислотным. Добавление фтороводородной кислоты к HNO3 приводит к тому, что эта смесь окисляет даже те вещества (Si, B, W, Ta, Nb), которые устойчивы к действию «царской водки», например: W + 2HNO3 + 8HF = H2WF8 + 2NO + 4H2O Фтор получают электролизом расплавленных фторидов калия или натрия; при этом происходит выделение фтора на аноде (2F– - 2e = F2). Химическое окисление невозможно, так как не существует более сильных, чем фтор, окислителей. Галогены, простые вещества
Хлор – жёлто-зелёный газ, тяжелее воздуха, ядовит, его вдыхание приводит к удушью и смерти. Хлор – сильный окислитель, окисляющий большинство металлов и неметаллов и многие сложные соединения: 2Fe + 3Cl2 = 2FeCl3; K2MnO4 + Cl2 = KMnO4 + KCl Хлор растворяется в воде (до 1 % при 20 0С), этот раствор называется хлорной водой. В хлорной воде хлор обратимо диспропорционирует:
Cl2 + H2O Образующаяся хлорноватистая кислота (НСlО) неустойчива и разлагается с образованием атомарного кислорода (НСlO = HCl + O), благодаря которому хлорная вода обесцвечивает органические красители, окисляет многие неорганические вещества. В растворах щелочей равновесие реакции диспропорционирования смещается вправо, и она протекает практически необратимо: Cl2 + 2NaOH(холодный раствор) = NaCl + NaClO + H2O; 3Cl2 + 6NaOH(горячий раствор) = 5NaCl + NaClO3 + 3H2O
Хлор получают в промышленности электролизом хлорида натрия. Для лабораторных целей в небольшом количестве хлор получают химическим путем, проводя реакции в вытяжном шкафу: 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O; 10KCl + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5Cl2 + 6K2SO4 + 8H2O Бром – красно-коричневая жидкость, переходящая в пар при +59 оС. Пары брома ядовиты: они вызывают, как и хлор, удушье. Бром окисляет многие простые вещества, разрушает древесину и резину. Растворяется в воде лучше хлора (до 4 %), раствор называется бромной водой. В бромной воде бром диспропорционирует подобно хлору. Бром получают из бромидов, действуя на них окислителями, в том числе хлором, который вытесняет бром: 2KBr + Cl2 = 2KCl + Br2; 2NaBr + MnO2 + 2H2SO4 = Br2 + MnSO4 + Na2SO4 + 2H2O Йод – темно-фиолетовое кристаллическое вещество. Он легко переходит в парообразное состояние, минуя жидкое (сублимируется). Фиолетовые пары йода ядовиты. Йод хорошо растворяется в спирте, этот раствор используется как лекарственное средство (йодная настойка). Растворимость йода в воде невелика (0,028 г в 100 г Н2О). По окислительной способности йод уступает другим галогенам, но тем не менее он окисляет многие металлы и соединения, разрушает резину. У йода заметно выражены восстановительные свойства: например, он окисляется азотной кислотой: 3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2O Йод получают из золы морских водорослей, где он присутствует в виде иодидов натрия и калия, вытеснением хлором. В лабораториях его получают теми же способами, что и бром. Галогеноводороды
Хлор взаимодействует с водородом на свету; реакция протекает со взрывом по механизму неразветвленной цепной реакции: Cl2 = 2Cl×; Cl× + H2 = HCl + H×; H× + Cl2 = HCl + Cl× и т.д. Бром взаимодействует с водородом при 600 оС; эта реакция также является цепной. Взаимодействие йода с водородом (при 500 оС в присутствии платинового катализатора) является обратимым процессом: Н2 + I2 Хлороводород НCl, бромоводород НВr и йодоводород НI – газы, хорошо растворяющиеся в воде; их растворы являются сильными кислотами. Окислительная способность этих кислот невелика: они окисляют только те металлы, которые в ряду напряжений расположены до водорода: Мg + 2HCl = МgCl2 + H2; Zn + 2HCl = ZnCl2 + H2, кроме свинца и таллия, на поверхности которых образуется защитный слой нерастворимых солей – галогенидов свинца(II) и таллия(I). Восстановительные свойства галогеноводородных кислот возрастают от HCl к HI. Например, раствор йодоводородной кислоты при хранении темнеет вследствие окисления кислородом воздуха с образованием йода:
4НI + O2 = 2I2 + 2H2O, а раствор соляной кислоты к действию кислорода воздуха устойчив. Концентрированные серная и азотная кислоты окисляют бромоводородную и йодоводородную кислоты и не окисляют соляную кислоту: 6HBr + H2SO4 = 3Br2 + S + 4H2O HI + 6HNO3 = HIO3 + 6NO2+ 3H2O Хлороводород в промышленности получают из водорода и хлора. В лабораториях (раньше и в промышленности) используют реакцию между концентрированной серной кислотой и поваренной солью: 2NaCl + H2SO4(конц) = Na2SO4 + 2HCl (отсюда название «соляная кислота») Для получения бромоводорода используются реакции: PBr3 + 3H2O = H3PO3 + 3HBr SO2 + Br2 + 2H2O = H2SO4 + 2HBr Иодоводород синтезируют из водорода и йода и используют для получения иодидов металлов и йодопроизводных органических веществ.
Оксосоединения галогенов Оксиды хлора, брома и йода – термодинамически неустойчивые соединения с положительными значениями энергии Гиббса образования, поэтому они не образуются из простых веществ и их получают из более сложных соединений, например: 4HClO4 + P4O10 = 4HPO3 + 2Cl2O7; 2NaClO2 + Cl2 = 2NaCl + 2ClO2 Оксиды галогенов легко взрываются (с разложением на галоген и кислород), и их химия является химией взрывчатых веществ. Оксиды с нечетными степенями окисления галогенов при взаимодействии с водой образуют соответствующие кислоты. Оксиды с четными степенями окисления содержат в молекулах неспаренный электрон, поэтому они соединяются в димеры. Из всех оксидов галогенов наибольшее практическое значение имеет диоксид хлора ClO2 (Cl2O4), который более устойчив, чем другие оксиды, и применяется как эффективный отбеливатель тканей. Кислоты галогенов удобно рассматривать в сравнении. Например, сила кислот одного и того же галогена при увеличении его степени окисления возрастает: HClO (очень слабая) – HClO2 (слабая) – НСlО3 (сильная) – НСlО4 (очень сильная). В ряду кислот, образованных различными галогенами в одной и той же степени окисления, сила кислот в подгруппе уменьшается: НСlО (К = 5·10-8) – HBrO (К = 2·10-9) – HIO (K = 2·10-11). Все кислоты являются окислителями, но окислительные свойства при увеличении степени окисления галогена уменьшаются, что объясняется увеличением прочности анионов кислот и что, в свою очередь, связано с увеличением числа валентных электронов атома галогена, принимающих участие в образовании химических связей. Таким образом, наиболее сильными окислителями являются наиболее слабые кислоты НСlО, НВrО и НIО. Например, хлорноватистая кислота окисляет многие простые и сложные вещества до максимальных степеней окисления: 3HClO + S + H2O = H2SO4 + 3HCl; 2MnSO4 + 5HClO + 3H2O = 2HMnO4 + 5HCl + 2H2SO4 При взаимодействии кислородосодержащих кислот с галогеноводородными кислотами образуются галогены – простые вещества (реакция контрдиспропорционирования): HCl + HClO = Cl2 + H2O; 5HCl + HClO3 = Cl2 + 3H2O Устойчивость кислот увеличивается с увеличением степени окисления галогена. Так, НСlО и НСlО2 устойчивы только в очень разбавленных растворах, НСlО3 устойчива в растворах до 30 – 40 %, а НСlО4 получают даже в безводном состоянии.
Разложение неустойчивых кислот происходит параллельно по типу диспропорционирования и внутримолекулярного окисления-восстановления: 3HClO = 2HCl + HClO3 (диспропорционирование); 4HClO3 = HCl + HClO4 (диспропорционирование); 2HClO = 2HCl + O2 (внутримолекулярное окисление-восстановление); 8HClO3 = 4HClO4 + 2Cl2 + 3O2 + 2H2O (внутримолекулярное окисление-восстановление). Соли кислородосодержащих кислот галогенов обладают большей устойчивостью, чем кислоты. Наибольшее практическое значение имеют гипохлориты, хлораты и перхлораты. Гипохлориты получают электролизом или диспропорционированием хлора в щелочах. Например, при взаимодействии хлора с холодным раствором гидроксида кальция получают смесь хлорида и гипохлорита кальция: 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O. Эту смесь называют белильной известью, а также хлорной известью, и её формулу записывают в виде СаОСl2. Белильную известь применяют для дезинфекционной обработки туалетов, выгребных ям и животноводческих помещений, для дезодорации воды в бассейнах, для отбеливания тканей. Хлорат калия КСlО3, называемый бертолетовой солью, получают взаимодействием хлора с горячими растворами гидроксида или карбоната калия: 3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O 3Cl2 + 3K2CO3 = KClO3 + 5KCl + 3CO2 Это соединение устойчиво к нагреванию до 400 0С. При 400 – 550 0С оно разлагается по механизму диспропорционирования: 4КСlО3 = 3КСlО4 + КСl, а при 550 – 600 0С происходит его разложение по механизму внутримолекулярного окисления-восстановления: 2КСlО3 = 2КСl + 3О2 Разложение бертолетовой соли ускоряют (катализируют) оксиды марганца(IV), железа(III) и другие катализаторы со снижением температуры разложения до 200 0С. С фосфором, серой, угольной пылью и органическими веществами бертолетова соль взаимодействует при комнатной температуре со взрывом при ударе или растирании. Бертолетова соль является сильным окислителем, в особенности, в расплавленном состоянии в смеси со щелочами; в этих условиях она окисляет многие природные устойчивые соединения: 3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O Крупными потребителями бертолетовой соли являются спичечная промышленность, пиротехника и производство взрывчатых веществ. В химической промышленности и в химических анализах её применяют для окисления и перевода в растворимую форму наиболее инертных соединений. Перхлораты получают из хлоратов при нагревании в отсутствии катализаторов, когда идет только реакция диспропорционирования: 4Mg(ClO3)2 = 3Mg(ClO4)2 + MgCl2 Перхлораты применяются в качестве окислителей и взрывчатых веществ; перхлорат магния (ангидрон) используется как осушитель газов. Кислород
Сера
Сера – распространенный химический элемент. Она в больших количествах встречается в самородном виде и в соединениях: сульфатах (Na2SO4·10H2O – мирабилит, СаSO4·2H2O – гипс), сульфидах (PbS – галенит, ZnS – сфалерит, CuS – ковелин, Сu2S – халькозин и др.), а также в виде газообразного сероводорода в природном газе некоторых месторождений и в некоторых минеральных источниках. Сера существует в виде восьмиатомных молекул S8, образующих молекулярные кристаллы трех аллотропических модификаций: a-серу (сера ромбическая), b-серу (сера моноклинная) и g-серу (структура неизвестна). Сера плавится при 115 0С и кипит при 445 0С. В парáх при повышении температуры появляются молекулы S6, S4 и при 800 0С – S2; при 1000 0С молекулы S2 распадаются на атомы. Селен также существует в виде нескольких модификаций. Сера и селен – неметаллы. Теллур также относится к неметаллам, но по внешнему виду он похож на металл, но хрупок. Полоний – металл, по физическим свойствам близкий к свинцу. Сера при взаимодействии с металлами является окислителем Zn + S = ZnS; 2Al + 3S = Al2S3, а при взаимодействии с сильными окислителями – восстановителем: S + 6HNO3 = H2SO4 + NO2 + 2H2O С водой сера не взаимодействует, а в щелочах при нагревании диспропорционирует по уравнению: 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O Получение серы сводится к выплавлению её из пустой породы в местах залегания с помощью нагретой воды под давлением. Кроме того, серу получают из сероводорода, содержащегося в природных газах, окислением при недостатке кислорода (при избытке кислорода образуется SO2): 2H2S + O2 = 2S¯ + 2H2O Применяют серу, в основном, для получения серной кислоты и вулканизации резины. Халькогеноводороды Сероводород, Н2S, – сильно ядовитый газ с неприятным запахом. Он образуется при взаимодействии водорода с серой при 150 0С, при обработке сульфида железа(II) и сульфидов других металлов соляной кислотой, при гидролизе сульфидов амфотерных металлов: H2 + S = H2S; FeS + 2HCl = FeCl2 + H2S; Al2S3 + 6H2O = 2Al(OH)3¯ + 3H2S. Молекулы сероводорода, подобно молекулам воды, полярны, однако водородные связи, в отличие от Н2О, между ними не возникают, поэтому сероводород очень летуч и малорастворим в воде. Концентрация его насыщенного водного раствора, называемого сероводородной водой, составляет при 20 0С около 0,4 %. В растворе сероводород – слабая кислота, диссоциирующая в две ступени: H2S H+ + HS-; К1 = 1,0·10-7 HS- H+ + S2-; К2 = 2,5·10-13 Сероводород является восстановителем. В зависимости от условий он может окисляться по следующим полуреакциям: H2S - 2e = S + 2H+; jo = 0,14 В HS- - 2e = S + H+; jo = - 0,06 В H2S + 4H2O - 8e = SO42- + 10H+; jo = 0,30 В Из сравнения стандартных окислительно-восстановительных потенциалов видно, что наиболее вероятно окисление сероводорода до серы, хотя не исключено и более глубокое окисление до серной кислоты: 3H2S + K2Cr2O7 + 4H2SO4 = 3S¯ + Cr2(SO4)3 + K2SO4 + 7H2O 3H2S + 4HClO3 = 3H2SO4 + 4НСl Сероводород применяется для получения серы, различных сульфидов и в органических синтезах (тиофены, меркаптаны). Сероводород – сильный яд. При его вдыхании может мгновенно наступить обморочное состояние или даже смерть от паралича дыхания. Соединения серы с более электроположительными элементами (металлами и некоторыми неметаллами) называются сульфидами. Свойства сульфидов, образованных элементами одного периода, изменяются от основных к кислотным. Основные свойства проявляют сульфиды типичных (щелочных и щелочноземельных) металлов, а кислотные – неметаллов. Первые при растворении в воде образуют щелочную среду вследствие обратимого гидролиза, а вторые разлагаются водой нацело с образованием двух кислот: Na2S + H2O NaHS + NaOH; SiS2 + 3H2O = H2SiO3 + 2H2S Сульфиды некоторых амфотерных металлов (Al2S3, Cr2S3, Fe2S3) гидролизуются необратимо с образованием малорастворимых оснований и сероводорода: Cr2S3 + 6H2O = 2Cr(OH)3 + 3H2S При взаимодействии основных сульфидов с кислотными образуются сульфосоли (или тиосоли): Na2S + SiS2 = Na2SiS3 – сульфосиликат (тиосиликат) натрия По отношению к воде и растворам других веществ сульфиды подразделяются на четыре группы: 1. Растворимые в воде – это сульфиды щелочных и щелочноземельных металлов и аммония. 2. Нерастворимые в воде, но растворимые в кислотах со слабой окислительной способностью (соляная, разбавленная серная и т.п.). Это сульфиды ZnS, FeS, MnS. Их растворение объясняется протеканием реакций: ZnS + H2SO4 = ZnSO4 + H2S 3. Растворимые в кислотах – окислителях (азотная, хлорноватая, концентрированная серная и т.п.). Это сульфиды тяжелых металлов: Cu2S, CuS, PbS, HgS, Ag2S, Bi2S3, MoS2, CdS, PtS и др. Их растворение объясняется окислением серы, входящей в состав сульфида, до серной кислоты: CuS + 10HNO3 = Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O У некоторых сульфидов вместе с серой происходит окисление металла до его высшей степени окисления: MoS2 + 18HNO3 = H2MoO4 + 2H2SO4 + 18NO2 + 6H2O 4. Растворимые в растворах сульфидов первой группы. Это сульфиды неметаллов и сильно амфотерных металлов: As2S3, As2S5, Sb2S3, Sb2S5, P2S3, P2S5, CS2, SiS2, GeS, GeS2, SnS2, B2S3. Их общее название сульфоангидриды. Их растворение объясняется образованием растворимых сульфосолей: 3(NH4)2S + Sb2S3 = 2(NH4)3SbS3 – ортотиостибит аммония Соответствующие сульфосолям сульфокислоты не существуют. Если на раствор сульфосоли подействовать кислотой со слабой окислительной способностью, то образующаяся по обменной реакции сульфокислота мгновенно разлагается на сульфид и сероводород: 2(NH4)3SbS3 + 6HCl = 6NH4Cl + Sb2S3¯ + 3H2S Различная растворимость сульфидов используется для разделения химических элементов. Кроме того, сульфиды применяются в качестве люминофоров, пигментов, полупроводников, в химических синтезах, в кожевенном производстве, для борьбы с вредителями сельскохозяйственных культур и т.д. Оксиды халькогенов
Диоксид серы синтезируют непосредственным сжиганием серы на воздухе или длительным отжигом сульфидов: 4FeS2 + 11O2 = 2Fe2O3 + 8SО2. Диоксиды селена и теллура образуются при обработке простых веществ диоксидом азота, концентрированной HNO3: Se + NO2 SeO2 + NO Однако в результате такой же обработки серы образуются производные S(VI): SO2 + NO2 SO3 + NO и S + 6HNO3 H2SO4 + 6NO2 + 2H2O. PoO2 можно получить слабым нагреванием (250оС) металла на воздухе. Физические свойства диоксидов халькогенов ЭО2 представлены в табл.7. С увеличением размера атома Э халькогена возрастает длина связи Э-О и усиливается межмолекулярное взаимодействие: при стандартных условиях SО2 - газ, а SеО2, TeО2 и РоО2 - твердые вещества. SО2 хорошо растворяется в воде (39.3 объема в 1 объеме Н2О при 20оС, то есть около 10% по массе) с образованием гидратов SО2. nH2O. Раствор имеет кислую реакцию, но в индивидуальном виде H2SO3 не выделена из-за ее термодинамической неустойчивости. Твердый диоксид селена также хорошо растворим в воде, и при этом образуется селенистая кислота SeO2 + H2O = H2SeO3. TeО2 и РоО2 в воде не растворяются в силу высокой энергии кристаллической решетки. В щелочной среде TeО2 образует теллуриты металлов TeО2 + 2OH + H2O. TeО2 легко растворяется в разбавленной HCl: TeO2+ 6HCl
РоО2 с щелочами взаимодействует лишь при сплавлении, а в реакциях с кислотами проявляет основные свойства: РоО2 + 2H2SO4 Po(SO4)2 + 2 H2O Восстановительные свойства SО2 обусловлены присутствием в его молекуле неподеленной электронной пары (см. § 10.1). SО2 взаимодействует с окислителями различной силы (свободные галогены, хлорная, бромная и иодная вода; растворы KMnO4, H2SeO3 и др.), образуя различные производные S(VI): I2 + SO2 + 2H2O = 2HI +H2SO4, H2SeO3 + 2SO2 + H2O Se + 2H2SO4. Реакция с F2 начинается около 200оС с образованием SF6: SO2 + 5F2 SF6 + 2ОF2. При повышении температуры (300-500оС) протекает вторичный процесс: 2SO2+ 2OF2 SO2F2 + SOF2. В зависимости от соотношений реагентов возможно образование ряда оксофторидов серы: SOF2, SOF4 и SF5OF. Диоксид серы фотохимически реагирует с Cl2: SO2 + Cl2 + hnu.lc.gif (53 bytes) SO2Cl2. Первичным процессом служит фотохимическая диссоциация молекулы Cl2 на два радикала Cl.. Важнейший процесс для химической промышленности и экологии - окисление SO2кислородом до SO3: SO2+1/2O2 SO3, в технике осуществляется при повышенной температуре с использованием катализатора V2O5+ К2O. При отсутствии воды выше 210оС диоксид серы реагирует с NO2 с образованием нитрозилдисерной кислоты (NO)2S2O7: 2NO2 2NO + О2, 2SO2 + О2 2SO3, 2SO3 + NO2 + NO (NO)2S2O7. В присутствии следов воды на стенках колбы обнаруживаются Н2SO4 и NOНSO4: 3NO2 + 2SO2 + H2O 2NOHSO4 + NO. Нитрозилсерная кислота разлагается: 2NOHSO4 + Н2О 2H2SO4 + NO + NO2. Ранее этот процесс использовался для получения серной кислоты. При взаимодействии с более слабыми окислителями SО2 может окисляться до других степеней окисления. Например, при пропускании SО2 через взвесь MnO2 в воде 2SO2 + MnO2 = MnS2O6, образуется дитионат MnS2O6, производное серы(V). Окислительные свойства SО2 проявляются при взаимодействии с сильными восстановителями, например, H2S: 2 H2S(г) + SО2(г) =3S + 2H2O(г). С этим процессом связано образование свободной серы при вулканических процессах. Взвесь пыли металлического цинка в воде восстанавливает SO2 до производных серы (III) - дитионитов и дитионистой кислоты: Zn + 2SO2 = ZnS2O4 или 2NaHSO3 + SO2 + Zn = ZnSO3 + Na2S2O4 + H2O. Наличие неподеленной электронной пары в молекуле SO2 обусловливает не только восстановительные, но и комплексообразующие свойства, в частности, образование гидратов. Молекула SO2 служит нейтральным лигандом в многочисленных комплексах с переходными металлами, например: [Fe2(CO)8(mu.lc.gif (62 bytes) - SO2)], [{ Fe(C5H5)(CO)2} 2 SO2] и [RuCl(NH3)4(SO2)]Cl. Их образование протекает по донорно-акцепторному механизму, при этом молекула SO2 может присоединяться (координироваться) к атому металла через атом серы или атом кислорода и действовать как концевой (однодентатный) или мостиковый (бидентатный) лиганды. Диоксид SеO2 менее термодинамически стабилен, чем SO2 и ТеO2. Он легко восстанавливается аммиаком, гидразином, водным раствором SO2 до красного Sе. Сравнить восстановительные свойства SeO2 и TeO2, более слабые по сравнению с SO2, можно с помощью диаграммы Фроста. РоО2 легко растворяется в галогеноводородных кислотах НХ, образуя соли РоХ4, и не участвует в окислительно-восстановительных реакциях с НХ Количественный расчет Нужно считать. Больше ничего не поможет) Образование молекулы водорода из двух атомов водорода
При взаимодействии, когда электронная плотность концентрируется в пространстве между ядрами, образуется связывающая сигма – орбиталь (σ). Эта комбинация имеет более низкую энергию, чем исходные атомы. При взаимодействии, когда электронная плотность концентрируется за пределами межъядерной области, образуется разрыхляющая сигма – орбиталь (σ*). Эта комбинация имеет более высокую энергию, чем исходные атомы.
Образование молекулы гелия He2 При сближении двух атомов гелия. В этом случае тоже происходит взаимодействие 1s-орбиталей и образование и σ*-орбиталей, при этом два электрона занимают связывающую орбиталь, а другие два электрона – разрыхляющую. σ *— орбиталь дестабилизирована в такой же мере, насколько стабилизирована σ –орбиталь, поэтому два электрона, занимающие σ*— орбиталь, дестабилизируют молекулу He2. NB! Чем больше разница в заполненности связывающей и разрыхляющей орбиталей, тем молекула более прочная.
Номенклатура неорганических соединений
Формирование названий кислородсодержащих кислот Название центрального атома + суффикс (- н, - оват, - ист, - оватист) + окончание -ая + слово – кислота H2SO4 – серная кислота; H2SO3 – сернистая кислота; HNO3 – азотная кислота; HClO4 – хлорная кислота; HClO3 – хлорноватая кислота; HClO2 – хлористая кислота; HNO2 – азотистая кислота; HClO – хлорноватистая кислота. Кислоты диссоциируют в воде на катион водорода H+ и на анион. Максимальное число ионов водорода, образованных из одной молекулы кислоты, определяют ее основность. Многоосновные кислоты диссоциируют ступенчато, последовательно отщепляя один ион водорода за другим. Первый ион водорода отщепляется от молекулы достаточно легко, а каждый последующий – труднее, чем предыдущий. Способность многоосновных кислот к ступенчатой диссоциации объясняет их склонность к образованию кислых солей. Кислоты, имеющие состав HnЭОn (или содержащие максимально возможное количество атомов водорода), называются ортокислотами: H3AsO3 – ортомышьяковистая кислота; H3AsO4 – ортомышьяковая кислота. Ортокислоты за вычетом одного (или нескольких) моль воды называются метакислотами: HAsO2 – метамышьяковистая кислота; НРО3 – метафосфорная кислота.
Взаимодействие простых веществ с водой, кислотами, щелочами
Взаимодействие металлов с водой Водород из воды могут вытеснять металлы, расположенные в ряду напряжений левее кадмия – от лития до железа. При комнатной температуре с достаточной скоростью взаимодействуют с водой лишь щелочные и щелочноземельные металлы. Порошкообразные магний и алюминий взаимодействуют с кипящей водой. Необходимым условием реакции является предварительное удаление оксидной пленки: MgO + H2O = Mg(OH)2 Этот процесс протекает без выделения газа. А далее вода непосредственно взаимодействует с металлом с выделением водорода: Mg + 2H2O = Mg(OH)2 + Н2 Вода является слабым окислителем, поэтому она окисляет металлы до низших степеней окисления. Часто наблюдается взаимодействие с водой металлов, расположенных в ряду напряжений правее железа. Оно объясняется присутствием в воде растворенного кислорода, являющегося более сильным окислителем, чем вода.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 146; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.13.173 (0.343 с.) |
 В результате взаимодействия 1s-орбиталей каждого из атомов водорода, образуются две молекулярные орбитали.
В результате взаимодействия 1s-орбиталей каждого из атомов водорода, образуются две молекулярные орбитали. Для элементов второго периода характерен данный тип диаграмм, при чем заполнение МО происходит постепенно, от МО с наименьшей энергией до МО с наивысшей пока не кончатся электроны.
Для элементов второго периода характерен данный тип диаграмм, при чем заполнение МО происходит постепенно, от МО с наименьшей энергией до МО с наивысшей пока не кончатся электроны.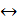 HСl + HClO
HСl + HClO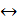 2НI
2НI H2TeCl6 +2H2O. Аналогичные соединения известны и у других элементов: H2PbCl6, H2TiCl6, H2PtCl6.
H2TeCl6 +2H2O. Аналогичные соединения известны и у других элементов: H2PbCl6, H2TiCl6, H2PtCl6.


