
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
С лайд№21 до, далее слайд№22. ⇐ ПредыдущаяСтр 6 из 6
При большой разнице температур между 298 и Т, необходимо учитывать вид температурной зависимости - для органических соединений
- для неорганических соединений
Однако в результате химической реакции меняется теплоемкость участников реакции, тогда:
где Δа, Δв, Δс – разность сумм соответствующих коэффициентов в Подставив уравнение (1.35) в (1.31), например, для органических соединений получим:
С лайд№22 до, далее Слайд№23. В большинстве случаев для диапазона температур, не превышающего 100 К линейная интерполяция теплоемкостей веществ допускается. Количество тепла, выделяемого или поглощаемого в химической реакции, можно определить по уравнению:
Или
где nj – количество (в молях) образовавшегося продукта; ni ,0 – количество (в молях) реагента; xi – степень конверсии реагента. Основной целью расчета теплового баланса является определение тепла необходимого для нагревания и охлаждения аппарата QF. Например, для реакции А + В = С + D – Qp
Или
где Зная QF можно рассчитать необходимую поверхность теплообмена при заданном времени охлаждения или нагревания, или времени охлаждения (нагревания) при заданной поверхности в периодических процессах.
В обоих случаях исходят из общеизвестного уравнения теплопередачи: · для периодических процессов
· для непрерывных процессов
В этом уравнении QF – количество передаваемого тепла; К – коэффициент теплопередачи; F – поверхность теплообмена; Δ t – средняя разность температур между реакционной массой и теплоносителем (хладагентом); τ – время проведения процесса. Если возникает необходимость определения тепла на нагрев реакционной массы перед началом процесса или охлаждения ее в конце процесса, то для этих целей используют уравнение:
где m – масса веществ, входящих в состав реакционной массы;
С лайд№24 до, далее Слайд№25. Как уже отмечалось, энергетические расчеты предполагают также расчет расходов теплоносителей для обогрева реакционной массы или хладагентов для ее охлаждения. В качестве теплоносителей наиболее широко используется пар. Расход пара можно определить по уравнению:
где Q – расход тепла, кДж; y – теплосодержание пара, кДж/кг; t – температура конденсата, которую можно принять равной температуре пара, численно равная теплосодержанию конденсата в кДж/кг. Наиболее распространенными охлаждающими агентами являются вода, рассол, воздух. Расход охлаждающих агентов определяется по формуле:
где Q – количество тепла, которое надо отвести, кДж; Вопросы и упражнения для самостоятельной Проработки материала 1. Из каких основных стадий состоит химико-технологический процесс. В каких стадиях процесса участвуют химические реакции? 2. Какие вы знаете технологические критерии эффективности химико-технологического процесса? Дайте их определения. 3. В чем различие между полной (интегральной) и мгновенной (дифференциальной) селективностями? 4. Рассчитайте селективность по продукту, если при проведении последовательных реакций A → R + M (целевая); A → S + N (побочная) получено 40 кг продукта R и 105 кг продукта S? 5. Протекают последовательные реакции A + N → S + D целевым продуктом которых является вещество R. Определите выход продукта R, степень превращения xA, если известен конечный состав реакционной смеси: nA ,0 = 2 кмоль, nA = 0,5 кмоль. 6. Дайте определение скорости реакции и запишите их выражения для реагентов и продуктов реакции A + B → C + D. 7. Каким уравнением описывается зависимость скорости реакции от концентрации реагирующих веществ? 8. Сформулируйте закон сохранения массы вещества и запишите его для реакции A + R → N. 9. Как определяется полнота простой и сложной реакции? 10. Для каких целей используется закон Гесса? Запишите его уравнение для реакции A + B → R + N + Qp.
11. Как определяется тепло, которое выделяется в процессе химической реакции и которое учитывается при составлении теплового баланса? Напишите уравнения. 12. Напишите уравнения Кирхгофа и проинтегрируйте его в различных вариантах. 13. Напишите уравнение теплового баланса для реакции A → B; A → S + R и прокомментируйте его.
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 143; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.240.178 (0.008 с.) |
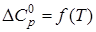 , которая в технической и справочной литературе дается в виде температурного ряда, например:
, которая в технической и справочной литературе дается в виде температурного ряда, например: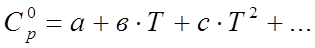 ,
,
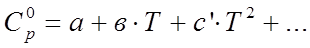 .
.
 ,
,
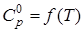 продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов.
продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов.

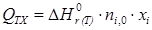 ,
,
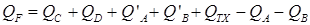
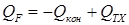 ,
,
 – конвективный перенос тепла. С лайд№23 до, далее Слайд№24.
– конвективный перенос тепла. С лайд№23 до, далее Слайд№24.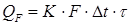 ,
,
 .
.
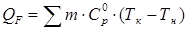 ,
,
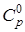 - теплоемкость отдельных веществ; T к и T н – конечная и начальная температуры реакционной смеси.
- теплоемкость отдельных веществ; T к и T н – конечная и начальная температуры реакционной смеси.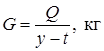 ,
,
 ,
,



