
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Материальный баланс химических процессовСтр 1 из 6Следующая ⇒
ОХТ лекция№1. ВВЕДЕНИЕ Глава I Химико-технологический процесс и его содержание §1 Основные технологические понятия и определения Материальный баланс химических процессов Энергетические (тепловые) балансы химических процессов Введение. Химическая технология – прикладная наука о способах и процессах производства различных продуктов и материалов, осуществляемых с участием химических превращений на основе рационального использования сырья и энергии. Свое название химическая технология берет от трех слов: химия, которая имеет свою этимологию от греческого «технос» - искусство, ремесло и «логос» - ученье, наука. Далее Слайд№1 Как наука химическая технология имеет предмет изучения – химическое производство; цель изучения – создание целесообразного способа производства необходимых человеку продуктов; методы исследования – экспериментальный, моделирования, системный анализ. Химическая технология относится к естественным наукам, поскольку имеет дело с материальными явлениями и объектами. Процессы химической технологии можно классифицировать по различным признакам: характеру используемых технологий, происхождению и характеру сырья, характеру и потребительским свойствам продуктов. Наиболее фундаментальным является отраслевой принцип классификации, определяющей принадлежность процессов к группам перерабатываемого сырья или потребительским свойствам производимых продуктов. В этом плане необходимо выделить следующие отрасли химической технологии. Неорганическая химическая технология, включающая в себя следующие подотрасли: 1. основной неорганический синтез, включающий в себя производство кислот, щелочей, солей, аммиака, минеральных удобрений на их основе и других неорганических веществ; 2. тонкий неорганический синтез – малотоннажные производства, но крайне важных для самой химической промышленности неорганических веществ: катализаторов; неорганических препаратов, реактивов, редких элементов, материалов для электроники, лекарственных веществ и др.; 3. технология силикатов – производство вяжущих и строительных материалов, керамических изделий, стекла и др.; Металлургия –производства черных и цветных металлов.
Слайд№1до, далее Слайд№2. Технология органических веществ, включающая в себя следующие подотрасли: 1. переработка ископаемого углеродсодержащего сырья - твердого топлива, нефти и газа – первичное разделение, очистка, облагораживание, конверсия углеводородного сырья; 2. нефтехимический синтез – производство органических продуктов и полупродуктов на основе переработки газообразных, жидких и твердых углеводородов, а также на основе оксидов углерода и водорода; 3. основной органический синтез – производство базовых продуктов органического синтеза, дающего начало всем остальным процессам более глубокой переработки органического сырья; 4. тонкий органический синтез – производство органических препаратов, реактивов, лекарственных веществ, душистых веществ, средств защиты растений и др.; 5. технология высокомолекулярных соединений, включающая в себя производство синтетических каучуков, пластмасс, химических волокон, пленок и др.; Технология переработки растительного и животного сырья. Слайд№2 до, далее Слайд№3. В соответствии с приведенной классификацией сырьевую основу соответствующей отрасли составляют: в неорганической химической технологии: · атмосферный азот и, в ограниченной степени, натриевая селитра, запасы которой быстро истощаются; · водород, который в промышленности производится конверсией и неполным окислением метана, конверсия твердого углеродного топлива, электролизом воды или водных растворов хлорида натрия; · кислород или воздух. Если необходимо иметь чистый кислород, то его сжижают при высоких давлениях и пониженной температуре, а затем подвергают фракционной перегонке. · Источником получения серной кислоты является элементарная сера, пирит и сульфиды цветных металлов. · Источником получения фосфорной кислоты и фосфат-содержащих удобрений являются фосфатные руды: апатиты и фосфориты. Источником получения серной кислоты в неорганическом синтезе и других продуктов на ее основе является элементарная сера, пирит и сульфиды цветных металлов. Источником получения фосфорной кислоты и фосфат-содержащих удобрений являются фосфатные руды: апатиты и фосфориты.
Слайд№3 до, далее Слайд№4. В этих рудах фосфор находится в нерастворимой форме, главным образом, в виде фторапатита Ca5F(PO4)5 и трикальций фосфата Ca3(PO4)2. Апатит – минерал, входящий в состав изверженных пород. В России на Кольском полуострове имеются крупнейшие залежи апатито-нефелиновые руды. Нефелин (K,Na)2O·Al2O3·2SiO2·2H2O – сырье алюминиевой промышленности. Апатито-нефелиновую породу, содержащую до 70% апатита и до 25% нефелина, разделяют флотацией на апатитовый концентрат, в состав которого входит до 40% P2O5 и нефелиновую фракцию, которая после повторного обогащения содержит до 30% Al2O3. Фосфориты – породы, содержание в которых P2O5 колеблется от 20 до 30%. Слайд№4 Первичным сырьем для производства органических веществ является природный газ, нефть, каменный уголь и, в меньшей степени, горючие сланцы и торф. Традиционные способы их переработки – пиролиз. Последние годы все большее значение приобретает синтез-газ, получаемый из всех перечисленных видов сырья путем парокислородной конверсии. Это особенно важно для твердых горючих ископаемых, залежей которых должно хватить на несколько сотен лет. Синтез-газ является основой для получения небольшой группы базовых продуктов органического синтеза, которые в сырьевом балансе промышленных органических продуктов составляют 90%. Сюда относятся этилен, ацетилен, пропилен, стирол, 1,3-бутадиен, бензол, толуол, ксилолы и др. Источником получения металлов в технически чистом виде, являются природные минералы, содержащие, как правило, часть пустой породы. Минералы руд представляют, в основном, оксиды и сульфиды металлов (Fe, Cu, Zn и др.), содержащие оксиды соединений, составляющих пустую породу. В черной металлургии к ним относятся Al2O3, SiO2, CrO, MgO и т.п. В то же время некоторые из этих оксидов могут служить рудами цветных металлов (например, Al2O3 в производстве алюминия). Химическая промышленность и смежные с ней отрасли, основанные на химических превращениях (нефтепереработка, нефтехимия, металлургия, целлюлозно-бумажная промышленность), являются крупнейшими потребителями энергии. Химические и нефтеперерабатывающие производства потребляют около 20% от энергопотребления всей промышленности. По расходу тепловой энергии химическая промышленность занимает второе место среди других отраслей хозяйственной деятельности, а по расходу электроэнергии – третье. Химические процессы подразделяются на экзо- и эндотермические. Слайд№4 до, далее Слайд№5.
Проведение эндотермических процессов требует дополнительного подвода тепла извне и поэтому, как правило, характеризуется гораздо большим энергопотреблением. В экзотермических процессах такого подвода обычно не требуется, так как тепло реакции может быть использовано для поддержания необходимого температурного режима. В высоко экзотермических процессах, протекающих при высоких температурах (400-600°С), часть избыточного тепла реакции может быть преобразовано в механическую энергию для транспортировки реагентов и продуктов, или создания повышенных давлений. Это дает существенную экономию энергии на производстве. Помимо затрат или экономии энергии, связанной с экзо- и эндотермичностью реакций, реализация любого химического производства связана с расходом энергии вспомогательных операций, таких как подготовка и транспортировка сырья, отвод продуктов, физические операции дробления, фильтрации, перемешивания, дистилляции и др.
Энергетические ресурсы разделяют на топливные (уголь, нефть, природный газ, сланец, битумные пески, торф, биомасса) и нетопливные (гидроэнергия, энергия ветра, лучистая энергия солнца и д.р.), возобновляемые и не возобновляемые, первичные и вторичные. Все возобновляемые энергетические ресурсы являются производными от энергии солнца, но в целях удобства их классифицируют по следующим категориям: солнечная энергия (прямая радиация); гидроэнергетические ресурсы (испарительно-конденсационный цикл); энергия ветра и волн; биомасса (растительного и животного происхождения). К практически неисчерпаемым относится геотермальные и термоядерные энергетические ресурсы, в геотермальные ресурсы включена глубинная теплота Земли, которая может быть использована как для теплоснабжения, так и для выработки электроэнергии. Термоядерные ресурсы (реакции синтеза) измеряются тепловыми эквивалентами преобразования дейтерия, содержащегося в морской воде и лития, находящегося в земной коре. К не возобновляемым энергетическим ресурсам относятся те, запасы которых по мере их добычи необратимо уменьшаются. К ним относятся: уголь, сланцы, нефть, битумные пески и природные газы. Все названные выше виды энергоресурсов относятся к первичным. Вторичными энергетическими ресурсами называется энергетический потенциал продукции, отходов, побочных и промежуточных продуктов, образующихся в технологических установках, который не используется в самих установках, может быть частично или полностью использован для энергоснабжения других установок. Например, вторичными энергоресурсами производства аммиака, наиболее энергоемкого в химической промышленности, являются жидкие углеводороды, танковые и продувочные газы, физическая теплота дымовых газов трубчатых печей и огневых подогревателей природного газа, физическая теплота конвертированных газов и синтез-газа. Вторичные энергетические ресурсы могут использоваться непосредственно без изменения вида энергоносителя для удовлетворения потребности в топливе или теплоте либо с изменением энергоносителя путем выработки теплоты, электроэнергии, холода или технической работы в утилизационных установках.
Топливо называют энергетическим, если его используют для получения электрической и тепловой энергии. Топливо, непосредственно используемое в различных установках, в том числе в промышленных печах и для коксования, называют технологическим. В зависимости от агрегатного состояния топлива подразделяют на твердое, жидкое и газообразное. К твердым топливам относятся бурые и каменные угли, антрациты, торф, сланцы и дрова, а также продукты их переработки: кокс, полукокс, брикеты торфяные и угольные, термоантрацит, древесный уголь; к жидким – нефть, газовый конденсат и продукты их переработки: бензин, керосин, дизельное топливо, мазут, смолы и т.п.; к газообразным – природный, нефтепромысловый (попутный) и шахтный газы, а также сжиженный нефтезаводской, коксовый, полукоксовый, генераторный, водяной, доменный и др. Глава I Слайд№5 до далее Слайд№6
§1 Основные технологические понятия и определения. Из рисунка 1.1 следует, что стадия 1 и 3 относится к физическим процессам, а вторая стадия – к химическим. Химические процессы неотделимы от химических реакторов, в которых они осуществляются. Показатели характеризующими эффективность работы аппаратов, реакторов, цехов и заводов в целом служат производительность:
где П – производительность в кг/час, т/сут или м3/сут и т.д.; m – масса продукта; τ – время. Для сравнения работы аппаратов и установок различного устройства и размеров, в которых протекают одни и те же химические процессы, используются понятие интенсивности. Интенсивность – это производительность, отнесенная в какой-либо величине, характеризующей размеры аппарата – к его объему или сечению.
где Vp – объем реактора в л или м3. Расход сырья, воды, энергии и различных реагентов, отнесенный в единице целевого продукта, называют расходным коэффициентом:
где Y – расход сырья в т/т (м3/т), энергии, кВт·ч/т и т.д. С лайд№6 до далее Слайд№7 Степень конверсии (превращения) – это отношение количества реагента, вступившего в реакцию, к его исходному количеству. Например, для реакции А→R; A→S
где xA – степень конверсии; m А,0, m А – масса реагента в начале и конце процесса; n А,0, n А – количество вещества в начале и конце процесса. Из уравнения (1.4) следует, что:
Или
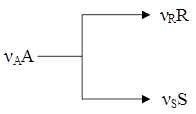
С лайд№8 до далее Слайд№9 Селективностью по продукту SR называется отношение количества целевого продукта к общему количеству получаемых продуктов. Селективность характеризует процессы, в которых протекают сложные параллельные и последовательные реакции с получением нескольких продуктов, что часто встречается на практике. Например, для реакции:
если целевым является продукт R, то селективность будет выражается в виде
где SR – селективность по продукту R; mR – масса продукта R, образовавшегося по целевой реакции. Селективность по направлению
где n (A → R) – соответствует количеству исходного реагента A, израсходованного на целевую реакцию; nR – количество, образовавшегося продукта R. С лайд№9 до далее Слайд№10 Скорость химической реакции определяется количеством прореагировавшего исходного вещества или продукта реакции в единицу времени в единице объема системы.
Например, скорость реакции А→R выражается уравнением:
или
где rA и rR – скорости реакции по реагенту A и R; nA и nR – число молей прореагировавшего вещества А и образовавшегося вещества R; τ – время реакции. Для реальных процессов число молей nA и nR может быть отнесено к объему реакционной смеси в реакторе (V см), к массе (mkt) или объему (Vkt) катализатора в случае гетерогенно-каталитических процессов. Если объем системы не изменяется в течение реакции, тогда:
Однако скорость реакции зависит от концентрации реагирующих веществ и температуры. Скорость реакции А→R, первого порядока имеет вид:
где k - константа скорости реакции. С лайд№10 до далее Слайд№11 Подставив в уравнение (1.17) значение CA = СА,0 (1-хА) получим:
Для реакции второго порядка 2 А→R имеем
Или
Материальные расчеты проводят, опираясь на вещественное выражение закона сохранения массы вещества, согласно которому во всякой замкнутой системе масса веществ, вступивших в реакцию, равно массе веществ, образовавшихся в результате этой реакции:
С лайд№11 до далее Слайд№12. Материальные расчеты проводят по уравнению основной суммарной реакции с учетом параллельных и побочных реакций. Материальные расчеты составляют для отдельных стадий или для процесса в целом. При этом учет массы веществ производится отдельно для твердой, жидкой и газовой фаз, поэтому в общем виде материальные балансы, например, для реакции:
Или
можно записать в следующем виде:
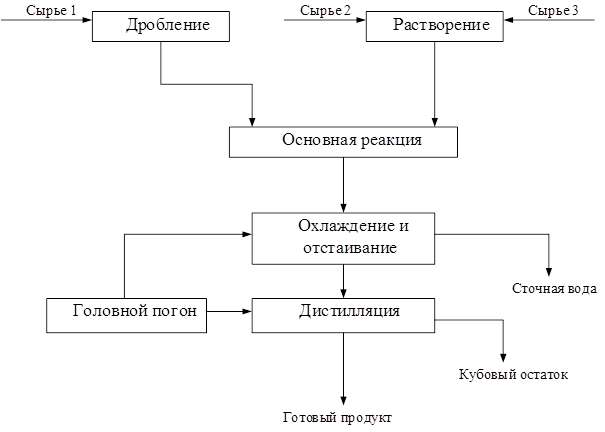
В этом уравнении ma и mb – масса веществ А и В в начале процесса; mr и ms – масса веществ R и S образующихся в результате процесса; В химической технологии различают теоретический и практический материальный баланс. Теоретический материальный баланс составляется на основе стехиометрических уравнений реакций, протекающих в рассматриваемом процессе, и молярных масс компонентов этих реакций. Практический материальный баланс отражает реальное положение дел в рассматриваемом процессе. Степень отклонения его показателей от теоретически возможных величин с одной стороны, характеризует уровень реализуемой технологии, а с другой – является движущей силой на пути его совершенствования. При составлении материальных балансов сложных производств, связанных с рециркуляцией сырья, растворителей, промывных вод, целесообразно составлять схему материальных потоков, на которой в наглядной форме представлены направления потоков сырья и промежуточных продуктов (рис. 1.2) Материальный расчет может быть составлен в кг, кг/час. Однако в действительности при химических реакциях вещества расходуются и образуются в мольных соотношениях и поэтому для материальных расчетов более удобно их количества выражать в молях (моль/час). Эти две величины, как известно, связаны между собой следующим соотношением:
где m – масса вещества в г или кг; М – солярная масса в г/моль или кг/кмоль; n – количество вещества в молях или кмолях. С лайд№12 до далее Слайд№13
Рис. 1.2 Схема материальных потоков. С лайд№13 до далее Слайд№14
Для количества веществ, выраженных числом молей уравнение (1.22) написать нельзя, так как во многих случаях во время реакции число молей изменяется. Однако, для любой реакции простой или сложной оказывается можно ввести понятие полноты химической реакции (μ), через которую можно легко рассчитать материальный баланс в молях. В частности, для простой реакции:
верно следующее равенство:
При этом величина μ будет всегда положительна и инвариантна в отношении участников реакции. Из уравнения (1.23) вытекает уравнение материального баланса Тогда:
по которому, зная ni ,0 и ni для одного из веществ, можно вычислить по формуле (1.23) значение μ, и затем по уравнению (1.24) мольные количества других веществ. Так, например, полагая, что 3С6Н10 = 2С6Н12+С6Н6 является простой реакцией можно вычислить мольные количества всех компонентов реакции, если известно,
По уравнению (1.24) определяем Полученные результаты сводим в таблицу материального баланса. В случае сложных реакций расчет материального баланса значительно усложняется. Это связано с тем, что до начала расчета материального баланса необходимо определить число независимых реакций и равное ему число ключевых веществ. С лайд№14 до, далее Слайд№15. Таблица 1.1 Материальный баланс процесса получения бензола. Компонент |
М, кг/кмоль |
Приход |
Расход | ||||||||||||||||||||||||||||||||||||||||||||||||||
| кмоль | кг | кмоль | кг | |||||||||||||||||||||||||||||||||||||||||||||||||||
| С6Н10 | 82,146 | 12,0 | 985,752 | 3,0 | 246,438 | |||||||||||||||||||||||||||||||||||||||||||||||||
| С6Н12 | 84,162 | - | - | 6,0 | 504,972 | |||||||||||||||||||||||||||||||||||||||||||||||||
| С6Н6 | 78,114 | - | - | 3,0 | 234,342 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Σ | - | 12,0 | 985,752 | 12,0 | 985,752 | |||||||||||||||||||||||||||||||||||||||||||||||||
При этом стехиометрически независимыми реакциями можно считать такие реакции, уравнения которых нельзя получить комбинацией уравнений других реакций (сложением, вычитанием, умножением стехиометрического коэффициента на постоянный множитель). В большинстве случаев это легко сделать исключением из системы сложной реакции зависимых реакций.
Так в системе сложных реакций дегидратации этанола:
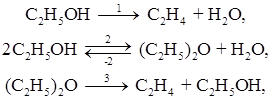
исключив реакцию -2 (как обратимую, зависимую от реакции 2) и 3 (уравнение которой можно получить вычислением уравнения 2 из уравнения 1) находим, что система имеет только две независимые реакции, то есть:
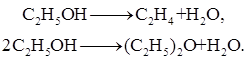
В более сложных случаях для определения числа независимых реакций обычно используют методы матричной алгебры, составляя стехиометрическую матрицу, строки и столбцы которой соответствуют реакциям и веществам. Определяют ранг матрицы, соответствующий числу независимых реакций. С лайд№15 до, далее Слайд№16.
Таблица 1.2 Стехиометрическая матрица процесса дегидратации этанола.
| № реакции | Вещество | |||
| С2Н5ОН | (С2Н5)2О | С2Н4 | Н2О | |
| 1 | -1 | 0 | +1 | +1 |
| 2 | -2 | +1 | 0 | +1 |
| -2 | +2 | -1 | 0 | -1 |
| 3 | +1 | -1 | +1 | 0 |
Примечание: ранг матрицы – это наивысший порядок минора матрицы, отличного от нуля. Здесь ранг матрицы равен 2, то есть числу независимых реакций.
Выбор ключевых веществ, как правило, осуществляется совместно с определением независимых реакций. Ключевые вещества определяются тем, чтобы в каждой независимой реакции участвовало хотя бы одно ключевое вещество, и в то же время выбранные ключевые вещества участвовали бы в одной или некотором минимуме независимых реакций. Анализ выше приведенной системы показывает, что ключевыми веществами являются (С2Н5)2О и С2Н4.
После анализа сложной системы превращений, то есть выбора независимых реакций и ключевых веществ достаточно легко провести ее материальный расчет. Для каждой независимой реакции по аналогии с (1.23) можно записать:
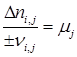 , ,
| (1.25) |
где i –соответствует веществу, j – реакции.
Тогда, имея в виду, что каждое вещество может участвовать в нескольких реакциях Δ ni = Σ Δ ni , j, получаем:
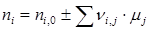 . .
| (1.26) |
Зная Δ ni ,0 и ni для ключевых веществ, можно в начале по уравнению (1.25) найти μj, а зачем полный состав реакционной массы по уравнению (1.26).
Таблица1.3 Материальный баланс реакции дегидратации этанола.
| Компонент | М, кг/кмоль | Приход | Расход | ||
| кмоль | кг | кмоль | кг | ||
| С2Н5ОН | 46 | 1000 | 46000 | 300 | 13800 |
| С2Н4 | 28 | - | - | 300 | 8400 |
| (С2Н5)2О | 74 | - | - | 200 | 14800 |
| Н2О | 18 | - | - | 500 | 9000 |
| Σ | - | 1000 | 46000 | 1300 | 46000 |
Как уже отмечалось данные материального баланса используются для расчета степени конверсии, выхода и селективности по целевому продукту.
С лайд№17 до, далее Слайд№18.
Из таблицы 1.3 следует, что
· степень конверсии этанола
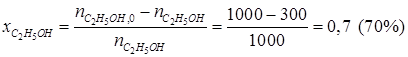 ,
,
· селективность по целевому направлению
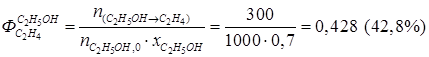 ,
,
· выход по этилену
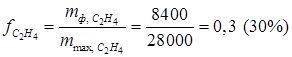 ,
,
· селективность по продукту С2Н4
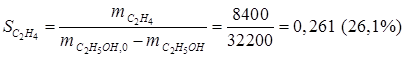 ,
,
· выход С2Н4 на пропущенное сырье
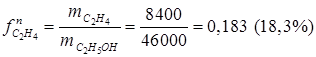 .
.
Или
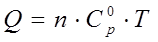 , ,
| (1.29) |
где m – масса вещества участвующего в реакции в кг; n – количество вещества участвующего в реакции в молях (кмолях); 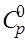 – теплоемкость вещества, Дж/кг∙гр (Дж/моль∙К); Т – температура в К.
– теплоемкость вещества, Дж/кг∙гр (Дж/моль∙К); Т – температура в К.
Массы (моли) вещества в этом уравнении берут из материального баланса, температура обычно задана отчетом об исследовательской работе. Теплоемкости находят в справочниках физико-химических величин, а при отсутствии их в справочниках – вычисляют по эмпирических уравнениям.
Для ориентировочных расчетов можно пользоваться практическими данными, согласно которым теплоемкости большинства жидкостей в ккал/кг∙гр составляют 0.4-0.6, а большинства органических соединений равны 0.3-0.4; исключением являются галоидзамещннные углеводороды, теплоемкости которых равны 0.15-0.35 ккал/кг∙гр, а также вода, аммиак и ряд других веществ, о теплоемкостях которых имеются экспериментальные данные.
Тепловой эффект процесса представляет собой суммарное количество тепла, которое выделяется или поглощается при протекании химических реакций и сопровождающих их физико-химических процессов (растворение, испарение и т.д.).
Тепловые эффекты некоторых химических реакций приведены ниже:
| Реакция |  ,кДж/моль ,кДж/моль
| Примечание |
| C6H6+HNO3=C6H5NO2+H2O | 122,88 | Бензол жидкий |
| C6H5NO2+2H2= C6H5NH2+H2O | 468,92 | Нитробензол в виде пара |
| C6H5OH+NH3=C6H5NH2+H2O | 11,723 | |
| C6H5NO2+HNO3=C6H4(NO2)2+H2O | 107,18 | Нитробензол жидкий |
С лайд№20 до, далее Слайд№21.
При отсутствии данных о значениях теплового эффекта химической реакции его чаще всего определяют по теплотам образования, используют для этих целей закон Гесса, математическая интерпретация которого имеет вид:

| (1.30) |
 , ,
|
где  - тепловой эффект химической реакции в стандартных условиях, кДж/моль;
- тепловой эффект химической реакции в стандартных условиях, кДж/моль; 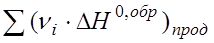 - сумма теплот образования веществ, образующихся при химическом взаимодействии;
- сумма теплот образования веществ, образующихся при химическом взаимодействии; 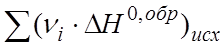 - сумма теплот образования исходных веществ, вступающих в химическое взаимодействие.
- сумма теплот образования исходных веществ, вступающих в химическое взаимодействие.
Значения энтальпийных эффектов химических реакций зависят от температуры и давления, при которых проводятся реакции. При относительно невысоких давлениях влиянием его обычно пренебрегают.
Влияние температуры на величину энтальпийного эффекта выражается законом Кирхгофа:
 . .
| (1.31) |
Если разность температур невелика, то можно принять среднее значение разности теплоемкости веществ участников реакции постоянной.
Тогда
 . .
| (1.32) |
Или
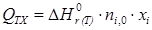 , ,
| (1.38) |
где nj – количество (в молях) образовавшегося продукта; ni ,0 – количество (в молях) реагента; xi – степень конверсии реагента.
Основной целью расчета теплового баланса является определение тепла необходимого для нагревания и охлаждения аппарата QF. Например, для реакции
А + В = С + D – Qp
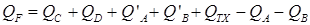
| (1.39) |
Или
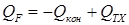 , ,
| (1.40) |
где  – конвективный перенос тепла. С лайд№23 до, далее Слайд№24.
– конвективный перенос тепла. С лайд№23 до, далее Слайд№24.
Зная QF можно рассчитать необходимую поверхность теплообмена при заданном времени охлаждения или нагревания, или времени охлаждения (нагревания) при заданной поверхности в периодических процессах.
В обоих случаях исходят из общеизвестного уравнения теплопередачи:
· для периодических процессов
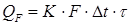 , ,
| (1.41) |
· для непрерывных процессов
 . .
| (1.42) |
В этом уравнении QF – количество передаваемого тепла; К – коэффициент теплопередачи; F – поверхность теплообмена; Δ t – средняя разность температур между реакционной массой и теплоносителем (хладагентом); τ – время проведения процесса.
Если возникает необходимость определения тепла на нагрев реакционной массы перед началом процесса или охлаждения ее в конце процесса, то для этих целей используют уравнение:
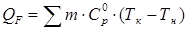 , ,
| (1.43) |
где m – масса веществ, входящих в состав реакционной массы; 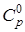 - теплоемкость отдельных веществ; T к и T н – конечная и начальная температуры реакционной смеси.
- теплоемкость отдельных веществ; T к и T н – конечная и начальная температуры реакционной смеси.
С лайд№24 до, далее Слайд№25.
Как уже отмечалось, энергетические расчеты предполагают также расчет расходов теплоносителей для обогрева реакционной массы или хладагентов для ее охлаждения.
В качестве теплоносителей наиболее широко используется пар. Расход пара можно определить по уравнению:
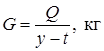 , ,
| (1.44) |
где Q – расход тепла, кДж; y – теплосодержание пара, кДж/кг; t – температура конденсата, которую можно принять равной температуре пара, численно равная теплосодержанию конденсата в кДж/кг.
Наиболее распространенными охлаждающими агентами являются вода, рассол, воздух. Расход охлаждающих агентов определяется по формуле:
 , ,
| (1.45) |
где Q – количество тепла, которое надо отвести, кДж; 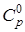 - теплоемкость охлаждающего агента; t к и t н – конечная и начальная температура хладагента, °С.
- теплоемкость охлаждающего агента; t к и t н – конечная и начальная температура хладагента, °С.
Вопросы и упражнения для самостоятельной
Проработки материала
1. Из каких основных стадий состоит химико-технологический процесс. В каких стадиях процесса участвуют химические реакции?
2. Какие вы знаете технологические критерии эффективности химико-технологического процесса? Дайте их определения.
3. В чем различие между полной (интегральной) и мгновенной (дифференциальной) селективностями?
4. Рассчитайте селективность по продукту, если при проведении последовательных реакций A → R + M (целевая); A → S + N (побочная) получено 40 кг продукта R и 105 кг продукта S?
5. Протекают последовательные реакции A + N → S + D целевым продуктом которых является вещество R. Определите выход продукта R, степень превращения xA, если известен конечный состав реакционной смеси: nA ,0 = 2 кмоль, nA = 0,5 кмоль.
6. Дайте определение скорости реакции и запишите их выражения для реагентов и продуктов реакции A + B → C + D.
7. Каким уравнением описывается зависимость скорости реакции от концентрации реагирующих веществ?
8. Сформулируйте закон сохранения массы вещества и запишите его для реакции A + R → N.
9. Как определяется полнота простой и сложной реакции?
10. Для каких целей используется закон Гесса? Запишите его уравнение для реакции A + B → R + N + Qp.
11. Как определяется тепло, которое выделяется в процессе химической реакции и которое учитывается при составлении теплового баланса? Напишите уравнения.
12. Напишите уравнения Кирхгофа и проинтегрируйте его в различных вариантах.
13. Напишите уравнение теплового баланса для реакции A → B; A → S + R и прокомментируйте его.
ОХТ лекция№1.
ВВЕДЕНИЕ
Глава I Химико-технологический процесс и его содержание
§1 Основные технологические понятия и определения
Материальный баланс химических процессов
 ,
,
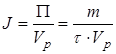 ,
,
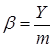 ,
,
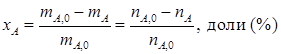 ,
,

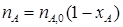
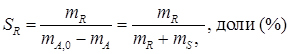 ,
,
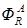 выполняется по мольным количествам (или мольным потокам), например:
выполняется по мольным количествам (или мольным потокам), например: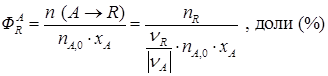 ,
,


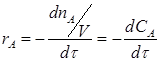 .
.
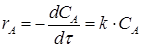 ,
,
 .
.

 .
.
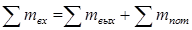 .
.

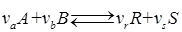
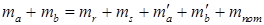 .
.
 и
и  – масса веществ А и В не вступившие в реакцию по различным причинам; m пот – технологические потери.
– масса веществ А и В не вступившие в реакцию по различным причинам; m пот – технологические потери.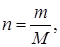
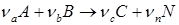
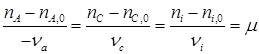 .
.
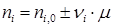 ,
,
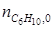 = 12 кмоль;
= 12 кмоль; 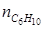 = 3 кмоль. Тогда по уравнению (1.23) находим:
= 3 кмоль. Тогда по уравнению (1.23) находим: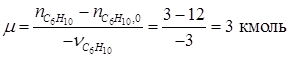 .
.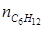 = 0 + 2∙ μ = 0 + 2∙3=6 кмоль;
= 0 + 2∙ μ = 0 + 2∙3=6 кмоль; 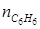 = 0 + +1∙ μ = 0 + 1∙3=3 кмоль.
= 0 + +1∙ μ = 0 + 1∙3=3 кмоль.


