
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Возможность коррозии с водородной и кислородной деполяризацией
Коррозия как самопроизвольный процесс возможна при: Так как Если 1. Если В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере. В этом случае железо будет анодом (E0 = –0,44В), а медь – катодом (E 0=+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризации ионами водорода, которые присутствуют в электролите: А: Fe – 2e → Fe2+ – окисление К: 2 H+ + 2e → H2 – восстановление Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом: A (–) Fe | HCl | Cu (+) К В нейтральной среде коррозия протекает с кислородной деполяризацией, т. е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде: (А) Fe – 2e → Fe2+ – окисление; (К) 2 H2O + O2 + 4e → 4 OH– – восстановление. Схема короткозамкнутого гальванического элемента: А (–) Fe | H2O, O2 | Cu (+) К. У поверхности металла в электролите протекают следующие реакции: Fe2+ + 2 OH– → Fe(OH)2; 4 Fe(OH)2 + O2 + 2 H2O → 4 Fe(OH)3. Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции. 2. Если Таким образом, при контакте раствора электролита с металлами большинство металлов может корродировать с поглощением О2 и лишь некоторые металлы – с выделением Н2. Защита металлов от коррозии
Все методы защиты от коррозии делятся на группы: 1) легирование металлов; 2) защитные покрытия (металлические и неметаллические); 3) электрохимическая защита; 4) изменение свойств коррозионной среды; 5) рациональное конструирование. 1. Легирование металлов. Это эффективный, (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивность металла. В качестве таких компонентов применяют Ti, Сr, Ni, W и др. Широкое применение нашло легирование для защиты от газовой коррозии. Введение некоторых добавок к сталям (титана, хрома, меди и никеля) приводит к тому, что при коррозии образуются плотные продукты реакции, предохраняющие сплав от дальнейшей коррозии. При этом используют сплавы, обладающие жаростойкостью и жаропрочностью. Жаростойкость обычно обеспечивается легированием металлов и сплавов, например, стали хромом, алюминием и кремнием. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов, например, SiO2, Al2O3 и Cr2O3. Легирование также используется с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода. К коррозионным сплавам, например, относятся нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы. 2. Металлические покрытия. Используют как чистые металлы (Zn, Cd, Al, Ni, Cu, Cr, Ag и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на анодные и катодные. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. При повреждении покрытия (или наличия пор) возникает коррозионный элемент, в котором основной металл в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае:
А (–) Fe | H2O, O2 | Sn (+) К; на аноде: Fe – 2e → Fe2+; на катоде: 2 H 2 O + O 2 + 4e → 4 OH – Fe2+ + 2 OH– → Fe(OH)2 Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент: А (–) Cr | H2O, O2 | Fe (+) К на аноде: Cr – 2e → Cr2+ на катоде: 2 H2O + O2 + 4e → 4 OH– _____________________________________ . Cr2+ + 2 OH– → Cr(OH)2 Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3: 4 Cr(OH)2 + 2H2O + O2 → 4 Cr(OH)3. Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 катодное, а в растворе органических кислот – анодное. Таким образом, в результате электрохимической коррозии разрушается анодное покрытие. При сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически. Неметаллические защитные покрытия. Они могут быть как неорганическими, так и органическими. Защитное действие таких покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной. Эмалированию подвергают черные и цветные металлы, которые используют при производстве аппаратуры в фармацевтической, химической, пищевой отраслях промышленности, при производстве изделий домашнего обихода. Некоторые защитные покрытия образуются непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных пленок (оксидных) в технике называют оксидированием. Процессы нанесения оксидных пленок (Fe2O3) называют воронением, электрохимическое оксидирование алюминия – анодированием. Лакокрасочные покрытия наиболее распространены и незаменимы. Лакокрасочное покрытие должно быть сплошным, беспористым, газо - и водонепроницаемым, химически стойким, обладать высоким сцеплением с материалом, механической прочностью и твердостью. 3. Электрохимическая защита. Этот метод защиты основан на торможении анодных или катодных реакций коррозионного процесса. Катодная поляризация (защита)используется для защиты от коррозии подземных трубопроводов, кабелей. Катодную защиту применяют также к подводным лодкам, водным резервуарам, буровым платформам и оборудованию химических заводов. Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. Вспомогательный электрод (анод) растворяется
а на защищенном сооружении (катоде) выделяется Н2:
Разработана также защита металла от коррозии наложением анодной поляризации. При анодной защите защищаемый металл при растворении покрывается пассивной пленкой:
Этот метод применим лишь к металлам и сплавам, способным легко пассивироваться при смещении их потенциала в положительную сторону (никель, железо, хром, титан и др.). Анодную защиту применяют например, для предотвращения коррозии нержавеющих сталей при контакте с H2SO4. 4. Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах коррозия обычно протекает с поглощением кислорода. Его удаляют деаэрацией (кипячение, барботаж инертного газа) или восстанавливают с помощью соответствующих восстановителей (сульфиты, гидразин т. п.). Агрессивность среды может уменьшаться также при снижении концентрации ионов Н+, т. е. повышении рН (подщелачивании). Для защиты от коррозии широко применяют ингибиторы. Ингибитором называется вещество, при добавлении которого в среду, где находится металл значительно уменьшается скорость коррозии металла. По составу различают ингибиторы органические и неорганические. По механизму своего действия на процесс электрохимической коррозии ингибиторы подразделяют на адсорбционные и пассивационные. Механизм действия адсорбционных ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности и последующем торможении катодных или анодных процессов (органические вещества, содержащие N, P, S, O, Si) пиридин C6H5N, уротропин N4(CH2)4, формальдегид CH2O. Пассивационные ингибиторы вызывают образование на поверхности металла защитных пленок и пассивацию металла. К ним относятся неорганические окислители, например NaNO2, Na2Cr2O7, H2O2, и вещества, образующие с ионами корродирующего металла малорастворимые соединения (полифосфаты, силикаты и карбонаты натрия, соединения кальция, магния и др.).
5. Рациональное конструирование изделий должно исключать наличие или сокращать число и размеры особо опасных, с точки зрения коррозии, участков в изделиях или конструкциях (сварных швов, узких щелей, контактов разнородных по электродным потенциалам металлов и др.), а также предусматривать специальную защиту металла этих участков от коррозии. Защита от коррозии блуждающими токами. Токи, ответвляющиеся от своего основного пути, называются блуждающими. Источниками блуждающих токов могут быть различные системы и устройства, работающие на постоянном токе, например железнодорожные пути электропоездов, трамвайные линии, заземления постоянного тока, установки для электросварки, электролизные ванны, системы катодной защиты и т. д. Коррозия металлов под влиянием электрического тока от внешнего источника называется электрокоррозией. В качестве примера рассмотрим электрокоррозию подземного трубопровода во влажной почве. Схема возникновения блуждающего тока от трамвайной линии, где стальные рельсы ипользуются для возвращения тока к генераторной станции, показана на рис. 8.6.
Борьба с блуждающими токами заключается, прежде всего, в их уменьшении. Для электрифицированных железных дорог, у которых рельсы служат обратными проводами, это достигается поддержанием в хорошем состоянии электрических контактов между рельсами и почвой. Коррозия блуждающими токами прекращается при соединении металлическим проводником с низким сопротивлением эксплуатируемой трубы с рельсами в зонах К1 – А1 (рис. 8.6). Это называется дренажом. В случае невозможности защиты с помощью дренажа закапывают параллельно рельсам специальный анод из чугунного лома и с помощью медного проводника присоединяют его к зоне К1. Решение типовых задач Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральной и кислой средах. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии? Решение. Цинк имеет более отрицательный потенциал (–0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий – катодом. Zn0-2ē→Zn2+; катодный процесс: в кислой среде 2Н+ + 2ē → Н2; в нейтральной среде О2+Н2О+4ē→ОН-. Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(ОН)2. Пример 2. 1. Склепаны два металла. Укажите, какой из металлов подвергается коррозии: а) Mn – Al; б) Sn – Bi. Решение. а) Al в ряду напряжений находится перед марганцем и имеет более отрицательное значение стандартного электродного потенциала, поэтому при контакте этих двух металлов Al будет анодом, а Mn - катодом. Окисляться, т. е. подвергаться коррозии, будет алюминий.
б) В этом случае корродировать будет олово, т. к. в ряду напряжений оно расположено впереди висмута и, следовательно, является электрохимически более активным. Пример 3. Какие из нижеперечисленных металлов выполняют для свинца роль анодного покрытия: Pt, Al, Cu, Hg? Решение. Анодное покрытие – это нанесение на защищаемое изделие электрохимически более активного металла. Из перечисленных металлов электрохимически более активным (по сравнению со свинцом) является алюминий (см. ряд напряжений металлов). Пример 4. Какие из нижеперечисленных металлов выполняют для свинца роль катодного покрытия: Ti, Mn, Ag, Cr? Решение. Катодное покрытие – это нанесение на защищаемое изделие электрохимически менее активного металла. Из перечисленных металлов электрохимически менее активным (по сравнению со свинцом) является серебро (см. ряд напряжений металлов). Пример 5. Стальное изделие имеет цинковое покрытие. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в нейтральную среду при рН 7? Подсчитайте ЭДС коррозионного элемента при стандартных условиях. При каких значениях рН прекратится процесс выделения водорода? Решение. Равновесные потенциалы водорода и кислорода, при их парциальных давлениях равных, определяем по уравнениям: ЭДС коррозионных микроэлементов равны:
2Н2О + 2е → 2ОН- + Н2
1/2О2 + Н2О + 2е → 2ОН-. Процесс выделения водорода прекратится, если Е' < 0, т. е. – 0,059 рН – (-0,763) < 0, откуда следует, что при рН < 12,9 Е' < 0; при этом процесс будет иметь место при любых значениях рН. 8.7. Задачи для самостоятельного решения 1. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составьте электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции. 2. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов. 3. Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях? 4. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель. Какие продукты коррозии образуются в первом и во втором случаях? 5. В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов. 6. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа? 7. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Какой состав продуктов коррозии? 8. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником? 9. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий – железо. Какие продукты коррозии образуются в первом и во втором случаях? 10. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов коррозии. Каков состав продуктов коррозии? 11. Одно железное изделие покрыли никелем, другое – оловом. Какие это покрытия? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия в кислой среде. В каком случае коррозия будет происходить активнее? 12. Трущиеся поверхности гребных валов защищают от коррозии, применяя облицовки из бронзы (сплава меди с оловом). Составьте схему коррозии стального вала в морской воде при появлении в облицовке трещин.
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 303; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.200.180 (0.048 с.) |
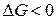 , так как
, так как 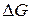 реакции связана с ЭДС элемента
реакции связана с ЭДС элемента 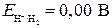 уравнением
уравнением 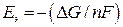 , то следовательно если
, то следовательно если 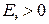 , то коррозия возможна.
, то коррозия возможна.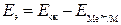 (ЭДС элемента равна разности потенциалов окислителя и восстановителя), то коррозия возможна, если
(ЭДС элемента равна разности потенциалов окислителя и восстановителя), то коррозия возможна, если 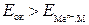 - (1).
- (1).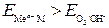 , то коррозия металла невозможна (Au не может корродировать с поглощением О2 и выделением Н2).
, то коррозия металла невозможна (Au не может корродировать с поглощением О2 и выделением Н2).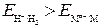 , то коррозия возможна с выделением Н2 и поглощением О2.К таким металлам относятся щелочные и щелочноземельные металлы.
, то коррозия возможна с выделением Н2 и поглощением О2.К таким металлам относятся щелочные и щелочноземельные металлы.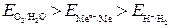 , то коррозия возможна с поглощением О2 и невозможна с выделением Н2. Большинство металлов могут корродировать с поглощением О2.
, то коррозия возможна с поглощением О2 и невозможна с выделением Н2. Большинство металлов могут корродировать с поглощением О2.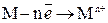 ,
,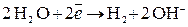 .
.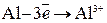 или
или 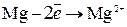 ,
а на изделии выделяется водород:
,
а на изделии выделяется водород:
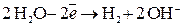 .
.
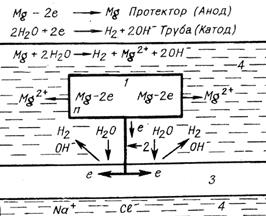 Рис.8.5. Схема протекторной защиты стального трубопровода магнием в морской воде: 1 –протектор; 2 – соединительный провод: 3 – трубопровод; 4 – морская вода
Рис.8.5. Схема протекторной защиты стального трубопровода магнием в морской воде: 1 –протектор; 2 – соединительный провод: 3 – трубопровод; 4 – морская вода
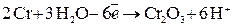 .
.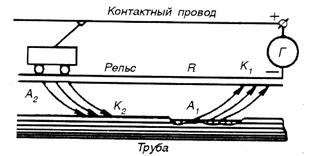 Рис. 8. 6. Схема коррозии трубопровода блуждающими токами
Рис. 8. 6. Схема коррозии трубопровода блуждающими токами
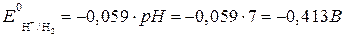 ,
,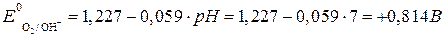 .
.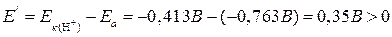 – процесс с выделением водорода возможен
– процесс с выделением водорода возможен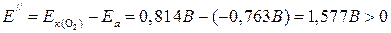 – процесс с поглощением кислорода возможен
– процесс с поглощением кислорода возможен


