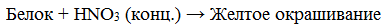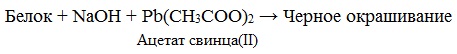Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
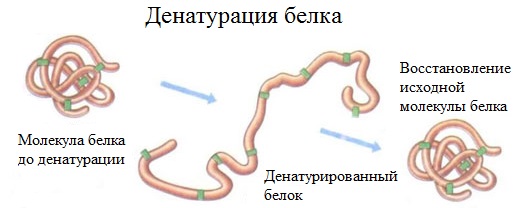
Денатурация белка (необратимое осаждение, свертывание) ⇐ ПредыдущаяСтр 4 из 4
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка. Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы. Денатурация бывает обратимой и необратимой. Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи. Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+). Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Гидролиз белков Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков. Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул. В лабораторных условиях и в промышленности проводится кислотный гидролиз. В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
Цветные (качественные) реакции на белки Для белков известно несколько качественных реакций. а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца) Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
б) Биуретовая реакция (на пептидные связи) Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
в) Цистеиновая реакция Фоля (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
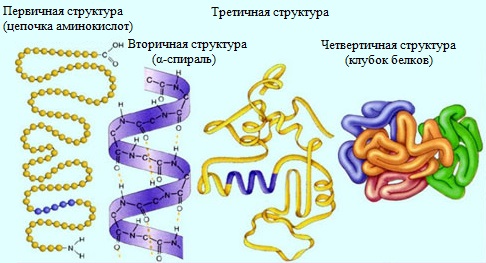
Строение белка Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
Первичная структура белка - определенная последовательность a-аминокислотных остатков в полипептидной цепи. Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве. Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).
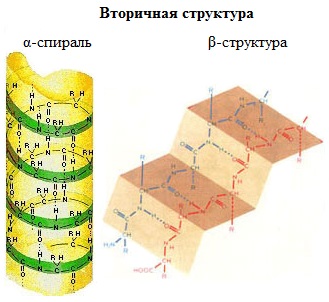
Вторичная структура белка - конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль. Существует два основных способа укладки цепи. Одна из моделей вторичной структуры - a-спираль. Другая модель – β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи. В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль. В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями. Большинство белков содержит как α-спирали, так и β-структуры. Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий.
Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами. Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом. Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α- и β-цепей и гема. Денатурация белков — изменение нативной конформации белковой молекулы под действием различных дестабилизирующих факторов. Аминокислотная последовательность белка не изменяется. Приводит к потере белками их естественных свойств (растворимости, гидрофильности и др.). Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют п лавлением молекулы. Практически любое заметное изменение внешних условий, например, нагревание или существенное изменение рН приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжёлых металлов, некоторых растворителей спирт),радиации и др. При денатурации разрушается четвертичная, третичная и вторичная структуры. Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц. Ренатурация — процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Не все белки способны ренатурировать; у большинства белков денатурация необратима. При нагревании двухцепочечных молекул ДНК до температуры около 100°C водородные связи между основаниями разрываются, и комплементарные цепи расходятся — ДНК денатурирует. Однако при медленном охлаждении комплементарные цепи могут вновь соединяться в регулярную двойную спираль. Эта способность ДНК к ренатурации используется для получения искусственных гибридных молекул ДНК (так называемая молекулярная гибридизация). Деструкция - разрушение белка до аминокислот под действием теплового шока, электрического тока, сильной радиации.
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 1154; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.66.206 (0.011 с.) |