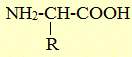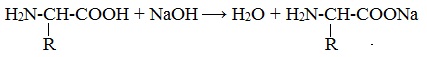Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 10. Белки и белковые полимеры. Синтез белка. Днк и рнк.Стр 1 из 4Следующая ⇒
Лекция 10. Белки и белковые полимеры. Синтез белка. ДНК и РНК. Амнокислоты Аминокислоты – органические бифункциональные соединения, в состав которых входят две функциональные группы: карбоксильная – СООН и аминогруппа -NH2. Аминокислоты – амфотерные соединения. Аминокислоты можно рассматривать как карбоновые кислоты, в молекулах которых один или несколько атомов водорода углеводородного радикала замещены аминогруппами.
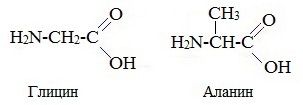
В природе встречаются в основном α-аминокислоты, составляющих белки (кроме пролина). Они имеют общую формулу
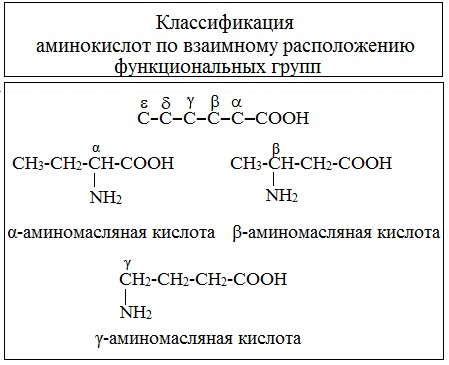
где R – углеводородный радикал, который может содержать различные функциональные группы (-SH, –OH, –COOH, NH2) и кольца. Специфичность каждой аминокислоты определяется строением радикала R. Боковой радикал у различных аминокислот имеет разную структуру. В качестве структурных элементов (мономеров) в составе белков обнаруживаются 20 различных аминокислот (см. таблицу), таким образом, в белках встречаются 20 различных по структуре боковых цепей. Как видно из таблицы, самым простым боковым радикалом является атом водорода (аминокислота глицин). Карбоксильная группа свободной аминокислоты может при нейтральных значениях рН диссоциировать, отдавая в раствор протон (H+) и приобретая отрицательный заряд. Аминогруппа свободной аминокислоты может присоединять протон и приобретать положительный заряд, подобно тому как аммиак превращается в ион аммония. Поэтому при нейтральных рН аминокислоты находятся в состоянии цвиттер-иона — иона (от нем. zwitter - двойной), одна часть которого имеет положительный, а другая часть — отрицательный заряд. I. Классификация по взаимному положения функциональных групп В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, b-, g-, d-, e- и т. д.
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. II. Классификация по строению бокового радикала (функциональным группам) Алифатические аминокислоты Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин. Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутомат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
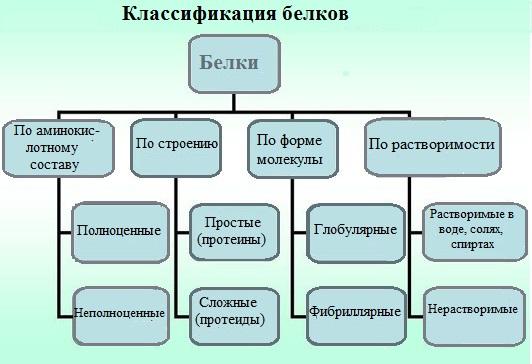
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин Диаминомонокарбоновые кислоты (содержат NH2-группу):лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд). Серусодержащие кислоты: цистеин, метионин. Ароматические аминокислоты: фенилаланин, тирозн, триптофан. Гетероциклические аминокислоты: триптофан, гистидин, пролин. Иминокислоты: пролин Неполярные (гидрофобные) К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота: — алифатические: аланин, валин, лейцин, изолейцин — ароматические: фенилаланин, триптофан. — серусодержащие: метионин — иминокислота: пролин. Полярные незаряженные Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды. К ним относятся аминокислоты, содержащие: — полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин — HS-группу: цистеин — амидную группу: глутамин, аспарагин — и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы). Основные Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин. Кислые Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты. Все остальные аминокислоты относятся к нейтральным. Белки В основу классификации белков положены их физико-химические и химические особенности. Белки классифицируют по нескольким признакам.
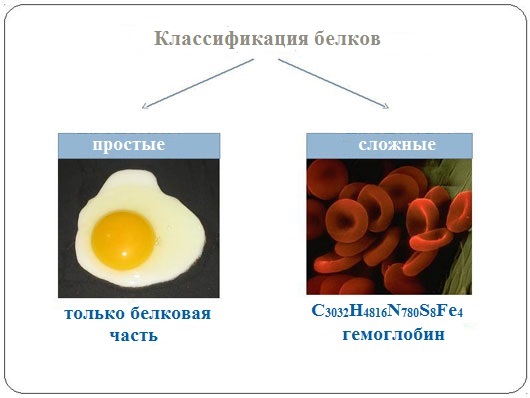
По строению По химическому строению молекул все белки подразделяют на простые и сложные. Простые белки (протеины) состоят только из аминокислот. Сложные белки (протеиды) состоят из глобулярных белков и небелкового компонента. Небелковая часть сложного белка называется простетической группой.
Простетическая группа может быть представлена различными по химической природе соединениями. В зависимости от ее строения и свойств сложные белки подразделяются: · хромопротеины – содержат в качестве небелковой части окрашенный компонент (гемоглобин, миоглобин, цитохромы, хлорофилл); · гликопротеины – содержат углеводы; · нуклеопротеины – содержат нуклеиновые кислоты; · липопротеины – содержат липиды; · фосфопротеины – содержат остаток ортофосфорной кислоты; · металлопротеины – содержат комплексно связанный металл.
Простые белки К простым белкам относят альбумины, глобулины, протамины, гистоны, проламины, глютелины, протеиноиды. Альбумины и глобулины белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. На долю альбуминов приходится более половины белков плазмы крови. Альбумины Альбумины – составляют основную часть белков животных и растительных тканей. Альбумины – это глобулярные белки. Альбумины – белки относительно небольшой молекулярной массы 25000-70000, они имеют выраженный кислый характер, так как содержат большое количество аспарагиновой и глутаминовой кислот. Характерным свойством альбуминов является их высокая адсорбционная способность. Они адсорбируют полярные и неполярные молекулы, выполняя транспортную роль. Они транспортируют гормоны, холестерол, билирубин, лекарственные вещества, ионы кальция. Глобулины Глобулины – широко распространённая группа глобулярных белков, обычно сопутствующая альбуминам. Глобулины имеют более высокую молекулярную массу, чем альбумины. Глобулины слабокислые или нейтральные белки. Глобулины растворимы в слабых солевых растворах, не растворимы в дистиллированной воде и выпадают в осадок при 50% и более насыщении растворов сернокислым аммонием, при нагревании свертываются. К глобулинам относятся сывороточный, молочный, яичный, мышечный и другие глобулины. Протамины Протамины – низкомолекулярные положительно заряженные ядерные белки с резко выраженными основными свойствами (щелочные белки), с низкой молекулярной массой – 4000 – 12000, содержат 60-85% аргинина. Протамины являются составной частью многих важных сложных белков (нуклеопротеидов), входящих в состав клеточных ядер. В ядрах клеток они находятся в комплексе с ДНК. Гистоны Гистоны представляют собой низкомолекулярные (11000 – 22000) белки с третичной структурой, обладают выраженными основными (щелочными) свойствами, т.к. содержат большое количество аргинина и лизина. Гистоны содержатся в ядрах клеток высших организмов в соединении с нуклеиновыми кислотами, образуя нуклеопротеиды. Гистоны играют важную роль в регуляции генной активности. Протеиноиды Протеиноиды – фибриллярные белки, их молекулы образуют многомолекулярные нитевидные комплексы – фибриллы. Протеиноиды – белки животного происхождения, богаты глицином, пролином, цистином. Они могут иметь третичную и четвертичную структуры. Протеиноиды – белки опорных тканей (костей, хрящей, сухожилий, связок). Они представлены коллагеном, эластином и кератином. К протеиноидам относятся коллаген – основной белок кожи, костей и хрящей, эластин – белок сухожилий и соединительной ткани, кератин – белок волос, шерсти, копыт, рогов и фиброин шелка.
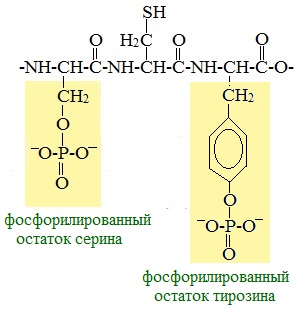
Сложные белки Фосфопротеины Фосфопротеины – это сложные белки, простетической группой которых является остаток фосфорной кислоты. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т.е. тех аминокислот, которые содержат ОН-группу.
К белкам этого класса относятся: · казеин молока, в котором содержание фосфорной кислоты достигает 1%; · вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца; · овальбумин, открытый в белке куриного яйца; · ихтулин, обнаруженный в икре рыб и, который играет немаловажную роль в развитии эмбриона рыб. Биологическая роль фосфопротеинов заключается в том, что они являются питательными веществами необходимыми для растущих организмов. Гликопротеины Гликопротеины (гликоконъюгаты) – это сложные белки, которые содержат в качестве простетической группы углеводный компонент. Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани. Многие ферменты и транспортные белки являются гликопротеинами. Гликопротеины разделяют на истинные гликопротеины и протеогликаны. Функциии гликопротеинов 1. Структурная – коллаген, эластин. 2. Защитная – антитела (иммуноглобулины), интерферон, факторы свертывания крови (протромбин, фибриноген). 3. Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ. 4. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны. 5. Ферментативная – ферменты: холинэстераза, нуклеаза. 6. Транспортная – перенос веществ в крови и через мембраны (трансферрин, транскортин, альбумин, Na+,К+-АТФаза). Протеогликаны Особую группу гликопротеинов составляют протеогликаны, в составе которых углеводный компонент преобладает и на его долю приходится от 90% и выше. Более того, эти вещества по своим свойствам более сходны с полисахаридами, чем с белками.
Нуклеопротеины Нуклеопротеины (ДНП и РНП) – это сложные белки, простетической группой которых являются нуклеиновые кислоты (РНК и ДНК). В природе обнаружено 2 типа нуклеопротеинов – дезоксирибонуклеопротеины (ДНП) – комплексы белков с дезоксирибонуклеиновой кислотой (ДНК) и рибонуклеопротеиды (РНП) – комплексы белков с рибонуклеиновой кислотой (РНК).
Липопротеины Липопротеины – сложные белки, простетическая группа которых представлена каким-либо липидом. Липиды играют важную роль в организме человека. Они содержатся во всех клетках и тканях и участвуют во многих обменных процессах. Они составляют структурную основу всех биологических мембран, в свободном состоянии присутствуют в основном в плазме крови и лимфе. Липопротеины плазмы, сыворотки крови растворимы в воде. Липопротеины мембранных стенок клеток, нервных волокон нерастворимы в воде. В состав липопротеинов могут одновременно входить свободные триглицериды, жирные кислоты, нейтральные жиры, фосфолипиды и холестерин (холестерол). Хромопротеины Хромопротеины («цветные белки») – сложные белки, содержащие в качестве простетической группы окрашенный компонент. Хромопротеины участвуют в таких процессах жизнедеятельности, как фотосинтез, дыхание, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето- и цветовосприятие и др. Например гемоглобин. Свойства Белков Амфотерные свойства белков Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН. Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
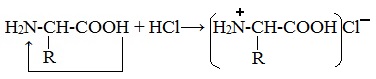
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований. Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма. Белки обладают и специфическими физико-химическими свойствами. Гидролиз белков Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков. Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул. В лабораторных условиях и в промышленности проводится кислотный гидролиз. В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
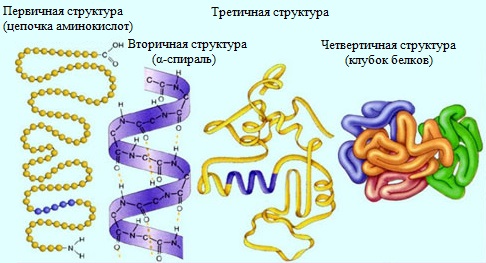
Строение белка Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
Первичная структура белка - определенная последовательность a-аминокислотных остатков в полипептидной цепи. Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве. Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).
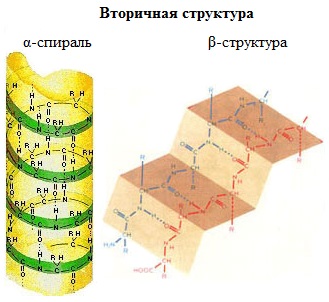
Вторичная структура белка - конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль. Существует два основных способа укладки цепи. Одна из моделей вторичной структуры - a-спираль. Другая модель – β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи. В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль. В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями. Большинство белков содержит как α-спирали, так и β-структуры. Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий.
Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей. Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами. Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом. Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α- и β-цепей и гема. Денатурация белков — изменение нативной конформации белковой молекулы под действием различных дестабилизирующих факторов. Аминокислотная последовательность белка не изменяется. Приводит к потере белками их естественных свойств (растворимости, гидрофильности и др.). Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют п лавлением молекулы. Практически любое заметное изменение внешних условий, например, нагревание или существенное изменение рН приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжёлых металлов, некоторых растворителей спирт),радиации и др. При денатурации разрушается четвертичная, третичная и вторичная структуры. Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц. Ренатурация — процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Не все белки способны ренатурировать; у большинства белков денатурация необратима. При нагревании двухцепочечных молекул ДНК до температуры около 100°C водородные связи между основаниями разрываются, и комплементарные цепи расходятся — ДНК денатурирует. Однако при медленном охлаждении комплементарные цепи могут вновь соединяться в регулярную двойную спираль. Эта способность ДНК к ренатурации используется для получения искусственных гибридных молекул ДНК (так называемая молекулярная гибридизация). Деструкция - разрушение белка до аминокислот под действием теплового шока, электрического тока, сильной радиации.
Лекция 10. Белки и белковые полимеры. Синтез белка. ДНК и РНК. Амнокислоты Аминокислоты – органические бифункциональные соединения, в состав которых входят две функциональные группы: карбоксильная – СООН и аминогруппа -NH2. Аминокислоты – амфотерные соединения. Аминокислоты можно рассматривать как карбоновые кислоты, в молекулах которых один или несколько атомов водорода углеводородного радикала замещены аминогруппами.
В природе встречаются в основном α-аминокислоты, составляющих белки (кроме пролина). Они имеют общую формулу
где R – углеводородный радикал, который может содержать различные функциональные группы (-SH, –OH, –COOH, NH2) и кольца. Специфичность каждой аминокислоты определяется строением радикала R. Боковой радикал у различных аминокислот имеет разную структуру. В качестве структурных элементов (мономеров) в составе белков обнаруживаются 20 различных аминокислот (см. таблицу), таким образом, в белках встречаются 20 различных по структуре боковых цепей. Как видно из таблицы, самым простым боковым радикалом является атом водорода (аминокислота глицин). Карбоксильная группа свободной аминокислоты может при нейтральных значениях рН диссоциировать, отдавая в раствор протон (H+) и приобретая отрицательный заряд. Аминогруппа свободной аминокислоты может присоединять протон и приобретать положительный заряд, подобно тому как аммиак превращается в ион аммония. Поэтому при нейтральных рН аминокислоты находятся в состоянии цвиттер-иона — иона (от нем. zwitter - двойной), одна часть которого имеет положительный, а другая часть — отрицательный заряд.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 178; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.191.22 (0.068 с.) |