Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гены, кодирующие белки, вовлеченные в синтез дофамина, его инактивацию и рецепцию.
Первые доказательства существовани рецепторов ДА в мозгу и связь их с системой аденилатциклазы были получены в 1972 году. В 1978 году было доказано, что рецепторы ДА в нервной системе представлены по крайней мере двумя дискретными популяциями, одна из которых свзана с системой 3’5’-циклического аденозинмонофосфата (цАМФ), другая независима от него. В частности, было продемонстрировано, что в гипофизе ДА тормозит секрецию пролактина, но не стимулирует формирование цАМФ. После было предложено подразделять рецепторы ДА на Д1, связанные со стимуляцией аденилатцеклазы, и Д2, не связанные с этим эффектом. В дальнейшем это разделение рецепторов ДА на два подтипа было подтвержено биохимически, морфологически, фармаколгически и физиологичски. Дуалистическа концепци ДА-ергической передачи была и остается основополагающей до настоящего времени. Тем не менее методами клонирования выделены и охарактеризованы еще три подтипа рецепторов ДА: Д3, Д4 и Д5/1b Однако оказалось, что выделенные подтипы рецепторов могут быть принципиально отнесены к первоначальным двум семействам рецепторов ДА, а также высокое сходство трансмембранной последовательности Д2, Д3 и Д4 подтипов рецепторов ДА. Хотя фармакологические профили Д1 и Д2 рецепторов различны, выявлено определенное сходство лиганд-рецепторных характеристик для подтипов Д1 и Д5/1b, а также сходство Д2, Д3 и Д4 подтипов рецепторов ДА. Кроме того, отмечают, что активация рецепторов Д5/1b, сходно с рецепторами Д1, стимулирует аденилатцеклазную систему клетки, в то время как активаци Д3 и Д4, сходно с Д2 рецепторами, ведет к угнетению образования цАМФ. Таким образом, в настощее время следует считать признанной классификацию рецептров ДА с выделением двух семейств – Д1, объединющего Д1 и Д5/1b, подтипы рецепторов, и Д2, объединющего Д2, Д3 и Д4 подтипы. У млекопитающих Д1b рецептор, первоначально названный так благодаря высокой гомолгии с Д1 рецептором, чаще выделяют как Д5 рецептор ДА. Кодирующая ДНК Д2 рецептора ДА была выделена в 1988-м, в дальнейшем было продемонстрировано существование нескольких видов этого рецептора. Д3 рецептор ДА был идентифицирован скринингом с ДНК крысы на основании последовательности Д2 рецептора. Д4 рецептор ДА клонировали, использу клетки нейробластомы SK-N-MC человека. Позже клонировали Д1 рецептор также на основании идентифицированной последовательности Д2 рецептора ДА. Последний подтип Д1 семейства рецепторов ДА, идентифицированный как Д5, Д1b выделили уже на основании последовательности Д1 рецептора. Позже было доказано, что Д5 и Д1b рецепторы человека и крысы идентичны.
Геномная организаци рецепторов ДА рассматривалась на основании концепции, что оба генных семейства рецепторов (Д1 и Д2) отличаются наличием или отсутствием интронов в их кодовой последовательности. Эти данные предствлены в табл. 1. Видно, что гены Д1 и Д5 рецепторов не содержат интронов в их кодовых областх и близи к рецепторам, свзанным с G-белкомю В противоположность к этому, по аналогии с геном, кодирующим родопсин, гены, кодирующие рецепторы Д2 семейства, нарушаются инторонами. Предполагается, что многие семейства рецепторов, свзанных с G-белком, имеют одого генного предшественника, сходного с геном опсина, который потерял свои интроны в течение генного процессинга.
Таблица 1. Молекулярные характеристики рецепторов дофамина.
Примечание. В скобках представлены данные, полученные для крысы (к) и человека (ч).
Выделяют два основных эволюционных механизма, обуславливающих различие в геномах рецептурных семейств: 1) механизм генного удвоения, дающий различия в родственных генах, кодирующих подтипы рецепторов и псевдорецепторов, и 2) обеспечение видовой гомологичность и развития генетического полиморфизма в пределах одного вида. Анализ генной структуры семейства Д2 рецепторов дофамина выявил, что область, кодирующая Д2 рецептор, содержит шесть интронов, кодирующая Д3 рецептор – пять, а кодирующая Д4 рецептор – три интрона. Локализация интронов сходна у всех трёх рецепторных генов и в гене опсина. Д3 рецептор теряет четвёртый интрон, характерный для Д2 рецептора, а Д4 рецептор – третий и четвёртый интроны структуры Д2 рецептора.
Присутствие интронов в кодирующей области с семейства Д2 рецепторов позволяет формировать внутренние варианты рецепторов. Д2 имеет две главных варианты, названных Д2s и Д2l, которые образуются в ходе альтернативного сплайсинга 87-bp экзона между четвёртым и пятым интроном. Сплайсинговые варианты Д3 рецептора, кодирующие нефункциональные белки, также идентифицированы. Анализ человечного Д4 рецептора выявил существование полиморфных вариант в кодирующей последовательности. 48-bp последовательность в третьей цитоплазматический петле существует либо как прямо повторяющаяся последовательность, либо как четырёх- или семикратное повторение. В Д4 рецептор найдено до 11 таких повторений. Д5 рецептор имеет два родственных псевдогена на первой и второй хромосоме человека. Они на 98% идентичны друг другу и на 95% идентичны человеческому Д5 рецептору Рецепторы Д1 и Д5 гомологичны по доменам на 80%, рецепторы Д2 и Д3-на 75%, а рецепторы Д2 и Д4 – на 53%.
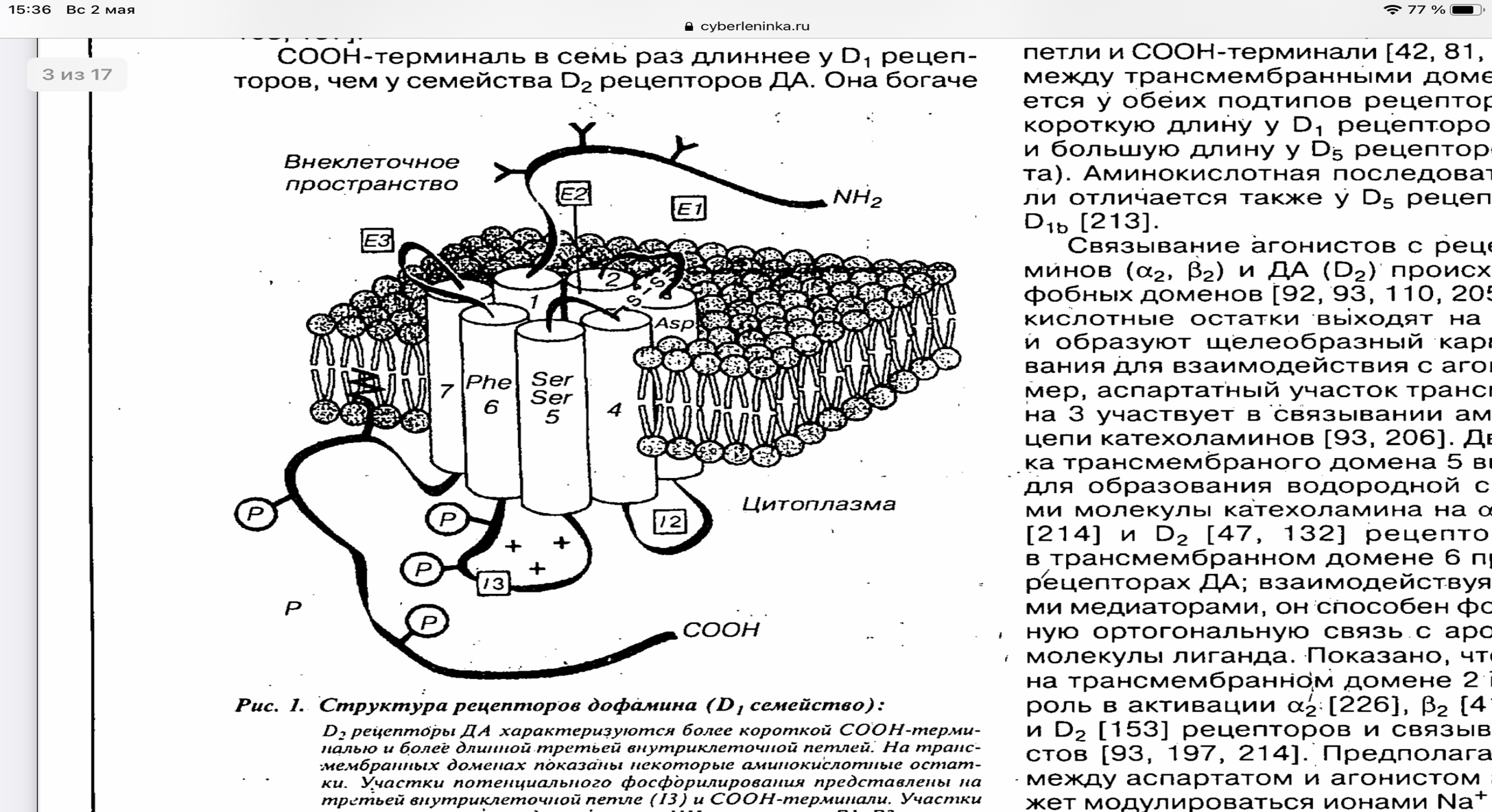
Рис. 2. Структура рецепторов дофамина (Д1 семейство) Прим. рецепторы ДА характеризуются более короткой COOH-терминально и более длинной третьей внутриклеточной петлей. На трансмембранных доменах показаны некоторые аминокислотные остатки. Участки потенциально фосфорилирования представлены на третьей внутриклеточной петле (13) и COOH-терминали. Участки глюкозилирования представлены на NH2-терминали. Е1-Е5 — экстраклеточные петли, 1-7 — трансмембранный домены; 12-13 — внутриклеточные петли.
NH2-терминальная петля (хвост) имеет одинаковую аминокислотную последовательность во всех подтипах рецепторов, отличаясь числом участков N-глюкозилирования, Д3-три, а Д4-только один. COOH-терминаль в семь раз длиннее у Д1 рецепторов, чем у семейства Д2 рецепторов ДА. Она богаче по содержанию остатков серина и треонина и содержит остатки цистеина, которые сохраняются у всех рецепторов, связанных с G- белком. Предполагают, что эти цистеиновые участки, связываясь с пальмитиновой кислотой, выполняют роль своеобразного якоря цитоплазматического хвоста мембраны, например в β-адренорецепторах или родопсине. В Д1 рецепторах ДА остатки цистеина локализуются вблизи начала COOH-терминали, тогда как в Д2 рецепторах COOH-терминаль заканчивается этими цистеиновыми остатками. Сходным образом всех рецепторов, связанных с G-белком, имеется два цистеиновых остатка на экстраклеточных петлях 2 и 3, которые предположительно формируют внутримолекулярный дисульфидный мостик, стабилизирующий структуру рецептора. Д2 рецептры имеют длинную третью внутриклеточную петлю, которая сходна с рецепторами, взаимодействующими с Gi-белками, тормозящими аденилатцеклазу, тогда как Д1 рецепторы характреризуются короткой третьей петлей, как и многие рецепторы, связанные с Gs-белком. У Д1 и Д5 рецепторов третья внутриклеточная петля и COOH-терминально сходны по размерам, но отличаются по аминокислотной последовательности. В противоположность этому малые цитоплазматический петли 1 и 2 высокостабильны, и все различия касаются лишь третьей цитоплазматический петли и COOH-терминали. Внешняя петля между трансмембранными доменами 4 и 5 отличается у обеих подтипов рецепторов ДА, имея более короткую длину у Д1 рецепторов (27 аминокислот) и большую длину у Д5 рецепторов (41 аминокислота). Аминокислотная последовательность этой петли отличается также у Д5 рецептора и его подтипа Д1b.
Связывание агонистов с рецепторами катехоламинов (α2 и β2) и ДА (Д2) происходит в зоне гидрофобных доменов. Аминокислотные остатки выходят на поверхность белка и образуют щелеобразный карман участка связывания для взаимодействия с агонистом. Например, аспартатный участок трансмембранного домена 3 участвует в связывании аминогруппы боковой цепи катехоламинов. Два серинорвых остатка трансмембранного домена 5 выступают донорами для образования водородной связи с гидроксилами молекулы катехоламинов на α2, β2, Д1 и Д2 рецепторах. Фенилаланин в трансмембранном домене 6 присутствует во всех рецепторах ДА, взаимодействуя с катехоламиновыми медиаторами, он способен формировать стабильную ортогональную связь с ароматической частью молекулы лиганда. Показано, что остаток аспартата на трансмембранном домене 2 играет критическую роль в активации α2, β2, Д1 и Д2 рецепторов и связывании с ними агонистов. Предполагают, что связывание между аспартатом и агонистом аллостерично и может модулироваться ионами Na+ или H+. Кроме того, в активации рецепторов играет немаловажную роль и количество цитоплазматических остатков, например таких, как остаток аланина в третьей внутриклеточной петле α-адренорецептора. Нейроны полосатого тела также получают входные данные от нейронов, расположенных в коре, которые выделяют возбуждающий нейротрансмиттер глутамат. Это приводит к стимуляции AMPA (2-амино-3-(3-гидрокси-5-метилизоксазол-4-ил) пропановая кислота) и NMDA (N- метил-D-аспарагиновая кислота или N- метил-D-аспартат)лиганд-управляемые ионные каналы и увеличивает внутриклеточную концентрацию Ca 2+, что приводит к активации сигнальных путей, зависящих от этого второго мессенджера. Среди нижестоящих эффекторов цАМФ и Ca 2+представляют собой DARPP-32 (регулируемый дофамином и цАМФ фосфопротеин с молекулярной массой 32 кДа) и RCS (регулятор передачи сигналов кальмодулина), оба из которых интегрируют сигналы от обоих этих вторичных мессенджеров [Шабанов, 2002] В дофаминергической системе существуют также ауторецепторы, расположенные на теле нейронов, аксонах, дендритах и терминалях, которые реагируют на собственный дофамин, регулируя его синтез и выделение. Их стимуляция приводит к снижению активности дофаминовых нейронов.
Большая часть охарактеризованных дофаминовых рецепторов относится к Д2-рецепторам. О функции Д1-рецепторов известно меньше. Д1- и Д2-рецепторы существуют в двух формах - высоко- и низкоаффинной, что определяется по их способности к связыванию агонистов и антагонистов. Было показано, что Д2-рецепторы сродство к бутирофенонам, в то время как Д1-рецепторы такой способностью не обладают. Д2-рецепторы преобладают в стриатуме - хвостатом ядре и скорлупе, но имеются также в поясной извилине и коре островка. В стриатуме Д2 обнаружены не только на дофаминергических, но и на холинергических нейронах. Это объясняет сопряженное выделение ацетилхолина при введении агонистов дофамина. Картирование Д1-рецепторов дало менее убедительные результаты, однако было установлено, что они преобладают в коре больших полушарий, особенно в области префронтальной коры, где имеются и Д2-рецепторы. Д1-рецепторы есть и в стриатуме.
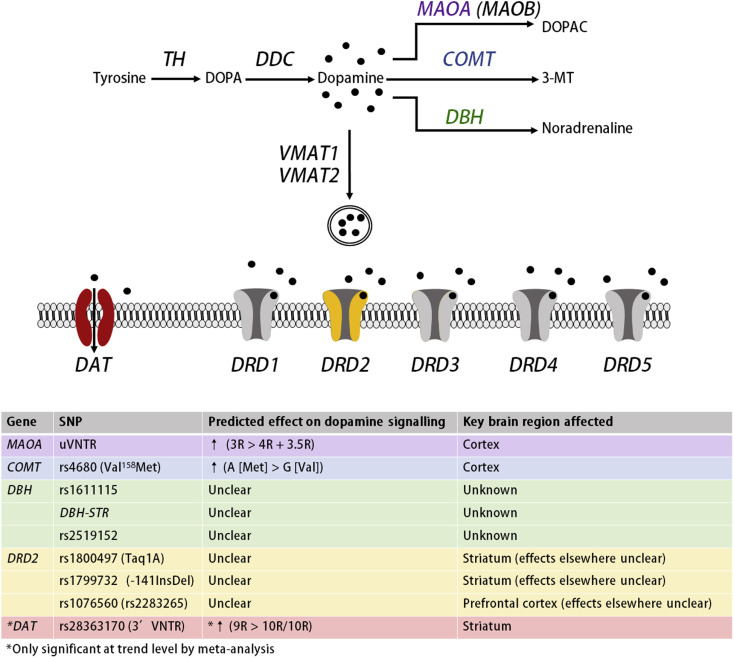
. Рис. 3. Прогнозируемое влияние функциональных полиморфизмов на передачу сигналов дофамина. Прим. На верхней панели выделены (цветом) гены в пути передачи сигналов дофамина, которые содержат функциональные полиморфизмы; гены без выявленных функциональных полиморфизмов показаны серым цветом. На нижней панели суммированы, где это возможно, предсказанное влияние каждого полиморфизма на передачу сигналов дофамина и области мозга, в которых эти эффекты, вероятно, имеют место. 3-МТ, 3-метокситирамин; 3R, 3-повторный полиморфизм; 3.5R, полиморфизм 3.5-повторов; 4R, 4-повторный полиморфизм; 9R, полиморфизм 9-повторов; 10R, полиморфизм с 10 повторениями; ДОПА, дигидроксифенилаланин; ДОПАК, 3,4-дигидроксифенилуксусная кислота; InsDel, вставка или удаление; SNP, однонуклеотидный полиморфизм; uVNTR, 5 'переменное количество тандемных повторов.
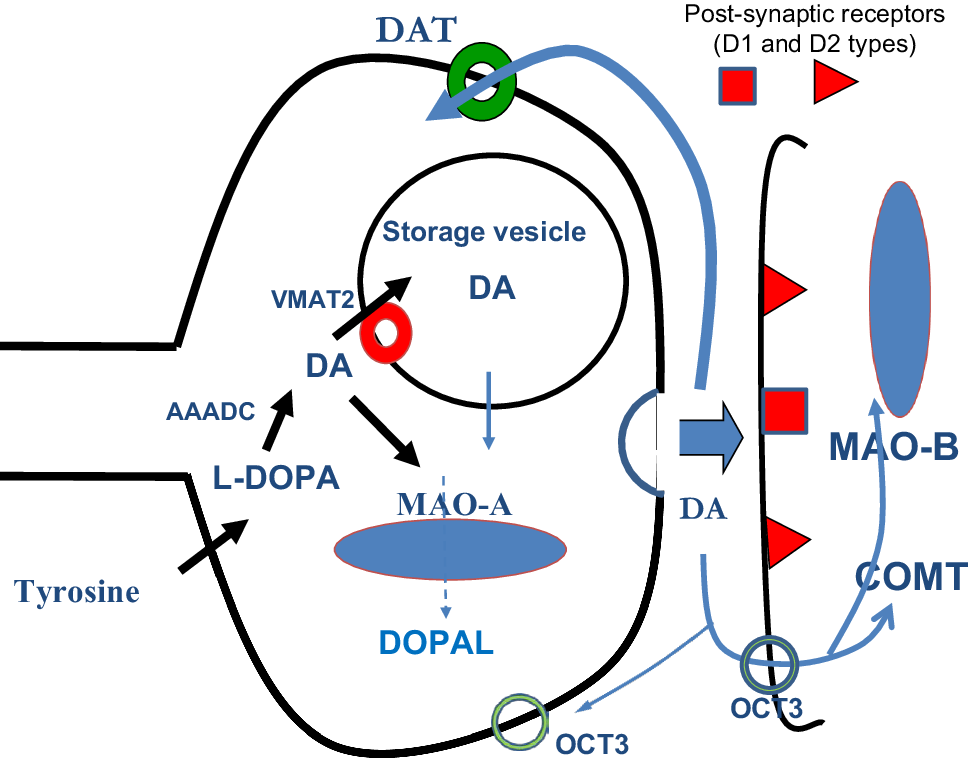
Рис. 4. Ферменты и переносчики, участвующие в синтезе, хранении и метаболизме дофамина
Биосинтез DA начинается с гидроксилированием тирозина по цитоплазматическому тирозин гидроксилазы (ТН) с получением Л -3,4-дигидроксифенилаланин(Л -DOPA). ДА производится из Л-ДОФА декарбоксилазой ароматических аминокислот (AAADC). После синтеза в цитоплазме нейронов, DA подвержен метаболическому распаду внутринейрональной митохондриальной моноаминоксидазой (МАО) или поглощается в гранулах с помощью везикулярного переносчика моноаминов VMAT2. После экзоцитотического высвобождения синаптический DA поглощается пресинаптическим DA-ергическим нейроном посредством высокоаффинного нейронального мембранного переносчика DA (DAT), а также низкоаффинного переносчика аминов плазматической мембраны PMAT и переносчиков органических катионов OCT1, OCT2 и OCT3, расположенных на глиальных клетках и плазматических мембранах нейронов [Daws, 2009]
Ген DRD1 Ген DRD1 кодирует подтип D1 дофаминового рецептора — наиболее распространенный подтип рецепторов дофамина в центральной нервной системе. Альтернативные сайты инициации транскрипции приводят к появлению двух вариантов транскрипции этого гена. У человека рецепторы D1, кодируемые генами DRD1, экспрессируются в префронтальной коре головного мозга и отвечают за такие процессы, как формирование рабочей памяти, обучение, развитие мелкой моторики и мотивации, а также вовлечены в развитие патологических состояний, например, при опиоидной зависимости [Nerenz, 2018]. Рецептор дофамина D1 относится к семейству сопряжённых с G-белками рецепторов. Как и все белки этого семейства, он включает семь кластеров гидрофобных аминокислотных остатков. Рецептор D1 имеет высокую степень структурной гомологии с другим рецептором дофамина — D5, они оба связывают аналогичные препараты и входят в группу D1-подобных рецепторов [Dearry et al., 1990]. Рецептор дофамина D1 стимулирует аденилатциклазу и активирует цАМФ-зависимые протеинкиназы, оказывая таким образом влияние на различные сигнальные пути. Этот рецептор регулирует рост и развитие нейронов, определяет некоторые поведенческие реакции [Кириченко Е.Н., 2020]. Природный лиганд этого класса рецепторов, дофамин, — гормон и нейромедиатор, который обеспечивает когнитивные функции, а также отвечает за чувство удовлетворения, любви и привязанности. Дофамин связан с формированием целенаправленного поведения, его также называют «молекулярный пряник». Рецептор дофамина D1 модулирует процессы, связанные с рецептором дофамина D2. Так, в случае ожидаемого поощрения активируется дофаминовый рецептор подтипа D1, а при его отсутствии — подтипа D2. Мутации гена DRD1 ассоциированы с поведенческими расстройствами и вовлечены в возникновение патологических состояний: никотиновой, кокаиновой и алкогольной зависимости, депрессии, шизофрении и т. д. [Yang et al.,2000]. Ген DRD1 состоит из одного экзона и кодирует белок из 446 аминокислот с молекулярной массой 49 300 кДа и трансмембранной топологией. Этот белок представляет собой тканеспецифичный рецептор. Транскрипция гена DRD1 регулируется двумя промоторами. мРНК гена DRD1 экспрессируется в центральной нервной системе. Наиболее высокие уровни экспрессии наблюдаются в дорсальном и вентральном полосатом теле (прилежащее ядро и обонятельный бугорок). Более низкие — в базолатеральной миндалине, коре головного мозга, перегородке, таламусе и гипоталамусе. Ген DRD1 вовлечен в этиологию различных психоневрологических заболеваний [Ахмедова, 2020]. Ген DRD2 Ген DRD2 кодирует D2-рецептор дофамина — один из наиболее распространённых типов дофаминовых рецепторов в головном мозге. D2- рецепторы обеспечивают функционирование дофаминергической системы. Полиморфизмы в гене DRD2 приводят к изменению экспрессии D2-рецепторов, что является одной из причин возникновения шизофрении. У человека рецептор D2, кодируемые генами DRD2, экспрессируются преимущественно в тканях мозга: среднем мозге, лимбической системе, коре головного мозга, а также встречаются и в сердечно-сосудистой системе, почках, сетчатке глаза, гипофизе [Серяпина, 2019] и отвечает за такие процессы, как формирование рабочей памяти, обучение, развитие мелкой моторики и мотивации, а также вовлечены в развитие патологических состояний, например, при опиоидной зависимости [Nerenz, 2018]. Ген DRD2 расположен на 11-й хромосоме (11q22-q23), состоит из 8 экзонов (1245 пар нуклеотидов). Альтернативный сплайсинг 6-го экзона приводит к образованию двух изоформ: D2S и D2L [Серяпина, 2019]. Белок D2-рецептора синтезируется в двух изоформах: D2S (415 аминокислот) и D2L (444 аминокислоты). Связываясь с дофамином, D2-рецепторы участвуют в деятельности дофаминергической системы: регуляции гемодинамики и метаболизма, реализации двигательных актов, контроле настроения, мотивации, памяти, внимания и прочее. Нарушения в функционировании дофаминергической нейромедиаторной системы (особенно изменение плотности D2-рецепторов) признаны одной из основных причин развития шизофрении [Moriguchi et al., 2013]. Повышение экспрессии D2-рецепторов связывают с такими симптомами как бред, расстройства мышления, снижение мотивации и развитие социальной ангедонии. Также известно, что D2-рецепторы участвуют в осуществлении двигательных актов, и изменение их экспрессии является одной из причин развития болезни Паркинсона. Дофаминергическая система вовлечена в механизм подкрепления различных зависимосте. Гиперчувствительность дофаминовых рецепторов 2 типа, кодируемых геном DRD2, играет ключевую роль в возникновении дофаминергической мигрени [Серяпина, 2019]. В составе гена DRD2 описано несколько десятков полиморфных локусов, функциональное значение которых интенсивно изучается с целью обнаружения взаимосвязей как с развитием шизофрении, так и с отдельными характеристиками шизофренического процесса [Liu et al., 2014]. Ген DRD3 Ген DRD3 кодирует подтип D3 рецептора дофамина — один из пяти рецепторов дофамина человека, который по своей фармакологии и сигнальной системе отличается от рецепторов D1 и D2. Рецепторы дофамина D3 расположены как в пресинаптических мембранах нервных клеток (ауторецептор), так и в постсинаптических мембранах. Рецептор дофамина D3 локализован в лимбической системе мозга, которая связана с когнитивными, эмоциональными и эндокринными функциями[Guma et al., 2019; Nakajima et al., 2013]. Полиморфизмы гена DRD3 могут оказывать влияние на формирование ответа на антипсихотические препараты, способствуют развитию алкогольной, никотиновой и героиновой зависимости. Мутации этого гена имеют связь с такими заболеваниями, как депрессия, аутизм, шизофрения, болезнь Паркинсона, а также с поведенческими и психическими нарушениями [Кириченко., 2020]. Ген DRD3 схож с геном DRD2, но отличается от большинства других генов рецепторов дофамина. Содержит 5 интронных областей, положение двух из которых соответствует положению интронов гена DRD2. Альтернативный сплайсинг гена DRD3 приводит к образованию вариантов транскрипта, кодирующих разные изоформы белка, хотя некоторые варианты могут подвергаться нонсенс-опосредованному распаду мРНК (цитоплазматическая система контроля качества мРНК) [Кириченко., 2020]. Ген DRD3 кодирует белок из 446 аминокислот, принадлежащий к семейству рецепторов, сопряжённых с G-белками. G-белки опосредуют активность рецептора D3, который, как и рецепторы дофамина D2 и D4, ингибирует аденилатциклазу [2]. Ген дофаминового рецептора D3 причастен к развитию шизофрении, аутизма и расстройств, связанных с употреблением психоактивных веществ. Также DRD3 связан с эмоциональной реактивностью, исполнительным функционированием, реакцией на стресс и последствиями посттравматического стрессового расстройства [Кириченко., 2020]. Ген DRD5 Этот ген кодирует подтип D5 дофаминового рецептора. Подтип D5 представляет собой рецептор, связанный с G-белком, который стимулирует аденилатциклазу. Этот рецептор экспрессируется в нейронах лимбических областей мозга. Он имеет в 10 раз более высокое сродство к дофамину, чем подтип D1. Псевдогены, связанные с этим геном, находятся на хромосомах 1 и 2. Структурно и функционально DRD5 подобен рецептору допамина D1 (DRD1). Ген кодирует белок из 475 аминокислот со структурными особенностями, которые соответствуют рецепторам, связанным с G-белком. Ген содержит 2 экзона, разделенных небольшим интроном различного размера (179 или 155 п.н.). Сайт начала транскрипции находится на 2125 п.н. выше сайта инициации трансляции. Полиморфизмы в гене DRD5, по-видимому, связаны с общим поведенческим состоянием, называемым синдромом дефицита внимания/гиперактивности (СДВГ). Это состояние, которое обычно начинается в детстве, характеризуется чрезмерной активностью, импульсивным поведением и трудностями в обращении внимания [Beaulieu, Gainetdinov, 2011]. Рецептор D5 экспрессируется в разных участках мозга: в пирамидальных нейронах префронтальной коры, поясной коре, энторинальной коре, чёрной субстанции, зубчатой извилине, гиппокампе и гипоталамусе и участвует в регуляции двигательных процессов, а также в развитии внимания, обучении, настроении и в других физиологических реакциях [Carr et al., 2017; Megat et al., 2018]. Ген BDNF Ген BDNF кодирует одноименный белок, который представляет собой нейротрофический фактор головного мозга. Этот белок, обнаруженный в головном и спинном мозге, способствует выживанию нервных клеток, участвует в росте, созревании (дифференцировке) и поддержании жизнедеятельности нейронов. В головном мозге белок BDNF активен в соединениях между нервными клетками (синапсами), которые осуществляют межклеточную коммуникацию. Синапсы могут изменяться и со временем адаптироваться в ответ на события, происходящие в жизни человека, и полученную информацию. Это свойство нервной системы называется синаптической пластичностью. Она имеет большое значение для процессов обучения и запоминания. Белок BDNF участвует в регуляции синаптической пластичности, реакции на стресс и настроения. Кроме того, ген BDNF экспрессируется в областях мозга, которые контролируют прием пищи и массу тела. Белок BDNF, вероятно, способствует управлению этими функциями. Установлено, что экспрессия этого гена снижена у пациентов с болезнями Альцгеймера, Паркинсона и Хантингтона [Кириченко, 2020]. Ген BDNF содержит 11 экзонов и занимает около 70 т. п. н. Сайты начала транскрипции в этом гене идентифицированы в 9 экзонах, каждый из которых был связан с функциональным промотором. Альтернативный сплайсинг приводит к образованию множества вариантов транскриптов. По крайней мере один из этих транскриптов кодирует протеин, который в процессе протеолитических преобразований превращается в зрелый белок. Связывание этого белка с его рецептором способствует выживанию нейронов во взрослом мозге [Кириченко, 2020]. Белок BDNF входит в семейство факторов роста нервов. Он обеспечивает долговременную нейронную и поведенческую пластичность в ответ на стресс. Вызываемая им поведенческая сенсибилизация связана с его способностью вызывать сверхэкспрессию рецептора дофамина D3 в полосатом теле головного мозга. Белок BDNF вовлечен в энергетический баланс и является анорексигенным фактором, который высоко экспрессируется в ядрах вентромедиального гипоталамуса[Кириченко, 2020]. Продукт гена BDNF может быть важной детерминантой патофизиологических состояний, таких как наркомания, шизофрения или болезнь Паркинсона, при которых наблюдается аномально высокая экспрессия рецептора дофамина D3 [Guillin et al.,]. Мутации гена BDNF ассоциированы с синдромом WAGRO (ожирения и нарушения когнитивных функций) [Xu et al., 2003]. Мутация в гене BDNF влияет на общие когнитивные способности, предрасположенность к нарушению памяти, расстройствами пищевого поведения (нервная анорексия и нервная булимия), биполярным аффективным расстройством, тревожным расстройством, болезнью Альцгеймера, Паркинсона и защитным эффектом при обсессивно-компульсивном расстройстве [Han, et al., 2008]. Полиморфизм гена совместно с другими генами и серотонином влияет на импульсивную поведенческую агрессию и когнитивную импульсивность у детей с синдромом дефицита внимания / гиперактивностью (СДВГ), а также связан с аллергической астмой и ринитом [Zintzaras et al.,2020].
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 75; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.74.239 (0.045 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||