Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: действие радиации на эмбрион и плод. Генетические эффекты радиации
Цель: 1. Обсудить современные представления о медицинских последствиях действия радиации на эмбрион и плод. 2. Рассмотреть молекулярно-генетические и цитогенетические механизмы, лежащие в основе постлучевых нарушений организма. 3. Освоить микроядерный тест, используемый для оценки мутагенного эффекта ионизирующих излучений. 4. Познакомиться с методом анализа метафазных пластинок и оценить с помощью этого метода генетические нарушения у облученных животных. 5. Выявить дозозависимый характер генетических нарушений при облучении животных.
І. Самостоятельная работа во внеучебное время Основные вопросы для самостоятельной подготовки: 1. Последствия облучения зародышей и плодов – детерминированные эффекты действия ионизирующего излучения. 2. Возможные уродства, формирующиеся у облученного зародыша и плода. 3. Радиочувствительность различных периодов внутриутробной жизни человека. 4. Роль облученного материнского организма в формировании патологии у эмбриона. 5. Механизмы радиоэмбриологического эффекта и оценка его последствий. 6. Радиационная генетика, ее задачи и методы исследования. 7. Дозы генетического риска. 8. Виды мутаций, индуцируемые ионизирующим излучением. 9. Методы исследования радиационного мутагенеза. 10. Генетические последствия облучения млекопитающих. 11. Радиационно-индуцированные мутации в соматических клетках организма. 12. Методы исследования пострадиационных цитогенетических нарушений.
Вопросы для самоконтроля: 1. Что называют тератогенными эффектами? 2. Почему эмбрион является самой радиочувствительной стадией онтогенеза? 3. Существует ли пороговая доза излучения, вызывающая аномалию плода человека или животного? 4. Какие последствия облучения могут возникать в предимплантационный период у зародыша человека? 5. Какие последствия облучения могут возникнуть в период основного органогенеза у эмбриона человека? 6. Какие последствия облучения могут возникнуть в плодный период развития человека? 7. Какие дефекты могут сформироваться в скелете облученных эмбрионов? 8. Какие дефекты могут сформироваться в головном мозге облученных эмбрионов? 9. Можно ли вызвать мозговую грыжу, микроцефалию, обратное расположение органов при облучении человека после рождения?
10. Какая система организма является наиболее радиочувствительной у эмбриона во время его развития? 11. Какие существуют доказательства преимущественно прямого эмбриогенного действия радиации? 12. Как будет формироваться плод при дефиците клеточной массы? 13. Какие изменения будут наблюдаться у топографически правильно сформированных организмов после утраты «строительных материалов» (животные-карлики)? 14. С помощью каких методов можно обнаружить у животных-карликов отклонения от нормы после внутриутробного облучения? 15. Что представляет собой экстраполяционная кривая, созданная Л. и У. Расселами (1954 г.)? 16. Какое облучение (однократное или фракционированное) в одной и той же суммарной дозе наиболее опасно для эмбриона? 17. Каковы последствия для плода при облучении матери во второй половине беременности? 18. Какой эффект можно ожидать после трансплантации органов от облученных эмбрионов интактным реципиентам? 19. Какие последствия можно ожидать при воздействии облучения на первичные зародышевые клетки половых органов у эмбрионов? 20. Установлена ли пороговая доза излучения, вызывающая аномалии у человеческого плода? 21. Какие последствия может вызвать радиографическое, рентгенологическое, радионуклидное обследование матерей на их потомство? 22. Какова задача каждого специалиста в области радиоэмбриологии, радиологии и радиобиологии в вопросах просвещения населения? 23. Что Вам известно об истории развития науки «радиационная генетика»? 24. Что понимают под генетическим риском облучения? 25. Как оценить риск проявления наследственных дефектов? 26. Каковы дозы, удваивающие спонтанный мутагенез? 27. Какие виды мутаций могут возникать под действием ионизирующих излучений? 28. В чем суть методов изучения геномных мутаций? 29. Какие методы изучения хромосомных мутаций Вы знаете? 30. Что Вам известно о методах изучения геннных мутаций? 31. Какие виды генетических повреждений претендуют на роль «маркеров» лучевого повреждения в ближайшие и отдаленные сроки после облучения?
32. Чем характеризуется чувствительность мужских гонад к мутагенному действию ионизирующего излучения? 33. В чем особенности чувствительности женских гонад к мутагенному действию ионизирующего излучения? 34. Каким образом в организме может происходить отбор генетически неполноценных половых клеток? 35. Какое влияние на потомство могут оказать мутации в гаметах родителей? 36. Можете ли Вы назвать правило «одного года», снижающее риск генетических последствий в потомстве облученных отцов? 37. Что Вы знаете о правиле «десяти дней» для женщин репродуктивного возраста? 38. Что известно о соотношении полов у детей, рождающихся у облученных родителей? 39. Чем характеризуется чувствительность к мутагенному действию ионизирующих излучений соматических клеток? Какие виды клеток могут «консервировать» лучевые поражения? 40. Каковы последствия радиационно-индуцированных мутаций, возникающих в соматических клетках? 41. Как связать явление радиационного старения с нарушениями генетического аппарата клетки? 42. Какие методы могут использоваться для обнаружения генетических нарушений в клетке? 43. Как проводится оценка генетических нарушений с помощью микроядерного теста? 44. Как выявляются генетические нарушения с помощью анализа метафазных пластинок? 45. Какие факторы могут влиять на количество аберраций, наблюдаемых после воздействия ионизирующих излучений? 46. Какие клеточные механизмы участвуют в утрате хромосомных аберраций со временем?
ІІ. Работа на занятии План занятия: 1. Вводное слово преподавателя – 10 мин. 2. Разбор теоретического материала с просмотром слайдов – 35 мин. 3. Знакомство с микроядерным тестом – 10 мин. 4. Знакомство с методом и выполнение работы по оценке метафазных пластинок – 80 мин. N. B. Необходимо помнить, что радиочувствительность плода по индукции отдаленных последствий облучения в 10-300 раз больше по сравнению со взрослым организмом!
Практическая работа студентов Работа 1.Оценка генетического эффекта облучения животных с помощью микроядерного теста В 1975 г. О. Schmidt предложил использовать для первичной прижизненной оценки мутагенеза метод подсчета микроядер в полихроматофильных эритроцитах костного мозга, который в последнее время получил широкое распространение в научных исследованиях. Появление микроядерных эритроцитов индуцирует облучение, алкилирующие агенты, сильные антиметаболиты и т.д. С целью проведения быстрой и эффективной оценки повреждения хромосом Schlege, Mac Iugor (1983) предложили изучать частоту микроядер в эритроцитах периферической крови. К достоинствам микроядерного теста относится сравнительная быстрота анализа. Если традиционными методами (в том числе анализ метафазных пластинок) для оценки цитогенетических аберрацийодного индивида требуется 1-2 рабочих дня, то при исследовании теста на микроядра приблизительно 1 час. Путем подсчета микроядер можно преодолеть также сложность анализа картины метафазных хромосом. Этот тезис подтверждает приведенная в литературе корреляция между частотой обнаружения микроядерных эритроцитов и цитогенетических аберраций. Действие мутагенов на организм индуцирует в клетках нарушения генома и структуры хромосом, которые, по-видимому, являются источником образования микроядер в эритроцитах костного мозга и периферической крови. В механизме образования микроядер ведущая роль отводится ацентрическим фрагментам хромосом. Фрагменты хромосом (хроматид), возникшие в результате разрывов хромосом и дисфункции веретена деления, окружаются мембраной и образуют микроядра. Существует мнение, что образование «крупных» микроядер тесно связано с геномными нарушениями хромосомного аппарата, в то время как уровень клеток с «мелкими» микроядрами коррелирует с частотой нарушений в структуре хромосом.
Работа проводится на трёх мышах, две из которых за 3-5 дней до занятия были подвергнуты облучению в дозах 3 и 6 Гр. У здорового и облучённых животных берут кровь из надреза кончика хвоста и готовят мазки. Затем мазки крови фиксируют в течение 5-10 мин в метаноле, после чего окрашивают азурII-эозином по общепринятой методике. Подсчёт микроядер проводят в расчёте на 1000 эритроцитов. При подсчёте микроядра делят на 2 группы: 1 – не превышающими 1/10 диаметра эритроцита; 2 – соответствующими 1/10-1/16 диаметра эритроцита. Строят графики, отражающие дозовую зависимость индуцированных цитогенетических нарушений в гемопоэтических клетках. Работа 2.Приготовление и анализ метафазных пластинок хромосом клеток костного мозга облученных крыс В опыте используют группы облученных и необлученных животных (см. работу 1). Крысам вводят колхицин внутрибрюшинно в количестве 0,2 мл 0,1 % раствора на 100 г массы тела. Через 1,5 часа животных умерщвляют с помощью эфира или методом дислокации цервикального отдела позвоночника согласно методическим рекомендациям МЗ СССР «Эвтаназия экспериментальных животных» (1985). Бедренную кость выделяют и очищают от мягких тканей. Костный мозг из бедренной кости вымывают 0,56 % раствором хлористого калия подогретого до 37 ºС. В этом растворе костный мозг помещают в термостат (37 ºС) на 20 мин. Затем клеточную суспензию центрифугируют при 1000 об./мин в течение 5 мин, надосадочную жидкость сливают и к полученному осадку по стенке пробирки (очень осторожно!) наливают охлажденную в холодильнике фиксирующую смесь (3 части абсолютного метилового или этилового спирта и 1 часть ледяной уксусной кислоты). Фиксацию клеток производят в течение 15-20 мин при 4ºС (в холодильнике). Затем пастеровской пипеткой смесь слегка ресуспендируют и оставляют в холодильнике еще на 10-15 мин. После этого клеточную взвесь ресуспендируют более тщательно и центрифугируют 5 мин.
Надосадочную жидкость сливают, полученный осадок снова заливают фиксатором, тщательно разбивают клетки костного мозга пастеровской пипеткой и ставят в холодильник. Через 15-20 мин вновь ресуспендируют, затем центрифугируют 5 мин, заливают свежим фиксатором и помещают в холодильник (10-15 мин). Таким образом, после трехкратного центрифугирования и фиксации, готовят препараты костного мозга. Для этого одну каплю взвеси разбрызгивают на охлажденном предметном стекле и высушивают над пламенем спиртовки. Красят препараты азурII-эозином в течение 30 мин. Под воздействием ионизирующей радиации в клетках костного мозга возникают хромосомные аберрации. Хромосомные аберрации подразделяют на два типа: структурные хромосомные и хроматидные. Перестройки хроматидного типа – единичные перестройки, т.е. когда поражена одна хроматида; перестройки хромосомного типа – двойные перестройки, т.е. когда в аберрации вовлечены обе хроматиды. Считают, что аберрации хромосомного типа отражают поражение хромосом на стадии G1, когда хромосома реагирует как однонитчатая структура. Аберрации хроматидного типа происходят при действии на стадии S и G2, когда хромосома реагирует как двунитчатая структура. Аберрации хромосомного типа: 1. Ацентрические фрагменты (терминальные делеции) представляют собой спаренные хроматиды, которые располагаются параллельно друг другу, но не имеют центромеры. 2. Точковые фрагменты представляют собой спаренные хроматиды и имеют вид спаренных хроматиновых шариков. 3. Кольцевые хромосомы (центрические кольца) представляют собой спаренные хроматиды в виде кольца, имеющие центромеру. 4. Хромосомы, имеющие более одной центромеры (дицентрические, трицентри-ческие) являются межхромосомными асимметрическими транслокациями. 5. Симметричные межхромосомные обмены (транслокации) представляют собой аберрации, возникающие в результате обмена между двумя хромосомами, причем дистальные участки двух хромосом переносятся от одной к другой.
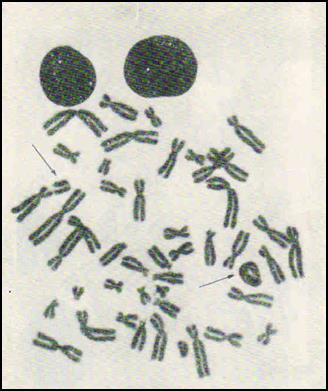
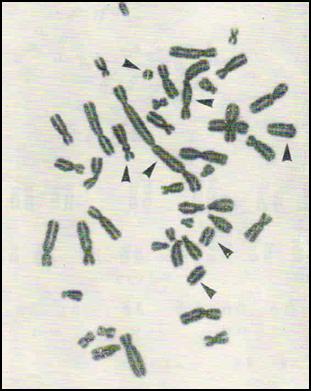
1. Клетка с центрическим кольцом и фрагментом. 2. Трицентрик + 2 дицентрические хромосомы + 4 ацентрических фрагмента. Рис. 15-1. Метафазные пластинки с хромосомными аберрациями в лимфоцитах человека Аберрации хроматидого типа: 1. Фрагменты. Представляют собой отделившиеся участки хроматид. Могут располагаться рядом с поврежденной хромосомой или вдали от нее. 2. Сложные перестройки (транслокации). Это аберрации, возникшие в результате обмена материалом между хроматидами одной хромосомы, двух или более хромосом. Наиболее частыми формами обменов являются обмены между хроматидами двух хромосом, относящиеся к группе квадрирадиалов. Для анализа берутся хорошие в техническом отношении метафазные пластинки облученных и необлученных крыс, в которых изучается количество хромосом, а также определяется характер и количество имеющихся аберраций. Анализу подвергаются 50 метафаз от каждого животного. Если в данной метафазной пластинке нет хромосомных аберраций, ставится условное обозначение – норма. При обнаружении хромосомного нарушения определяется тип аберрации. После анализа 50 пластинок составляется таблица.
Таблица представляет собой сетку квадратов, каждый из которых соответствует одной метафазной пластинке. Изучая препарат, в каждый квадрат вносится: - общее число хромосом (верхний левый угол квадрата); - аберрация в схематическом изображении. Если в данной метафазной пластинке нет хромосомных аберраций, в центре квадрата ставится условное обозначение N (норма). Заполненная таким образом карта отражает: 1) число аберрантных клеток; 2) число хромосомных аберраций; 3) тип хромосомных аберраций; 4) распределение числа аберраций в клетках; 5) число хромосом, участвующих в обменах, и их группы. При обработке данных, полученных после заполнения таблицы, рассчитывают два показателя: 1. Число аберрантных клеток (%). 2. Число хромосомных аберраций на клетку.
Вопросы для обсуждения: 1. Охарактеризуйте механизм образования микроядер в зритроцитах под влиянием мутагенных факторов. 2. Назовите достоинства микроядерного теста по сравнению с другими методами исследования. 3. Какие результаты исследования подтверждают дозозависимый характер индукции облучением микроядер в эритроцитах? 4. В какой фазе клеточного цикла колхицин блокирует деление клетки? 5. Какие результаты анализа метафазных пластинок подтверждают мутагенный эффект ионизирующей радиации?
Таблица 15-1
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 155; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.247.31 (0.044 с.) |