Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительное титрование.
В основе методов оксидиметрии лежит окислительно-восстановительная реакция. Названия методов обусловлены рабочим раствором. а) перманганатометрия – рабочим раствором является калия перманганат Определение проводят в кислой среде, так как есть возможность использовать Пример взаимодействия:
Фактор эквивалентности в перманганатометрии равен 1/z, где z – количество принятых или отданных электронов. Перманганат-ион принимает в результате реакции 5е-, т.о. f =1/5. Щавелевая кислота отдает 2е-, т.е. f =1/2. Восстановители определяют прямым перманганатометрическим титрованием. Прямой метод используют для количественного определения железа восстановленного, препаратов пероксида водорода. Окислители определяют обратной перманганатометрией. Избыток титранта устанавливается иодометрически.
Расчетная формула прямого титрования:
С% – содержание анализируемого вещества, %; V( К – поправочный коэффициент титрованного раствора Т( а – навеска анализируемого вещества, г. б) йодометрия основана на использовании окислительных свойств свободного йода и восстановительных свойств иодид-ионов:
Рабочими растворами являются раствор Методом прямой иодометрии количественно определяют неорганические и органические лекарственные вещества, способные окисляться или восстанавливаться, а также образовывать с йодом продукты замещения. Кроме того, иодометрию используют для определения избытка титранта в обратном иодатометрическом, броматометрическом, перманганатометрическом, иодхлорометрическом методах. Свободный йод, образовавшийся при окислении иодид-ионов или оставшийся в избытке при обратном иодометрическом титровании, оттитровывают тиосульфатом натрия:
Индикатором обычно служит крахмал, образующий с иодом соединение, окрашенное в синий цвет. Прямое титрование иодом применяют для определения натрия тиосульфата, препаратов мышьяка (III) и других веществ, проявляющих восстановительные свойства, например препаратов альдегидов (хлоралгидрат, формальдегид) в щелочной среде:
Определение окислителей проводят косвенным способом титрования. При этом в качестве вспомогательного компонента используют
Выделившийся свободный иод оттитровывают тиосульфатом натрия. Этот процесс лежит в основе количественного определения препаратов перекиси (пероксида) водорода, соединений мышьяка (V), меди (II), калия перманганата, а также обладающих активными окислительными свойствами гипохлоритов (известь хлорная) и хлорпроизводных амидов сульфокислот (хлорамины, пантоцид). Для количественного анализа используют также сочетание реакций замещения и иодометрии. С помощью титрованного раствора иода получают монозамещенные (антипирин), ди- и трииодпроизводные (фенолов, первичных ароматических аминов, в том числе сульфаниламидов, производных n-аминобензойной кислоты), тетраиодпроизводные (метиленовый синий). Полученные иодпроизводные, если они мешают титрованию, отфильтровывают, а в фильтрате определяют избыток титрованного раствора иода. Ряд лекарственных веществ, представляющих собой органические основания, могут быть определены методом, который основан на их способности образовывать осадки полииодидов, имеющих состав К их числу относятся ряд алкалоидов (хинина гидрохлорид, папаверина гидрохлорид, кодеин, кофеин, кокаина гидрохлорид, пахикарпина гидроиодид), витаминов (тиамина бромид), гетероциклические основания и их соли (хинозол, спазмолитин, дипрофен, дибазол, карбахолин, кватерон, амидопирин), четвертичные аммониевые соли (прозерин) и др. в) йодатометрия используется для определения фтивазида, апрессина и кислоты аскорбиновой. Происходит процесс окисления лекарственных веществ титрованным раствором иодата калия. Избыток титранта устанавливают иодометрическим методом:
г) броматометрия. В броматометрии в качестве титранта используют бромат калия, проявляющий в кислой среде окислительные свойства. Определение обычно ведут в присутствии бромида (бромид-броматометрия):
Выделяющийся свободный бром расходуется либо на окисление, либо на образование моно-, ди- или трибромпроизводных. Индикаторами служат красители, представляющие собой азосоединения (метиловый красный, метиловый оранжевый), которые окисляются и обесцвечиваются под действием избытка титранта после достижения эквивалентной точки. При использовании обратной броматометрии конец титрования устанавливают иодометрически, добавляя в титруемый раствор иодид калия:
Объектами броматометрического титрования являются неорганические соединения мышьяка (III) и элементорганические соединения мышьяка (после предварительной минерализации). Обладая восстанавливающими свойствами, соединения мышьяка (III) окисляются броматом калия:
При количественном определении органических лекарственных веществ производных фенолов (фенол, тимол, резорцин, салициловая кислота) и первичных ароматических аминов (сульфаниламидные препараты, производные n-аминобензойной кислоты, натрия n-аминосалицилат) используют метод обратной броматометрии. Выделяющийся бром (в присутствии бромида) расходуется на галогенирование фенолов или аминов, образуя ди- или трибромпроизводные. Избыток брома определяют иодометрическим методом:
Лекарственные вещества, представляющие собой гидразины и гидразиды (изониазид, фтивазид, метазид, ниаламид), количественно определяют окислением, используя в качестве титрантов раствор иода, иодат калия, бромат калия, по общей схеме:
д) цериметрия – метод, основанный на использовании в качестве титранта солей церия (IV), которые в кислой среде восстанавливаются до церия (III):
В качестве индикаторов используют дифениламин или о-фенантролин (фероин). При обратном титровании избыток титранта (сульфат церия) определяют иодометрически:
Ряд преимуществ отличают цериметрию от других окислительно-восстановительных методов анализа. Соединения церия (IV) обладают устойчивостью в титрованных растворах. Даже при температурах выше 100°С они не образуют промежуточных продуктов взаимодействия. Все это послужило предпосылкой для использования цериметрии в анализе как неорганических (соединений железа (II), мышьяка), так и органических (углеводов, органических кислот, производных фенотиазина) лекарственных веществ. Рекомендуют цериметрию для определения викасола, токоферола ацетата. Ее используют также для определения производных бензотиадиазина (дихлотиазид). Существуют также и другие методы окислительно-восстановительного титрования.
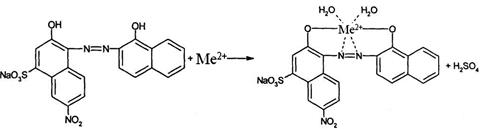
Комплексонометрия. Комплексонометрическое титрование основано на реакции комплексообразования катионов металлов с комплексонами – аминополикарбоновыми кислотами и их солями. Образующиеся комплексные соединения называют комплексонатами. Наибольшее применение для комплексонометрического титрования получила динатриевая соль этилендиаминтетрауксусной кислоты (комплексон III, трилон Б, Взаимодействие происходит в стехиометрическом соотношении 1:1 независимо от заряда катиона:
Именно поэтому фактор эквивалентности в комплексонометрии всегда равен 1. Комплексонометрическое титрование применяют для количественного определения неорганических и элементорганических лекарственных препаратов, содержащих ионы магния, кальция, цинка, висмута, свинца, алюминия и др. Индикаторы, применяемые в комплексонометрии, называются металлоиндикаторами. Они представляют собой органические красители и образуют с ионами металлов непрочные ярко окрашенные комплексы. В конце титрования эти комплексы разрушаются, меняя окраску в эквивалентной точке. Металлоиндикаторы для комплексонометрии подбираются так, чтобы их взаимодействие с катионами определяемых металлов было обратимым и устойчивость соответствующих комплексов была заметно меньше устойчивости комплексонатов, образующихся в процессе титрования. Реакции метода: При добавлении металлоиндикатора к исследуемому раствору, содержащему ионы металлов, происходит образование комплекса (показано на примере двухзарядного металла):
синий винно-красный
При последующем добавлении титранта (трилона Б), последний вытесняет индикатор из его комплекса с катионом металла:
винно-красный синий Изменение окраски является следствием перехода индикатора в свободное состояние. В ГФ XII включены следующие металлоиндикаторы: ксиленоловый оранжевый, хальконкарбоновая кислота, хромовый темно-синий (кислотный хром темно-синий), эриохром черный Т (протравной черный II). Непременным условием комплексонометрического титрования является соблюдение определенного интервала значений рН, которое достигается с помощью буферных растворов. Титрование большинства катионов проводят обычно в среде аммиачного буфера, который поддерживает рН = 8 – 10. При рН меньше 8 равновесие уравнения (1) будет смещаться влево, т.о. не будет образовываться комплекс индикатора с металлом. При рН больше 10 будут выпадать в осадок гидроксиды определяемых металлов. При прямом титровании к анализируемому раствору солей кальция, магния, цинка, висмута, свинца и других добавляют необходимый объем буферного раствора для достижения нужного значения рН и указанное в частной статье количество металлоиндикатора. Затем титруют 0,05 М раствором трилона Б до тех пор, пока в эквивалентной точке не произойдет изменение окраски индикатора.
При обратном титровании избыток трилона Б, не вступивший во взаимодействие с анализируемым катионом, оттитровывают, используя в качестве титрантов растворы солей цинка, магния, свинца и др. Титруют в присутствии металлоиндикатора при определенном значении рН среды. Комплексонометрию используют для количественного определения неорганических фармакопейных препаратов магния (магния оксид, магния сульфат, магния карбонат основной); цинка (цинка оксид, цинка сульфат); свинца (свинца оксид); кальция (кальция хлорид); висмута (висмута нитрат основной). Кальциевые соли органических кислот, растворимые в воде (кальция лактат, кальция глюконат, кальция пангамат, кальция пантотенат), определяют так же, как и кальция хлорид. Нерастворимый в воде бепаск (n-бензоиламиносалицилат кальция) предварительно минерализиуют прокаливанием до образования оксида кальция, а затем растворяют в хлористоводородной кислоте и титруют раствором трилона Б. Комплексонометрию применяют и для количественного анализа органических и элементорганических соединений, в том числе и лекарственных веществ. Анализ может быть выполнен методом как прямого, так и обратного титрования по катиону металла, входящего в молекулу препарата, или по аниону с использованием титрованного раствора, содержащего катион металла. Ряд методик основан на образовании комплексных соединений с ионами меди (II), цинка, свинца и др. (избыток которых титруют трилоном Б). Аналогичным образом выполняют определение после осаждения препарата в виде соли. Осадительное титрование. а) аргентометрия основана на реакциях осаждения галогенидов (
Аргентометрическое титрование в зависимости от химических свойств лекарственного вещества может быть выполнено прямым, обратным и косвенным методами. Прямое титрование (метод Мора). Титрантом является серебра нитрат Реакции метода: Присутствующий в анализируемом образце ион галогена взаимодействует с титрантом, образуя осадок белого цвета в случае хлоридов, желтоватый – в случае бромидов и желтый – иодидов:
После осаждения всех ионов галогена, избыточная капля титранта взаимодействует с индикатором, образуя осадок красного цвета:
Обратное титрование (метод Фольгарда). При обратном аргентометрическом титровании используется два рабочих раствора: серебра нитрат Реакции метода: К анализируемому раствору добавляется избыток первого титрованного раствора:
Далее избыток серебра нитрата оттитровывается вторым рабочим раствором:
После того, как в растворе не останется серебра нитрата, избыточная капля аммония тиоционата взаимодействует с индикатором, образуя кроваво-красный раствор:
Этот же химический процесс лежит в основе количественного определения препаратов серебра. Он известен под названием тиоцианатометрии или роданометрии.
Косвенное титрование (метод Фаянса). Титрантом является серебра нитрат и используются так называемые адсорбционные индикаторы, которые показывают изменение цвета не в растворах, а на поверхности выпавшего осадка. Использование адсорбционных индикаторов основано на следующем. При титровании галогенидов образуется серебряная соль галогена, которая адсорбирует вначале на своей поверхности ионы галогена, находящиеся в избытке и заряжается отрицательно.
В конце титрования все галогены уже связаны, частицы теряют свой заряд и наблюдается процесс коагуляции. При добавлении даже незначительного избытка раствора
Прямым, обратным и косвенным аргентометрическим методом определяют неорганические лекарственные вещества, представляющие собой галогениды (хлориды, бромиды, иодиды) щелочных металлов, галогениды четвертичных аммониевых оснований (пентамин) и соли галогеноводородных кислот (гидрохлориды, гидробромиды, гидроиодиды) органических оснований, в том числе алкалоидов (морфина гидрохлорид, эфедрина гидрохлорид).
б) меркуриметия основана на образовании малодиссоциирующих соединений ртути (II). Например, при взаимодействии нитрата ртути с хлорид-ионами получается малодиссоциирующий дихлорид ртути:
В эквивалентной точке избыток свободных ионов титранта (
При титровании хлоридов в качестве индикаторов используют дифенилкарбазид или дифенилкарбазон:
дифенилкарбазон
дифенилкарбазид В эквивалентной точке они образуют сиреневого цвета комплексные соединения с ионом ртути (II), содержащимся в избытке титранта. Существует вариант меркуриметрического титрования, основанный на использовании в качестве титранта раствора перхлората ртути и индикатора – дифенилкарбазона. Он позволяет количественно определять хлориды металлов и гидрохлориды органических оснований в присутствии различных неорганических соединений, органических спиртов, альдегидов, кислот алифатической, ароматической и гетероциклической структуры. Недостатком метода является отсутствие селективности в присутствии солей бромоводородной и иодоводородной кислот. в) меркурометрия представляет собой метод определения анионов (главным образом галогенидов), образующих малорастворимые соединения с катионами ртути (I)
При определении галогенидов в меркурометрии в качестве индикаторов используют также бромфеноловый синий и дифенилкарбазон. Однако в отличие от кислотно-основного и меркуриметрического титрования они в данном случае выполняют роль адсорбционных индикаторов (подобно эозинату натрия в аргентометрии). Так, например, при титровании хлоридов образуется белый осадок
В эквивалентной точке избыточная капля титранта взаимодействует с индикатором, а он окрашивает поверхность осадка
Нитритометрия. Метод основан на реакциях первичных и вторичных ароматических аминов с нитритом натрия, который используют в качестве титранта. Первичные ароматические амины образуют с нитритом натрия в кислой среде диазосоединение:
Вторичные ароматические амины в этих условиях образуют N-нитрозосоединения:
Эквивалентную точку устанавливают с помощью внешних индикаторов (иодкрахмальная бумага); внутренних индикаторов (тропеолин 00, нейтральный красный, смесь тропеолина 00 с метиленовым синим) или потенциометрически. При потенциометрическом титровании индикаторным служит платиновый электрод, а электродом сравнения хлор серебряный или насыщенный каломельный. Нитритометрическое титрование проводят, как правило, при 15 – 20°С, в некоторых случаях анализируемый раствор охлаждают до 0 – 5° С. Кроме температуры на результаты нитритометрического титрования оказывают влияние концентрация хлористоводородной кислоты, природа растворителя и катализатора. В качестве последнего используют бромид калия. Он оказывает каталитическое действие на скорость титрования препаратов, повышает четкость перехода окраски внутренних индикаторов в точке эквивалентности и увеличивает скачок потенциала на платиновом электроде при потенциометрическом способе индикации. При использовании внешнего индикатора – иодкрахмальной бумаги – титрование ведут до тех пор, пока капля титруемого раствора, взятая через 1 мин после прибавления титранта, не будет немедленно вызывать синее окрашивание на полоске иодкрахмальной бумаги. Нитритометрию применяют в фармацевтическом анализе для определения сульфаниламидных препаратов (стрептоцид, норсульфазол, этазол, сульгин, сульфацил-натрий и др.), производных n-аминобензойной кислоты (анестезин, новокаин, новокаинамид), n-аминосалициловой кислоты (натрия n-аминосалицилат), представляющих собой первичные ароматические амины, а также вторичные амины (дикаин). Если первичная ароматическая аминогруппа ацилирована (парацетамол, стрептоцид растворимый), то обычно вещество предварительно гидролизуют. Ароматические нитропроизводные (левомицетин) вначале количественно восстанавливают до первичных аминов, а затем титруют нитритом натрия.
Вопросы для самоконтроля:
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 356; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.104.238 (0.054 с.) |
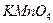 .
.
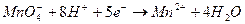

 ,
,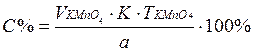 ,
,
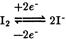
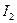 и
и  . Так как иод плохо растворяется в воде, его растворяют в растворе
. Так как иод плохо растворяется в воде, его растворяют в растворе 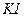 :
: 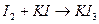



 . Осадки отфильтровывают, а избыток иода оттитровывают тиосульфатом натрия.
. Осадки отфильтровывают, а избыток иода оттитровывают тиосульфатом натрия.


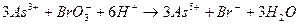



 ). Трилон Б образует с катионами различных металлов бесцветные, устойчивые и хорошо растворимые в воде комплексонаты.
). Трилон Б образует с катионами различных металлов бесцветные, устойчивые и хорошо растворимые в воде комплексонаты.
 (1)
(1)
 ) раствором нитрата серебра (титрант):
) раствором нитрата серебра (титрант):
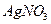 . Эквивалентную точку при прямом аргентометрическом определении устанавливают с помощью индикатора – калия хромата
. Эквивалентную точку при прямом аргентометрическом определении устанавливают с помощью индикатора – калия хромата  .
.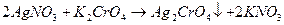
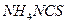 . Индикатором служат железоаммониевые квасцы.
. Индикатором служат железоаммониевые квасцы.




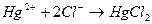
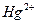 ) обнаруживают с помощью потенциометра или другими способами. При определении иодидов эквивалентную точку устанавливают по появлению красного осадка иодида ртути (II) вследствие разрушения образующегося в процессе титрования тетраиодомеркурат-иона:
) обнаруживают с помощью потенциометра или другими способами. При определении иодидов эквивалентную точку устанавливают по появлению красного осадка иодида ртути (II) вследствие разрушения образующегося в процессе титрования тетраиодомеркурат-иона: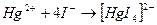

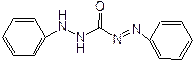

 , содержащимися в титранте – растворе
, содержащимися в титранте – растворе 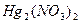 . Эквивалентную точку устанавливают по обесцвечиванию индикатора – тиоцианата железа (III)
. Эквивалентную точку устанавливают по обесцвечиванию индикатора – тиоцианата железа (III)  . Галогенид-ионы в процессе титрования полностью связываются в осадок
. Галогенид-ионы в процессе титрования полностью связываются в осадок  . При добавлении избыточной капли титранта ионы
. При добавлении избыточной капли титранта ионы 
 :
: