Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теплоемкость идеальных газов
Программа Понятие о теплоемкостигазов и удельной теплоемкости. Массовая, объемная, мольная теплоемкость, связь между ними. Зависимость теплоемкости от характера процесса. Теплоемкость при постоянном объеме и при постоянном давлении. Закон Майера, выражающий вязь между изобарной и изохорной теплоемкостью. Зависимость теплоемкости от температуры подвода теплоты. Средняя и истинная теплоемкость. Определение количества теплоты через среднюю теплоемкость.Теплоемкость смеси идеальных газов. Методические указания. Как правило, во всех расчетах используется удельная теплоемкость вещества - количество теплоты, которое нужно подвести или отвести от единицы вещества, чтобы изменить его температуру на 1 К (или градус). В зависимости от единицы вещества различают массовую(с, [ Дж/(кг × К) ]), объемную (с ¢, [ Дж/(м3 × К) ]) и мольную (m с, [ Дж/(кмоль × К) ]) теплоемкости. Мольная теплоемкость идеального газа зависит от его атомности. Зная мольную теплоемкость, можно получить массовую или объемную:
Количество теплоты, необходимое для изменения температуры тела на 1 К, в различных процессах не одинаково. Поэтому теплоемкость различают по процессами: изохорная сv, изобарная сp, изотермическая сt, адиабатная са, политропная сп. ct = ¥, са = 0, -¥< сп < +¥. Изохорно сv и изобарная сp теплоемкости имеют вполне определенные значения и связаны между собой уравнениями Майера и Пуассона; при этом сp > сv, так как при подведении теплоты к телу в изобарном процессе, она расходуется не только на изменение внутренней энергии тела, но и на работу расширения. Количество теплоты, которое обуславливает изменение температуры тела на 1 К, не одинаково при различных значениях температуры тела. Чем выше температура тела, тем больше нужно подвести к нему теплоты, чтобы изменить его температуру на 1 К. Поэтому введено понятие средней теплоемкости в некотором интервале температур (от t1 до t2). В справочных таблицах приведены значения средних теплоемкостей в интервале от 0°Сдо t, как правило, кратной 100°С. Средняя теплоемкость в заданном интервале температур определяется:
Если значение температуры нет в таблице, то значение теплоемкости при этой температуре определяют путем линейного интерполирования:
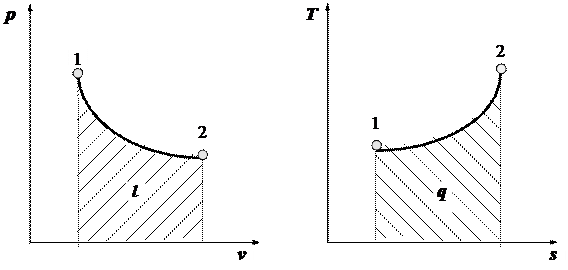
где t/ и t// – табличные значения температуры соответственно меньше и больше заданного значения t. Теплоемкость смесей подчиняется таким же закономерностям, что и другие удельные величины смесей: cсм = å gi × ci, c ¢ см = å ri × c ¢ i, m cсм = å ri × m ci. Первый закон термодинамики Программа Закон сохранения и превращения энергии. Калорические параметры. Внутренняя энергия. Энтальпия и энтропия как функции состояния тела. Теплота и работа как функции процесса. Выражение теплоты и работы через термодинамические параметры состояния. Рабочая (p - v) и тепловая (T - s) диаграммы. Графическое изображение работы и теплоты. Первый закон термодинамики, его содержание и формулировки. Две формы аналитического выражения первого закона термодинамики. Методические указания. Калорические параметры характеризуют тепловым (энергетическим) состоянием тела или системы. Внутренняя энергия u – это энергия хаотического движения молекул тела. Энтальпия i (h) включает в себя энергию движения молекул и работу, которую совершает газ объемом v при внесении его в среду с давлением р (i = u + p × v). Энтропия s характеризует степень теплового взаимодействия тела с окружающей средой. Она изменяется только тогда, когда происходит теплообмен. При изучении данной темы студент должен понять, что, несмотря на то, что работа и теплота - два различных способа передачи энергии, общее их свойство - передача энергии, оно может происходить только во время процесса - при чередовании параметров состояния рабочего тела. При этом должно быть условие протекания процесса (движущая сила) и его результат - изменение характерной для этого процесса свойства.Так, чтобы происходил теплообмен, нужны тела с разной температурой, то есть температура (Т) является потенциалом, движущей силой теплообмена; чтобы совершалось работа, нужно силовое воздействие, возникающее при разнице давления, то есть давление (р) является потенциалом, движущей силой механического воздействия - работы. В результате силового взаимодействия происходит изменение объема тела, и оно выполняет работу l = ò p ´ d v.
В результате теплового взаимодействия происходит изменение энтропии тела - передается теплота q = ò T ´ d s (см.рис.1).
а) б)
Рисунок 1 – Графическое определение работы в рабочей (а) и теплоты в тепловой (б) диаграммахпри произвольном термодинамическом процессе 1-2
Площадь, ограниченная линией процесса 1-2, осью v и координатами, проведенными на нее из точек 1 и 2, является графическим изображением работы в координатах p - v. Площадь, ограниченная линией процесса 1-2, осью s и координатами, проведенными на нее из точек 1 и 2, является графическим изображением теплоты в координатах T - s. Согласно этому, диаграмма p - v получила название рабочей, а диаграмма T - s – тепловой. Две формы аналитического выражения первого закона термодинамики: d q = d u + p × d v, d q = d i - v × d p.
|
||||||
|
Последнее изменение этой страницы: 2021-04-13; просмотров: 69; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.224.197 (0.005 с.) |
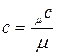
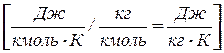 ;
; 
 .
.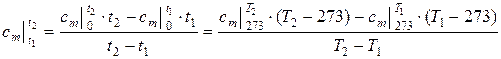 .(1.4)
.(1.4) , (1.5)
, (1.5)