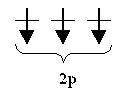Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химия – наука о веществах, их строении, свойствах и превращениях.
Все химические вещества состоят из частиц, классификация которых в химии достаточно сложна; химические превращения связывают, прежде всего, с такими частицами, как атом, молекула, ядро, электрон, протон, нейтрон, атомные и молекулярные ионы, радикалы. АТОМ. Атом — это наименьшая химическая частица вещества, состоящая из элементарных частиц: протонов р, нейтронов n и электронов е. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Атом — электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов. Хотя атомы образуются при взаимодействии всего лишь трех типов элементарных частиц, при их сочетании возникает большой набор разнообразных устойчивых или неустойчивых (радиоактивных) систем. При этом выяснилось, что всю совокупность образовавшихся таким образом атомов легко классифицировать всего лишь по одному параметру — заряду ядра z. ЭЛЕКТРОН. Первые указания о сложном строении атома были получены при изучении процессов прохождения электрического тока через жидкости и газы. Опыты выдающегося английского ученого М. Фарадея в 30-х гг. XIX в. навели на мысль о том, что электричество существует в виде отдельных единичных зарядов. Величины этих единичных зарядов электричества были определены в более поздних экспериментах по пропусканию электрического тока через газы (опыты с так называемыми катодными лучами). Было установлено, что катодные лучи — это поток отрицательно заряженных частиц, которые получили название электронов. В основе современной теории строения атома лежат следующие основные положения: 1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна: подобно частице, электрон обладает определенной массой и зарядом; в то же время движущийся поток электронов проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ, и его скорость v связаны соотношением де Бройля: λ = h / mv, где m — масса электрона. 2. Для электрона невозможно одновременно точно измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. АТОМНЫЕ ОРБИТАЛИ. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью. Орбиталь — совокупность положений электрона в атоме, т. е. область пространства, в которой наиболее вероятно нахождение электрона. КВАНТОВЫЕ ЧИСЛА. Главное квантовое число n определяет общую энергию электрона на данной орбитали. Оно может принимать любые целые значения, начиная с единицы (n = 1, 2, 3,...). Под главным квантовым числом подразумевают, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома). В пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями. Существование различий в энергетическом состоянии электронов, принадлежащих к различным подуровням данного энергетического уровня, отражается побочным (орбитальным)квантовым числом l. Это квантовое число может принимать целочисленные значения от 0 до n - 1 (l = 0, 1,..., п - 1). Обычно численные значения l принято обозначать следующими буквенными символами: s p d f, соответствующими числовым значениям, т.е 0 соответствует s, 1 – p и т.д. В этом случае говорят о s-, p -, d-, f- состояниях электронов, или о s-, p -, d-, f- орбиталях. Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака, а также орбитальный момент р — момент импульса электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа - орбитальное) p = ħ√ l(l+1). Таким образом, электрон, обладая свойствами частицы и волны, с наибольшей вероятностью движется вокруг ядра, образуя электронное облако, форма которого в s-, p -, d-,f-состояниях различна. Форма электронного облака зависит от значения побочного квантового числа l. Так, если l = 0 (s-орбиталь), то электронное облако имеет сферическую форму (шаровидную симметрию) и не обладает направленностью в пространстве. При l = 1 (р-орбиталь) электронное облако имеет форму гантели, т. е. форму тела вращения, полученного из «восьмерки». Формы электронных облаков d- и f-электронов намного сложнее.
Движение электрического заряда (электрона) по замкнутой орбите вызывает появление магнитного поля. Состояние электрона, обусловленное орбитальным магнитным моментом электрона (в результате его движения по орбите), характеризуется третьим квантовым числом — магнитным ml. Магнитноеквантовое число mlхарактеризует ориентацию орбитали впространстве, выражая проекцию орбитального момента импульса на направление магнитного поля. Соответственно ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля магнитное квантовое число ml может принимать значения любых целых чисел, как положительных, так и отрицательных, от - l до + l, включая 0, т.е. всего (2l + 1) значений. Например, при l = 0 ml = 0; при l = 1 ml = -1, 0, +1; при l = 3, магнитное квантовое число может иметь семь (2l + 1 = 7) значений: -3, -2, -1, 0, +1, +2,+3. Таким образом, ml характеризует величину проекции вектора орбитального момента количества движения на выделенное направление. Например, р-орбиталь в магнитном поле может ориентироваться в пространстве в трех различных положениях, так как в случае l = 1 магнитное квантовое число может иметь три значения: -1, 0, +1. Поэтому электронные облака вытянуты по координатным осям х, у и z, причем ось каждого из них перпендикулярна двум другим. Для полного объяснения всех свойств атома была выдвинута гипотеза о наличии у электрона так называемого спина. Спин — это квантовое свойство электрона, не имеющее классических аналогов, представляющий собой это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина всегда равно s = ½. Проекция спина на ось z(магнитное спиновое число ms) может иметь лишь два значения: ms = + ½ или ms = -1/2. Поскольку спин электрона s является величиной постоянной, его обычно не включают в набор квантовых чисел, характеризующих движение электрона в атоме, и говорят о четырех квантовых числах. Так как при химических реакциях ядра реагирующих атомов остаются без изменения (за исключением радиоактивных превращений), то физические и химические свойства атомов зависят, прежде всего, от строения электронных оболочек атомов. ПРИНЦИП ПАУЛИ. В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Хотя бы одно из квантовых чисел n, l, ml и ms должно обязательно отличаться. Так, электроны с одинаковыми квантовыми числами n, l, и ml должны обязательно различаться проекцией спина. Поэтому в атоме могут быть лишь два электрона с одинаковыми n, l, ml: один ms = + ½, другой ms = -1/2. Если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l или ml. Зная принцип Паули, рассмотрим, сколько электронов в атоме может находиться на определенной “орбите” с главным квантовым числом n. Первой «орбите» соответствует п = 1. Тогда l = 0, ml = 0 и ms может иметь произвольные значения: = + ½, или -1/2. Т. е. при п = 1, таких электронов может быть только два.
В общем случае при любом заданном значении n электроны прежде всего отличаются побочным квантовым числом l принимающим значения от 0 до п - 1. При заданных n и 1 может быть (21 + 1) электронов с разными значениями магнитного квантового числа ml. Это число должно быть удвоено, так как заданным значениям n, l, и ml соответствуют два разных значения проекции спина ms. Следовательно, максимальное число электронов с одинаковым квантовым числом n выражается суммой:
n-1 N = Σ= 2(2l + 1) = 2 (1+3+5+...) = 2n2 l=0 Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором — 8, на третьем — 18 и т. д. ПРАВИЛО ГУНДА. При данном значении l (т. е. в пределах определенного подуровня) электроны располагаются таким образам, чтобы суммарный спин был максимальным. Если, например, в трех р- ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т. е. размещаться на трех разных р-орбиталях:
Рассмотрим электронную конфигурацию атома четвертого периода 19К. Первые 18 электронов заполняют следующие орбитали: 1s22s22р63s23р6. Казалось бы, что девятнадцатый электрон атома калия 19К должен попасть на подуровень Зd, которому соответствуют п = 3 и l = 2. Однако на самом деле валентный электрон атома калия располагается на орбитали 4s. Дальнейшее заполнение оболочек после 18-го элемента происходит не в такой последовательности, как в двух первых периодах. Электроны в атомах располагаются в соответствии с принципом Паули и правилом Гунда, но так, чтобы их энергия была наименьшей. ПРИНЦИП НАИМЕНЬШЕЙ ЭНЕРГИИ. В атоме каждый электрон располагается так, чтобы его энергия была минимальной(что отвечает его наибольшей связи с ядром). Энергия электрона в основном определяется главным квантовым числом п и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел п и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне Зd, так как в первом случае n + l = 4 + 0 = 4,а во втором n + l = 3 + 2 = 5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т. д. В. М. Клечковский сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимально возможным значением n, а с наименьшим значением суммы n + l. В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т. е. Зd-4р-5s и т. д. Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.
|
|||||||
|
Последнее изменение этой страницы: 2021-04-12; просмотров: 69; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.168.87 (0.01 с.) |