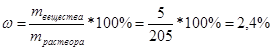Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция № 2 растворы. Химическое равновесие. Равновесие в гетерогенной системе раствор – осадок.Стр 1 из 2Следующая ⇒
Лекция № 2 РАСТВОРЫ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ. РАВНОВЕСИЕ В ГЕТЕРОГЕННОЙ СИСТЕМЕ РАСТВОР – ОСАДОК. Содержание лекции Общие понятия о растворах. Способы выражения состава раствора. Химическое равновесие. Константа химического равновесия, способы ее выражения. Смещение химического равновесия. Слабые, сильные электролиты. Электролитическая диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели. Растворимость. Равновесие в гетерогенной системе раствор-осадок. Произведение растворимости (ПР). Условия образования и растворения осадков. Дробное осаждение и разделение. Гидролиз солей.
Растворами называют гомогенные системы, состоящие из двух и более компонентов. Компонентами раствора являются растворитель и растворенные вещества.
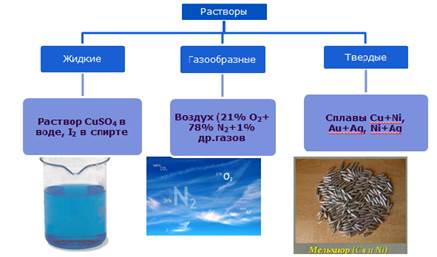
Растворы бывают жидкие (растворы солей, сахара, спирта, кровь, моча), твердые (сплавы металлов) и газообразные (воздух).
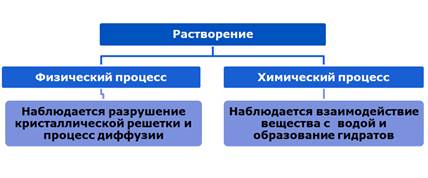
Растворение – это физико-химический процесс. При физическом процессе происходит разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя. Химический процесс – это взаимодействие молекул растворителя с частицами растворенного вещества с образованием сольватов (в случае воды гидратов). Процесс образования сольватов называется – сольватация (гидратация).
Физический процесс идет с поглощением энергии, химический – с выделением.
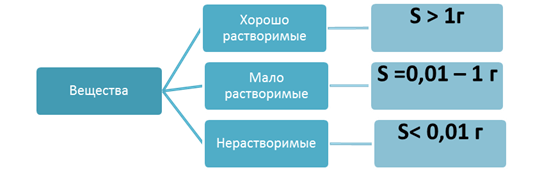
Растворимость – свойство вещества растворяться в воде или другом растворе. Коэффициент растворимости (S) – максимальное число г вещества, которое может раствориться в 100г растворителя при данной температуре.
На растворимость веществ влияют следующие факторы: природа вещества и растворителя, температура.
При растворении веществ могут образовываться насыщенные, насыщенные и перенасыщенные растворы. Насыщенный раствор – это раствор, который содержит максимальное количество растворяемого вещества при данных условиях. При добавлении вещества в такой раствор вещество больше не растворяется. Насыщенный раствор можно получить, если осторожно слить раствор над осадком в другую пробирку. Ненасыщенный раствор – это раствор, который содержит меньше растворяемого вещества. При добавлении вещества в такой раствор вещество еще растворяется.
Иногда удается получить раствор, в котором растворенного вещества содержится больше, чем в насыщенном растворе при данной температуре. Такой раствор называется перенасыщенным.
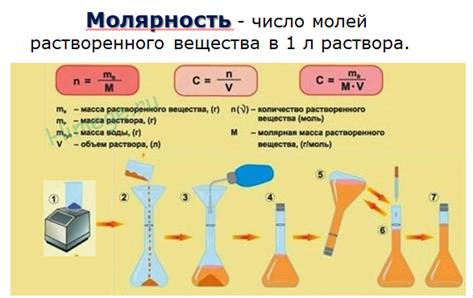
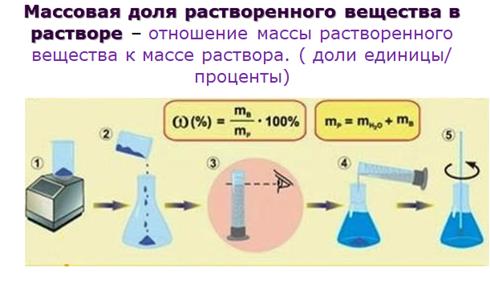
Концентрация вещества в растворе может быть выражена несколькими способами: Например, растворили 5 г натрия хлорида в 0,2 л воды
Рассчитаем молярную концентрацию вещества:
Рассчитаем процентное содержание натрия хлорида в растворе
Задача №1 Рассчитайте значения константы равновесия: AgCl(т) + 2NH3 = [Ag(NH3)2]Cl Ход решения 1. Определим агрегатное состояние исходных веществ и продуктов и запишем в скобках AgCl(т) + 2NH3(г) = [Ag(NH3)2]Cl (ж) 2. AgCl – нерастворим в воде характеризуется как все осадки ПР NH3 – входит без изменения в продукт поэтому К=1 [Ag(NH3)2] — комплексная частица, слабый электролит характеризуется Кнест. 3. Запишем формулу расчета Кр Кр = произведение констант исходных веществ / произведение констант продуктов реакции Подставим значения Кр= Кр<1, поэтому преобладает обратная реакция, для сдвига равновесия в сторону образования продуктов необходимо добавить избыток аммиака.
Умение рассчитать константу химического равновесия необходимо для предсказания будет протекать данная химическая реакция или нет, какие условия необходимо создать для протекания химической реакции.
Задача 1. Вычислить рН в 0,01М HCl и NaOH
Решение. Значение рН=–lg 0,01 =2. Гидроксид натрия относится к сильным основаниям, поэтому можно принять концентрацию гидроксил-ионов равной концентрации основания[ОH-] = 0,01 моль/л Значение рН= 14–lg [ОH-] =12.
4. Растворимость. Равновесие в гетерогенной системе раствор-осадок. Произведение растворимости (ПР). Условия образования и растворения осадков. Дробное осаждение и разделение.
В растворе с осадком происходят постоянные процессы растворения осадка и осаждения. Концентрация ионов в растворе над осадком величина постоянная Произведение концентраций ионов в насыщенном растворе труднорастворимого электролита постоянная величина называется произведением растворимости ПР Например для CaCO3 ПР = [Са2+][СО32-]= 4,76 ∙ 10-9 (справочная величина).
Гидролиз солей Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого изменяется рН среды.
рН воды=7, но при растворении хлорида железа (III) рН-метр выдает значение 2,34. Откуда в растворе соли появляются ионы водорода? И учеными было выяснено, что некоторые соли реагируют с водой.
1. Соли, образованные катионом сильного основания и анионом сильной кислоты не подвергаются гидролизу: NaCl, K2SO4, NaNO3. Имеют нейтральную реакцию среды, рН = 7. 2. Соли образованные катионом сильного основания и слабой кислоты подвергаются гидролизу по аниону: Na2CO3, Na2S, K2SO3, CH3COOK, NaCN, Ba(NO2)2. Na2S + H2O ↔ NaHS + NaOH 2Na+ + S2- + H2O ↔ Na+ + HS- + Na+ + OH- S2- + H2O ↔ HS- + OH- Растворы имеют щелочную реакцию среды, рН>7. 3. Соли образованные катионом слабого основания и сильной кислоты подвергаются гидролизу по катиону: ZnCl2, FeCl3, CuCl2, NH4I, Al2(SO4)3. FeCl2 + H2O ↔ FeOHCl + HCl Fe2+ 2Cl- + H2O ↔ FeOH- +Cl- + H+ + Cl- Fe2+ + H2O ↔ FeOH+ + H+ Растворы имеют кислотную реакцию среды, рН<7. 4. Соли образованные катионом слабого основания и слабой кислоты подвергаются гидролизу по катиону и аниону: CH3COONH4, (NH4)2S, NH4CN CH3COONH4 +HOH↔CH3COOH+NH4OH CH3COO- + NH4+ +HOH↔CH3COOH+NH4OH В результате гидролиза ацетата аммония происходит образование двух слабых электролитов, раствор оказывается близким к нейтральному, рН~7.
Лекция № 2 РАСТВОРЫ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ. РАВНОВЕСИЕ В ГЕТЕРОГЕННОЙ СИСТЕМЕ РАСТВОР – ОСАДОК. Содержание лекции Общие понятия о растворах. Способы выражения состава раствора. Химическое равновесие. Константа химического равновесия, способы ее выражения. Смещение химического равновесия. Слабые, сильные электролиты. Электролитическая диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели. Растворимость. Равновесие в гетерогенной системе раствор-осадок. Произведение растворимости (ПР). Условия образования и растворения осадков. Дробное осаждение и разделение. Гидролиз солей.
Растворами называют гомогенные системы, состоящие из двух и более компонентов. Компонентами раствора являются растворитель и растворенные вещества.
Растворы бывают жидкие (растворы солей, сахара, спирта, кровь, моча), твердые (сплавы металлов) и газообразные (воздух).
Растворение – это физико-химический процесс. При физическом процессе происходит разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя.
Химический процесс – это взаимодействие молекул растворителя с частицами растворенного вещества с образованием сольватов (в случае воды гидратов). Процесс образования сольватов называется – сольватация (гидратация).
Физический процесс идет с поглощением энергии, химический – с выделением.
Растворимость – свойство вещества растворяться в воде или другом растворе. Коэффициент растворимости (S) – максимальное число г вещества, которое может раствориться в 100г растворителя при данной температуре.
На растворимость веществ влияют следующие факторы: природа вещества и растворителя, температура.
При растворении веществ могут образовываться насыщенные, насыщенные и перенасыщенные растворы. Насыщенный раствор – это раствор, который содержит максимальное количество растворяемого вещества при данных условиях. При добавлении вещества в такой раствор вещество больше не растворяется. Насыщенный раствор можно получить, если осторожно слить раствор над осадком в другую пробирку. Ненасыщенный раствор – это раствор, который содержит меньше растворяемого вещества. При добавлении вещества в такой раствор вещество еще растворяется. Иногда удается получить раствор, в котором растворенного вещества содержится больше, чем в насыщенном растворе при данной температуре. Такой раствор называется перенасыщенным.
Концентрация вещества в растворе может быть выражена несколькими способами: Например, растворили 5 г натрия хлорида в 0,2 л воды
Рассчитаем молярную концентрацию вещества:
Рассчитаем процентное содержание натрия хлорида в растворе
|
||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 442; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.79.59 (0.022 с.) |




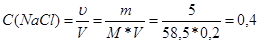 моль/л.
моль/л.