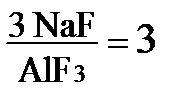Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сырьё и материалы для производства алюминияСтр 1 из 39Следующая ⇒
Учебное пособие
по междисциплинарному курсу МДК 01.02
МЕТАЛЛУРГИЯ АЛЮМИНИЯ для студентов специальности 22.02.02. Металлургия цветных металлов
Разработка и оформление преподавателя Минаковой Л.Н.
В учебном пособии приведены следующие темы: сырьё для производства алюминия электролизом и требования к нему, теория электролиза криолитоглиноземных расплавов, состав и свойства промышленных электролитов, электродные процессы, конструкция и монтаж электролизеров, основы АСУТП электролиза, обслуживание электролизёров и нарушения технологии, производство АВЧ, получение товарной продукции из алюминия, вопросы экологии и экономии сырья.
Содержание Предисловие. 3 Введение. 4 1 Сырьё и материалы для производства алюминия. 6 1.1 Глинозём.. 6 1.2 Фтористые соли.. 9 1.3 Углеродистые изделия. 12 2 Теоретические основы электролиза глинозёма. 17 2.1 Основы электрохимии.. 17 2.2 Характеристика криолита как растворителя глинозёма. 17 2.3 Состав промышленного электролита. 18 2.4 Свойства промышленного электролита. 19 3 Теоретические основы электролиза глинозема. 24 3.1 Сущность электролиза глинозёма. 24 3.2 Напряжение разложения. 24 3.3 Процессы, протекающие на электродах. 25 3.4 Анодный эффект. 26 3.5 Поведение примесей, попадающих в электролит. 27 4 Технико-экономические показатели процесса электролиза. 29 4.1 Законы Фарадея. 29 4.2 Выход по току. 29 4.3 Удельный расход электроэнергии.. 30 4.4 Выход по энергии.. 30 4.5 Зависимость выхода по току от переменных факторов. 31 5 Конструкция алюминиевых электролизёров. 34 5.1 Классификация электролизеров. 34 5.2 Катодное устройство электролизера. 35 5.3 Анодное устройство. 36 5.4 Катодная и анодная ошиновка. 37 6 Монтаж и демонтаж, обжиг и пуск электролизёров. 39 6.1 Материалы для монтажа электролизёра. 39 6.3 Монтаж катодного устройства. 40 6.4 Локальный ремонт электролизёров. 42 6.5 Обжиг электролизёров. 42 6.6 Пуск электролизёра и послепусковой период. 44 6.7 Демонтаж электролизера. 45 6.8 Срок службы электролизеров. 45 7 Обслуживание алюминиевых электролизёров. 47 7.1 Параметры работы электролизера. 47 7.2 Поддержание технологических параметров в заданных пределах. 47 7.3 Обслуживание катодного устройства. 48 7.4 Обслуживание анодного устройства. 50
7.5 Механизация электролизного производства. 51 8 Магнитное поле в электролизере. 53 9 Автоматизация процесса электролиза. 54 10 Нарушения технологии электролиза алюминия. 55 11 Электролизный цех. 57 11.1 Серия корпусов электролиза. 57 11.2 Вентиляция и газоотсос. 58 12 Очистка анодных газов и регенерация фтористых солей.. 59 12.1 Извлечение фтористых солей из отходящих газов. 59 12.2 Извлечение фтористых солей из угольной пены и футеровки ванн.. 60 12.3 Утилизация прочих отходов. 61 13 Литейное отделение и другие производства. 62 13.1 Качество алюминия и первичное рафинирование. 62 13.2 Технология и оборудование литейного производства. 63 14 Получение алюминия высокой чистоты.. 65 15 Промышленная безопасность и экология. 70 16 Себестоимость алюминия. 73
Предисловие Получение легких металлов в элементарном состоянии – одна из труднейших задач химической технологии и металлургического производства, что обусловлено высокой химической активностью этих металлов и термодинамической прочностью образуемых ими соединений. В связи с этим выделение легких металлов в свободном виде стало практически возможным только в начале XIX в. благодаря успехам электрохимии и использованию в качестве восстановителя электрического тока или полученных электролизом щелочных металлов. Электролиз расплавов и высокотемпературное металлотермическое восстановление являются основой современного промышленного производства алюминия, магния, бериллия и других легких металлов. Таким образом, близость химической природы этих элементов определяет единство используемых на практике приемов и технологий. Легкие металлы, особенно щелочные и щелочноземельные, имеют высокий отрицательный потенциал по отношению к водороду, что делает невозможным их выделение из водного раствора даже при больших плотностях тока, вызывающих значительное перенапряжение выделения водорода. В этом случае водород представляет собой электроположительную примесь, что приводит к первичной потере по току металлов в ходе электролиза. Все промышленно освоенные методы электролитического производства легких металлов основаны на электролизе расплавов, к проведению которого предъявляются однотипные требования:
- высокая чистота соединений, используемых при электролизе, без более электроположительных примесей и воды; - электрохимическая и термическая устойчивость соединений, применяемых в качестве растворителей или корректирующих добавок; - возможность поддержания достаточно высокой активности разряжающихся ионов в расплаве; - низкая температура плавления электролита и высокая электропроводность при температуре процесса; - малая летучесть электролита, то есть низкое давление паров над расплавом используемых компонентов; - низкая вязкость и оптимальная плотность электролита, обеспечивающие разделение металла и электролита в расплавленном состоянии (ликвацию); - низкая химическая активность электролита по отношению к выделенному металлу; - низкая коррозионная активность по отношению к оборудованию. Несмотря на значительные успехи, достигнутые металлургией в области получения легких металлов, их производство остается технически сложным, высокоэнергоемким, опасным и требует дальнейшего совершенствования. Алюминиевая промышленность России занимает доминирующее положение в производстве цветных металлов в стране и по выпуску первичного алюминия находится в группе мировых лидеров. В условиях изменяющейся стратегии отрасли возникают значительные изменения в подходах к содержанию и направлению модернизации, проектированию и строительству производящих алюминий предприятий. Новые задачи в сфере подготовки специалистов были поставлены Федеральным государственным образовательным стандартом. Область профессиональной деятельности выпускников КГБПОУ КрИМТ - это производство цветных металлов и сплавов и организация деятельности структурного подразделения. Объектами профессиональной деятельности выпускников являются: - технологические процессы производства цветных металлов и сплавов; - основное и вспомогательное оборудование; - руды и рудное сырье; - техническая, технологическая и нормативная документация; - первичные трудовые коллективы. Выпускниктехникума должен быть готов к следующим видам деятельности: - Подготовка и ведение технологического процесса производства цветных металлов и сплавов. - Обслуживание основного, вспомогательного технологического оборудования и коммуникаций в производстве цветных металлов и сплавов. - Контроль промежуточных и конечных продуктов в производстве цветных металлов и сплавов. - Планирование и организация работы коллектива исполнителей и обеспечение безопасности труда на производственном участке. - Выполнение работ по одной или нескольким профессиям рабочих, должностям служащих.
В данном учебном пособии рассмотрены вопросы, без знания которых в настоящих условиях и в ближайшем будущем невозможно эффективное управление процессом электролиза и дальнейшее повышение его технико-экономических показателей: производство фторсолей и угольных электродов, основы электрохимии и теоретические основы электролиза глинозёма, ведение технологии, конструкция и монтаж электролизёров, производство готовой продукции и переработка отходов, производство алюминия высокой чистоты.
Предлагаемое учебное пособие является междисциплинарным и рекомендуется к использованию студентами КГБПОУ КрИМТ, обучающимся по специальности 22.02.02 Металлургия цветных металлов.
Введение Цветная металлургия отличается исключительным разнообразием применяемых технологических схем, процессов и аппаратов. А сочетание в технологических схемах пиро- и гидрометаллургических процессов позволяет успешно решать задачи: - повышения степени извлечения ценных компонентов и - комплексности использования перерабатываемого сырья, - создания мало- и безотходных технологий, - охраны окружающей среды. Современные металлургические процессы получения цветных металлов должны удовлетворять следующим основным требованиям: I) высокая удельная производительность применяемых аппаратов; 2) высокая производительность труда (выпуск продукции на одного работника в количественном или стоимостном выражении); 3) высокая степень извлечения всех ценных составляющих; 4) высокая степень комплексности использования сырья; 5) минимальные затраты тепловой или электрической энергии; 6) максимальное использование вторичных энергоресурсов; 7) комплексная механизации и автоматизации всех операций; 8) использование дешевой, долговечной и удобной в работе, пуске, наладке и ремонте аппаратуры; 9) создание непрерывных, поточных, полностью автоматизированных технологических линий получения металлов с частичным или полным программным управлением; 10) обеспечение безопасных и безвредных условий труда и охраны окружающей природы. Совершенствование существующих и создание новых технологий и аппаратов, максимально удовлетворяющих требованиям современности, возможно лишь при условии глубокого понимания структуры металлургического процесса и возможностью управления скоростью его протекания. Любой металлургический процесс это сложный комплекс последовательно и одновременно протекающих физико-химических превращений и взаимодействий. В химической науке принято считать, что с древности человечеству было известно всего семь металлов: золото, серебро, ртуть, медь, железо, олово, свинец. Алюминий не входит в их число, однако история хранит одну интересную легенду о некоем мастере, который подарил римскому императору Траяну легкий меч из серебристого металла. А когда Траян его нечаянно уронил - меч погнулся. На вопрос императора, из чего же сделан этот меч, кузнец ответствовал: из глины. Император приказал кузнеца казнить, а меч запрятать подальше - он боялся, что металл, похожий на серебро, попросту обесценит последнее.
Легенда кажется невероятной – ведь алюминий проявляет большое сродство к кислороду, легко окисляясь и образуя устойчивый оксид. Выделить из оксида алюминий в металлическом виде способен только электрический ток или очень сильные восстановители - щелочные металлы натрий или калий, для получения которых опять же необходимо недоступное древним римлянам электричество. Первый документально подтвержденный факт получения алюминия в лаборатории - 1825 год. Датский физик Ганс Эрстед восстановил алюминий из оксида раствором калия в ртути. Калий Эрстед получил электролизом. Впоследствии, в 1854 году, француз Анри Этьен Сент-Клер Девиль разработал промышленный способ получения алюминия восстановлением его оксида с помощью более дешевого и безопасного в обращении натрия. Однако для производства металлического натрия тоже требовалось электричество. Кроме того, все щелочные металлы в чистом виде пожароопасны. Поэтому уже в 1856 году Сент-Клер Девиль получает алюминий, проводя электролиз расплава его хлорида. Всего методом Сент-Клер Девиля с 1856 по 1890 год произведено 200 тонн металлического алюминия - ничтожная цифра по сравнению с масштабами алюминиевой индустрии XXI века. Следующий шаг в алюминиевой технологии сделал американец Чарльз Мартин Холл, который после долгих поисков разработал технологию электролитического получения алюминия из криолитоглиноземных составов. В 1886 году Холл получает патент на свою технологию, а уже в 1888 основывает "Aluminum Company of America". В сотрудничестве с французским химиком Полем Эру довел до совершенства технологический процесс, который получил название Холла-Эру и лег в основу технологии Содерберга. Технология Содерберга была предложена в 1920-х годах норвежскими исследователями и внедрена советскими металлургами в ходе индустриализации сталинских пятилеток. Основное её отличие от технологии Холла-Эру - самообжигающиеся угольные аноды. Но у технологии Содерберга есть существенный недостаток - при электролизе глинозема выделяется агрессивный кислород, который тут же "сжигает" угольный анод, образуя оксиды углерода, а также ядовитые смолистые соединения и страшный канцерогенный яд - бенз(а)пирен. Все ведущие алюминиевые компании постепенно закрывают "содерберговские" производства. Сегодня по этой технологии в мире выплавляется не более 15% первичного алюминия. Китай закрыл последний такой завод в 2005 году, Norsk Hydro отказалась от этой технологии в 2009 году, Канада установила крайний срок прекращения производства "по Содербергу" в 2015 году. В настоящее время на территории России находятся несколько заводов по производству первичного алюминия, часть из них объединены в крупные алюминиевые корпорации. Крупнейшая компания - РУСАЛ, в состав которой входят: Братский (БрАЗ), Саяногорский (САЗ), Красноярский (КрАЗ), Новокузнецкий (НкАЗ) алюминиевые заводы, Ачинский глинозёмный комбинат и ряд заводов по производству изделий из алюминия. РУСАЛ входит в тройку крупнейших производителей алюминия в мире. Более половины производимого предприятиями РУСАЛа алюминия производится по технологии Содерберга. Проблема внедрения новых экологически чистых технологий взамен устаревшего Содерберга особенно актуальна для Красноярска, где алюминиевый завод - один из основных загрязнителей города. Проведённая на заводе модернизация оборудования и технологии - так называемый "экологический Содерберг"- в основном касается снижения энергозатрат и повышения производительности и лишь частично снижает выбросы.
Гораздо перспективнее выглядит технология электролиза с применением инертных анодов, в этом случае выбросы в окружающую среду минимальны, однако технология еще испытывается. Второй по величине алюминиевой компанией России является ОАО СУАЛ, включающее в себя Иркутский (ИркАЗ), Уральский (УАЗ), Кандалакшский (КАЗ), Волгоградский (ВгАЗ), Надвоицкий (НАЗ) алюминиевые заводы, Полевский криолитовый завод, научно-исследовательский и проектный институт «СибВАМИ» и др. Эта компания занимает 2 место в нашей стране по производству алюминия и 1 место - по производству глинозёма. Алюминий является важнейшим цветным металлом, по объему производства намного опережающим другие цветные металлы, а среди конструкционных материалов уступающим только стали. Алюминий обладает высокой коррозионной стойкостью вследствие образования на его поверхности тонкой прочной пленки его оксида Al2O3, и чем чище алюминий, тем выше его коррозионная стойкость. Высокий спрос на алюминий и, соответственно, высокие темпы роста производства обусловлены его уникальными физико-химическими свойствами, благодаря которым он нашел широкое применение в электротехнике, авиа- и автостроении, транспорте, производстве бытовой техники, строительстве, упаковке пищевых продуктов и других отраслях. Алюминий легко обрабатывается литьём и давлением, сваривается всеми видами сварки (обработка резанием затруднена) и изготовляется в виде листов, профилей, прутков, проволоки и других полуфабрикатов. Технический алюминий применяют для изготовления элементов конструкции и деталей, не несущих нагрузки, но когда требуется высокая пластичность, хорошая свариваемость, сопротивление коррозии и высокие тепло- и электропроводность. Из технического алюминия изготовляют различные трубопроводы, палубные надстройки морских и речных судов, кабели, электропровода, шины, конденсаторы, корпуса часов, витражи, перегородки в комнатах, двери, рамы, посуду, цистерны для молока и т.д. Алюминий высокой чистоты предназначается для фольги, токопроводящих и кабельных изделий. Россия по-прежнему сохраняет ведущие позиции в мировом производстве и экспорте первичного алюминия. Однако для российской алюминиевой промышленности характерна зависимость от рынка глинозёма - основного сырьевого материала.
Глинозём Промышленное производство алюминия основано на применении глинозёма – обогащённой алюминиевой руды. Свойства глинозема влияют на его расход, на расход анода и фторидов, на затраты электроэнергии, запыленность атмосферы в рабочей зоне, качество улавливания фтора и др. Около 95 % всего глинозема для производства алюминия в мире получают из бокситовых руд. Боксит (фр. bauxite) получил название по местности Baux на юге Франции. Химический состав бокситов и их физические свойства весьма разнообразны: - содержание Al2O3 от 35 до 60% и выше; SiO2 – от десятых долей до 25%; Fe2O3 – от 2 до 40%; - содержание TiO2 – от следов до 11%; ванадия 0,025-0,15%, галлия 0,001-0,007%; - по содержанию оксидов железа различают бокситы маложелезистые до 10%, железистые 10-18% и высокожелезистые более 18%; - в зависимости от содержания СО2, бокситы делятся на малокарбонатные до 0,6%, карбонатные 0,6–2% и высококарбонатные более 2%; - по содержанию серы, до 0,35% S относят к малосернистым, от 0,3 до 0,8% – к сернистым, и более 0,8% – к высокосернистым бокситам. На сегодняшний день главными поставщиками бокситов в мире являются: Австралия, Гвинея, Центральная Америка (Гайана, Ямайка, Суринам, Бразилия. В Европе все месторождения истощены, в Греции есть бокситы низкого качества. В России немногочисленные месторождения бокситов на северном Урале, Ямале и в Забайкалье. Требования к глинозёму как сырью для электролиза Глинозем представляет собой белый абразивный, мелкокристаллический порошок, нерастворимый в воде. Типичные производственные требования к глинозёму при электролизе: - хорошая растворимость в электролите, без образования осадка; - минимальное содержание вредных примесей, снижающих сорт алюминия; - хорошая текучесть при возможно меньшем пылении, обеспечивающая транспорт в склады и в бункера АПГ, - угол естественного откоса 29-32 градуса (важно при загрузке на корку электролита); - адсорбционная активность для поглощения поверхностью летучих фтористых соединений; - диапазон содержания фракций – 45 мкм 5–30 % (до 50%); + 150 мкм 1–6 % (до 30%), - удовлетворительные теплофизические свойства. В алюминиевом электролизере глинозем выполняет множество функций: - является основным расходуемым компонентом, который растворяется в электролите и подвергается электролитическому разложению с получением алюминия и анодных газов; - участвует в образовании корки над электролитом и боковой настыли; - является тепловой изоляцией и герметизацией ванны, находясь на корке электролита; - защищает анод от окисления; - улавливает пары фторидов; - укрывает обожжённые аноды, предотвращая их окисление - является адсорбентом газообразных и твёрдых фторидов в сухой газоочистке. Глинозем выпускают следующих типов в зависимости от гранулометрического состава и содержания α-Al2O3: - мучнистый (пылевидный); - песчаный (крупнозернистый), - фторированный (поступает с сухой газоочистки). К глинозему, используемому для производства алюминия, предъявляются требования по химическому составу в соответствии с ГОСТ 30558–2017. На КрАЗе применяют глинозём всех марок, его практический расход на 1 тонну алюминия ≈ 1925 кг (теоретический 1889 кг). Глиноземы отличаются большим разнообразием свойств, и если их не учитывать, то это может нанести технологии, экономике и экологии серьезный ущерб. Содержание примесей в глинозёме Глинозем должен содержать минимально возможное количество оксидов железа, кремния и других более электроположительных, чем алюминий, элементов, так как, выделяясь на катоде с алюминием, они ухудшают его качество. Нежелательно присутствие в глиноземе оксидов щелочных и щелочноземельных металлов, поскольку они, вступая во взаимодействие с AlF3, изменяют состав электролита, что вызывает необходимость его корректировки 3 Na2О + 2 АlF3 = 6 NaF + Аl2О3 (1.2) С увеличением содержания оксида натрия возрастает расход фторида алюминия, что видно из следующих данных: Содержание Na2O в Al2O3, % 0,25 0,3 0,35 0,4 0,6 Расход AlF3, кг/т Al 10,0 13,8 17,5 24,7 35,3 При содержании Na2O в глиноземе более 0,33 % начинает нарабатываться излишнее количество электролита, который надо выливать из ванны. Кроме того, оксиды Na и К, проникая в угольную футеровку, снижают срок службы ванны. Крайне нежелательно присутствие влаги в глиноземе, так как при взаимодействии воды с криолитом и фторидом алюминия образуется фтористый водород HF: 2Na3AlF6 + 3H2O = Al2O3 + 6NaF + 6HF↑ (1.3) 2AlF3 + 3H2O = Al2O3 + 6HF↑ (1.4) что приводит к дополнительному расходу фторидов и загрязнению воздуха. Как следует из этих реакций, из каждых 18 г воды, попавших в электролит, образуется 56 г HF. Фтористые соли Алюминий очень электроотрицательный металл, поэтому получить его возможно только электролизом из расплава. Промышленным способом получения алюминия служит электролиз его оксида, растворённого в криолите. 1.2.1 Свойства фторсолей и технические требования к ним Криолит – двойная соль фторида натрия и фторида алюминия 3NaF*AlF3 или Na3AlF6. Криолит служит расплавленной средой – электролитом, в котором осуществляется электролиз глинозёма. Для улучшения свойств криолита и корректировки состава электролита в него вводят AlF3, MgF2, CaF2, LiF и другие фтористые соли. В переводе с греческого криолит значит “ледяной камень”, так как по внешнему виду сходен со льдом. Естественный криолит в природе распространён ограниченно. Единственное в мире промышленное месторождение криолита находится в Гренландии. Весь криолит для электролиза алюминия получают искусственным путём. Искусственный криолит готовят обычно с избытком AlF3 против его теоретической формулы, вплоть до состава 5NaF*3AlF3 (или Na5Al3F14), что соответствует составу природного минерала хиолит с молекулярным отношением NaF/AlF3 = 1,66. Искусственный криолит – серовато-белый порошок, плохо растворим в воде. Плотность при 20 °С равна 2,95 г/см3. Плавится при t =1008 °С, плотность расплавленного криолита 2,09 г/см3, электропроводность 2,67 Ом-1*см-1 (См/см). Молярное отношение NaF/AlF3 называют криолитовым отношением (КО) Для чистого криолита КО = Фтористый алюминий AlF3 – бело-розоватый порошок с плотностью 2,88 г/см3, плохо растворим в воде. Кристаллический AlF3 при нагревании не плавится, а сублимирует и при t = 1260 оС упругость его паров равна атмосферному давлению. Является наиболее летучим компонентом электролита алюминиевой ванны. Фтористый натрий NaF – кристаллическая соль, ядовитое вещество, плохо растворим в воде. При 20 °С имеет плотность 2,73 г/см3. Плавится при t = 992 оС, кипит при t = 1695оС, плотность при 1000 оС равна 1,942 г/см 3. Чтобы получаемый алюминий был необходимой чистоты, криолит и фтористые соли должны содержать минимум примесей в виде соединений элементов с более электроположительным потенциалом, чем потенциал алюминия. А для лучшего протекания процесса электролиза, фторсоли должны содержать минимальное количество влаги и сульфатов, приводящих к разложению криолита в расплавленном состоянии. Эти требования, предъявляемые алюминиевой промышленностью к искусственному криолиту и фторсолям, регламентируются техническими условиями: - На криолит искусственный технический ГОСТ 10561-80. - На алюминий фтористый технический ГОСТ 19181-78. - На натрий фтористый технический ТУ 113-08-586-86. - На соду ГОСТ 5100-85. Исходный криолит может быть получен кислотным или щелочным способами, а также из отходов газов суперфосфатного производства. Углеродистые изделия Металлургия цветных металлов и, в частности, алюминиевая промышленность являются крупными потребителями углеродистых изделий, в том числе электродов. Электродами называют проводники, служащие для подвода электрического тока к среде, на которую он воздействует: водный раствор, расплав или твердое раскаленное вещество. Электроды изготавливают из токопроводящих материалов: серебра, меди, алюминия, железа и углеродистых материалов. Также из углеродистых материалов изготавливают блоки, плиты и другие изделия для футеровки аппаратов, в которых протекают электрохимические и химические процессы. 1.3.1 Виды углеродистых изделий и требования к ним В алюминиевой промышленности применяют углеродные изделия двух видов 1) электродные массы: анодная, подштыревая и подовая; 2) прессованные изделия: призматические и цилиндрические электроды, катодные (подовые) и боковые блоки. Шахту алюминиевого электролизера выполняют из углеродных блоков - практически единственного материала, стойкого к воздействию расплавленного алюминия и электролита. В зависимости от расположения в ванне, блоки бывают: 1) п о довые (катодные) блоки, используемые для футеровки подины (дна) ванны электролизера; 2) боковые и угловые блоки, используемые для футеровки бортов и углов ванны электролизера. При электролизе алюминия углеродные изделия работают в весьма жестких эксплуатационных условиях (высокая температура, агрессивная среда в виде расплавленных солей, механическое воздействие), поэтому они должны удовлетворять следующим требованиям: 1. выдерживать высокую температуру; 2. иметь хорошую электропроводность, малую пористость и достаточную механическую прочность; 3. обладать хорошей стойкостью против окисления кислородом воздуха и разъедания химическими веществами; 4. содержать минимальное количество примесей, ухудшающих качество получаемой продукции; 5. иметь правильную геометрическую форму; 6. быть достаточно дешевыми. Наиболее полно этим требованиям отвечают изделия из углеродистых материалов, при этом они выполняют несколько функций: являются и электродами и футеровочными материалами, служат средством подвода тока к среде и сами участвуют в происходящих в ней процессах. Подготовка твёрдых углеродистых материалов Различные твердые углеродистые материалы поступают на завод в обычных или саморазгружающихся железнодорожных вагонах. Их разгружают и хранят в закрытых складах раздельно, исключая их смешивание. От качества хранения и подготовки углеродистых материалов в значительной степени зависит качество получаемой продукции. Твердые материалы поступают на завод в кусках, их подготовка сводится к дроблению, прокаливанию и размолу. Куски дробят в щековых дробилках до 75 мм,тем самым обеспечивая должное качество прокаливания. Более крупные куски, пройдя через печь, не успеют прокалиться, а более мелкие увеличивают угар при прокаливании. Прокаливанию подвергают все углеродистые материалы (кроме графита) для их усадки и удаления летучих веществ до 0,2% в печах двух типов: ретортных без доступа воздуха или в ТВП. Ретортная печь состоит из вертикальных кирпичных камер (реторт), тепло от сжигания газов ≈ 1400 °С передается материалу через стенки реторт. Сырьё в них загружают сверху, время прокаливания 24—32 час. Достоинства ретортной печи: - использование в качестве горючего летучих веществ, выделяющихся из прокаливаемого материала; - получают равномерно прокаленный углеродистый материал; - малые потери материала за счет окисления, (угар 1—3 %), так как прокаливают без доступа воздуха. Недостатки ретортных печей: большие капитальные затраты на их сооружение и сложность эксплуатации. Вращающиеся трубчатые прокалочные печи длиной до 45 м и диаметром 2—3 мфутерованы огнеупорным материалом. Ось печи наклонена под углом 3 – 7 градусов к горизонту в сторону выхода материала из печи. Над печью установлен загрузочный бункер, из которого материал равномерно подается в печь. При вращении печи 2—3 об/мин, прокаливаемый материал медленно движется со скоростью 1 —1,2 м/минот загрузочного конца печи к разгрузочному, проходя зоны сушки, подогрева и прокаливания. Топливом служит мазут или природный газ, который подается в печь форсункой, установленной в разгрузочной головке печи. В отличие от ретортных печей, здесь горячие газы и пламя непосредственно соприкасаются с углеродистым материалом. Участок печи, где из углеродистого материала выделяются и сгорают летучие, называется зоной прокалки, температура здесь достигает 1200—1300 °С. По выходе из печи, материал выгружается в холодильный барабан, расположенный под печью и охлаждается до 60—75 °С пропускаемым через него воздухом, а также путем теплоотдачи через стенки барабана, который охлаждается снаружи водой. Вращающаяся трубчатая печь по сравнению с ретортными печами имеет следующие преимущества: 1) на содержание требуется меньше капитальных затрат; 2) проста в эксплуатации; 3) прост переход с одного вида материала на другой; 4) процесс прокаливания непрерывный, 5) возможна механизация и автоматизация процесса прокаливания. К недостаткам этих печей следует отнести повышенный угар углеродистых материалов (до 14%) и более низкую температуру прокаливания, чем в ретортных печах. Из углеродистых материалов полностью удаляется влага, резко снижается количество летучих веществ и повышается плотность за счет усадки (сокращения объема), что предотвращает деформацию и появление трещин в готовых электродных изделиях при их обжиге. Поэтому температура прокаливания углеродистых материалов всегда выше температуры обжига готовых изделий. После прокаливания у углеродистых материалов понижается реакционная способность к кислороду воздуха, повышается их электропроводность, теплопроводность и механическая прочность. Прокаленный материал поступает в размольное отделение. Измельчение необходимо для получения определенной крупности зерна (фракции), чтобы получать изделия с нужной пористостью и механической прочностью. Прокаленный материал измельчают в несколько приемов: - дробление на валковых или молотковых дробилках до 25—5 мм; - мелкий помол — от 20—5 мм до 10—0,5 мм - тонкий помол — 0,1 мм и мельче. Мелкий и тонкий помол осуществляют в шаровых мельницах. При этом углеродистый материал загрязняется железом вследствие износа дробилок, мельниц и шаров, поэтому железные частицы удаляют электромагнитом. После измельчения углеродистый материал рассеивают (классифицируют) на вибрационных грохотах по фракциям, которые поступают в сортовые бункера. Подготовка связующего Пек на завод поступает на склад пека в специальных железнодорожных вагонах-битумовозах с внешней паровой рубашкой. Пек в вагонах может находиться в жидком или твёрдом виде. Если пек в вагоне-бункере оказался застывшим, в паровую рубашку подводят перегретый пар и пек начинает плавиться. Вагон опрокидывают и жидкий пек сливают в обогреваемые паром стальные пекоплавители. Пек в пекоплавителях выдерживается 2-3 суток при 110 – 120 ºC. При этом из пека удаляется влага и усредняется его состав. Вода содержится в пеке в двух видах: в капельно-жидком и в тонкораспыленном. Капельно-жидкая вода легко отделяется при расплавлении пека, распыленная же выделяется только при нагревании его до 110 °С и вызывает сильное вспенивание пека. Дозировка и смешение шихты Сыпучие и связующие материалы взвешивают на весах или отмеряют по объему механическим или автоматическим способом. Эту операцию называют дозировкой. Цель дозировки — обеспечить определенный гранулометрический состав, такое соотношение между размерами зерен и связующим, при котором электродное изделие получилось бы с необходимой плотностью и механической прочностью. Этого достигают, смешивая крупные зерна с мелкими. Крупные зерна образуют основу электрода, придавая ему надлежащую прочность, а мелкие частицы и связующее служат заполнителем пустот между крупными. Подбор гранулометрического состава твердых материалов и количества связующего — весьма ответственная операция. Обычно на заводах сначала изготовляют опытные партии углеродистых изделий, а затем их проверяют на эксплуатационную стойкость в производственных условиях. В соответствии с гранулометрическим составом (рецептом) количество связующего различается. Избыток связующего особенно вреден в углеродной массе для формованных изделий, так как твердые частицы будут отделены друг от друга утолщенным слоем пека. При обжиге из-за усадки пека могут образовываться пустоты и трещины в изделии. Но повышенное содержание связующего в анодной массе необходимо - для лучшего размягчения, равномерного распределения и схватывания с предыдущей анодной массой в аноде. Твердые углеродистые материалы загружают в парообогреваемый смеситель и перемешивают 20-30 мин., пока они нагреются до 100—120 °С. Затем в смеситель подают расплавленный пек и перемешивают ещё 50—60 мин. Цель смешения сухой шихты со связующим — обеспечить полное соприкосновение зерен кокса со связующим и получить однородную массу с равномерным распределением в ней компонентов. Связующее должно покрыть тонкой пленкой каждую частицу твердого материала и заполнить пустоты между ними. На алюминиевых заводах такая «сырая» углеродистая масса является готовой продукцией — анодной, подштыревой или подовой массой. Её формуют в брикеты и после контроля качества отгружают на склад готовой продукции. Анодные материалы В современных алюминиевых электролизерах используются два вида анодных материалов: 1) самообжигающиеся аноды - формуются из анодной массы непосредственно в процессе электролиза; 2) предварительно обожжённые анодные блоки. Анодная масса выпускается в России в соответствии с ТУ 48-5-80-86 из пекового или нефтяного коксов. Масса из пекового кокса лучше по прочности, пористости, удельному электросопротивлению, чем из нефтяного кокса, но пековый кокс гораздо дороже. Анодная масса состоит из кокса (наполнителя) и пека (связующего). В зависимости от содержания связующего анодная масса может быть «жирной», «полусухой» и «сухой». В «сухой» анодной массе количество пека составляет 26 ± 1 %, что на 2% меньше, чем в «полусухой» и на 4-7%, чем в «жирной». Меньшее количество пека означает лучшее качество анода: - выделение полиароматических углеводородов и вредных выбросов в атмосферу сокращается на 80−90 %; - съём угольной пены сокращается на 15−20 кг/т Al; - падение напряжения в аноде уменьшается на 80 мВ; - меньший расход электроэнергии. В связи с высокими требованиями к охране окружающей среды и значительными экологическими штрафами алюминиевые заводы перешли на прогрессивную технологию производства сухой анодной массы. Содержание золы в анодной массе влияет на содержание примесей в алюминии, так как на производство 1 т алюминия расходуется ≈ 550 кг анодной массы. В свою очередь, зольность массы определяется качеством коксов, а также износом технологического оборудования и, прежде всего, футеровки прокалочных печей. Содержание серы в массе зависит
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 1044; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.63.87 (0.107 с.) |