
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обнаружение белков в гидролизатах кости и тканей зуба
Принцип метода При гидролизе белкового компонента кости, тканей зуба образуются фрагменты белков и свободные пептиды, вступающие в характерную биуретовую реакцию, когда пептидные связи в щелочной среде формируют с ионами меди комплексное соединение фиолетового цвета. Проведение анализа Для гомогенизации образцов твёрдых тканей и приготовления гидролизата измельчают поотдельности небольшой кусочек кости и небольшой кусочек зуба, затем в отдельных ступках тщательно растирают оба образца до гомогенного порошкообразного состояния. С помощью сухой воронки полученный порошок костной ткани переносят в 1-ю пробирку, порошок тканей зуба переносят во 2-ю пробирку. В каждую пробирку добавляют по 10 капель 10 % раствора NaOH, перемешивают, закрывают фольгой, помещают в кипящую водяную баню, нагревают до кипения и прогревают 1 мин. Белки при этом подвергаются щелочному гидролизу. Гидролизаты охлаждают под проточной водой и после охлаждения проводят качественную реакцию на белковый компонент: в пробирки к гидролизату костной ткани и к гидролизату тканей зуба добавляют по 1 капле раствора CuSO4. Появление фиолетового окрашивания, характерного для биуретовой реакции, указывает на наличеи белка в исходном субстрате. Оформление работы Фиксируют принципы методов, результаты реакций, сравнивают полученные данные с теоретическими предпосылками, делают заключение о наличии минеральных составляющих и белковых веществ в костной ткани и тканях зуба. Лабораторная работа 2. Актуальность Биологическое значение кальция очень разнообразно. Он участвует в формировании костей, зубов, хрящей, влияет на проницаемость биологических мембран, нервно-мышечную возбудимость и проводимость, участвует в сокращении и расслаблении сердца и скелетной мускулатуры, секреторных процессах, воздействует на обмен веществ, является посредником действия гормонов и важным фактором свёртывания крови. Концентрация кальция в плазме крови отражает его содержание в организме и состояние костной ткани. Гипокальциемия приводит к нарушению минерализации костей, поскольку в этом случае кальций начинает вымываться из депо, каковым для кальция в организме является скелет. Минерализованные ткани зуба также вовлекаются в этот процесс. Одновременно нарушается реминерализация эмали вследствие влияния концентрации кальция в плазме крови на содержание кальция в слюне.
Реактивы 1) 4 % раствор щавелевокислого аммония, 2) 2 % раствор аммиака, Материал для исследования 1) Сыворотка крови, 2) свежая моча. Титрометрический метод Принцип метода Метод основан на осаждении кальция из сыворотки крови в виде оксалата кальция. Оксалат кальция разлагается серной кислотой при нагревании с образованием щавелевой кислоты, которую оттитровывают перманганатом калия. Содержание кальция пропорционально количеству щавелевой кислоты. СаCl2 + (NH4)2C2O4 → CaC2O4 + 2NH4Cl CaC2O4 + H2SO4 → H2C2O4 + CaSO4 5H2C2O4 +2KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 8H2O +10CO2 Проведение анализа В центрифужную пробирку приливают 1 мл сыворотки крови и 1 мл дистиллированной воды (опыт), в другую центрифужную пробирку ‑ 2 мл дистиллированной воды (контроль). В обе пробирки добавляют по 0,5 мл раствора щавелевокислого аммония, слегка встряхивают и инкубируют при комнатной температуре 30 мин, после чего центрифугируют в течение 5 мин при 3000 об/мин и удаляют надосадочную жидкость. В опытной пробирке на дне остаётся белый осадок оксалата кальция. В обе пробирки наливают по 2 мл раствора аммиака для удаления избытка щавелевокислого аммония. Затем пробирки вновь центрифугируют в течение 5 мин и повторно удаляют надосадочную жидкость. В обе пробирки вносят по 1 мл раствора серной кислоты для растворения осадка, слегка размешивают стеклянной палочкой и помещают в нагретую водяную баню на 2 мин. Содержимое пробирок титруют раствором перманганата калия до появления слаборозовой окраски, не исчезающей в течение минуты. Расчёт Расчёт содержания кальция в пробе проводят по формуле: Ca = (А – Б) · 0,005 · 1000, где: Са ‑ концентрация кальция в сыворотке крови, ммоль/л, А ‑ объём раствора КМnО4, пошедший на титрование опытной пробы, мл;
Б ‑ объём раствора КМnО4, пошедший на титрование контроля, мл; 0,005 ‑ количество Са, соответствующее 1 мл 0,01 М КМnО4, моль; 1000 ‑ коэффициент для пересчёта на 1 л сыворотки крови. Колориметрический метод Принцип В кислой среде ионы кальция образуют с индикаторным реактивом арсеназо‑III комплекс малинового цвета. Интенсивность окраски пропорциональна концентрации кальция в пробе и определяется колориметрически. Проведение анализа Готовят три пробы согласно таблице:
Расчёт Содержание кальция в сыворотке крови рассчитывают по формуле:
где: СОП – концентрация кальция в сыворотке крови (ммоль/л), Содержание кальция в моче рассчитывают по формуле:
где: СОП ‑ концентрация кальция в моче (ммоль/сут), ССТ ‑ концентрация кальция в стандартном растворе, ЕОП ‑ экстинкция опытной пробы, ЕСТ ‑ экстинкция стандарта, Д ‑ диурез (1300‑1500 мл/сут). Нормальные величины
Практическое значение Содержание общего кальция в крови повышается при избытке паратгормона, гипервитаминозе D, идиопатической чувствительности к витамину D, деструкциии костей, злокачественных опухолях с поражением костной ткани и без такового, тиреотоксикозе, акромегалии, лейкозах, миеломной болезни, ацидозе. Гипокальциемия выявляется при гиповитаминозе D (недостаток всасывания, реабсорбции и резорбции кальция), нарушении всасывания, недостаточности паратгормона, остром панкреатите, гипотиреозе, хронической почечной недостаточности, прогрессирующей остеомаляции, сепсисе (выход через нарушенную систему микроциркуляции), алкоголизме, циррозе печени, гипоальбуминемии, остром алкалозе (усиление связывания кальция с белками). Кальцитонин снижает содержание кальция в крови, ограничивая резорбцию костной ткани. Содержание кальция в моче возрастает при метастазах рака или саркомы в кости и при состояниях организма, сопровождающихся гиперкальциемией. Снижение уровня кальция в моче отмечается во всех случаях снижения его содержания в сыворотке, при нефрозах, остром нефрите, дефиците витамина D. Оформление работы Указывают принцип метода, фиксируют результаты, делают расчёты, формулируют вывод о содержании Са в сыворотке крови и моче, наличии/отсутствии патологических отклонений, отмечают клинико-диагностическое значение. Лабораторная работа 3. Актуальность Обмен фосфора тесно связан с обменом кальция, что особенно важно для поддержания функционирования костной и зубных тканей. Для диагностики патологических состояний существенное значение имеет установление соотношения между содержанием кальция и неорганических фосфатов в крови (норме они соотносятся как 2: 1).
Уровень фосфатов в крови зависит от функции паращитовидных желёз, содержания соматотропина и вазопрессина, от регулирующего действия витамина D и функции почек. Для поддержания кальций-фосфорного обмена очень важен процесс выведения этих минералов из организма, осуществляемый преимущественно почками и имеющий неоднозначную гормональную регуляцию. Потеря фосфатов с мочой может превалировать над выведением кальция. Принцип метода Фосфорная кислота безбелкового фильтрата сыворотки крови (мочи) реагирует с ванадатом и молибдатом аммония с образованием фосфорнованадиево-молибденовой кислоты жёлтого цвета. Интенсивность окраски прямо пропорциональна концентрации неорганического фосфата в пробе и определяется фотометрически. Реактивы 1) 10% трихлоуксусная кислота, 2) рабочий раствор, содержащий 1 ммоль/л аммония молибдата и 1 ммоль/л аммония ванадата, 3) 2,5 ммоль/л стандартный раствор KH2PO4. Материал для исследования Сыворотка крови, моча (разведение 1: 5). Проведение анализа Сначала готовят безбелковый фильтрат сыворотки крови (мочи) в центрифужных пробирках, вторую часть работы проводят с надосадочной жидкостью (фильтратом) в химических пробирках
Расчёт Содержание фосфатов в сыворотке крови рассчитывают по формуле:
где: СОП – концентрация фосфатов в сыворотке крови (ммоль/л), Содержание фосфатов в моче рассчитывают по формуле:
где: СОП ‑ концентрация фосфатов в моче (ммоль/сут), ССТ ‑ концентрация фосфатов в стандартном растворе, ЕОП ‑ экстинкция опытной пробы, ЕСТ ‑ экстинкция стандарта, 5 ‑ разведение мочи, Д ‑ диурез (1300‑1500 мл/сут). Нормальные величины
Практическое значение Концентрация неорганических фосфатов в сыворотке крови и моче, прежде всего, зависит от функции паращитовидных и щитовидных желез, функции почек, регулирующего влияния кальцитриола.
Гиперфосфатемия наблюдается при почечной недостаточности, гипертиреозе, гипопаратиреоидизме, акромегалии, заживлении костных переломов, метастазах в кости, передозировке витамина D, остром дыхательном ацидозе, миеломной болезни. Гипофосфатемия отмечается при инфузии глюкозы и гиперинсулинизме (инсулин способствует транспорту фосфора в клетки), диабетическом кетоацидозе (глюкозурия повышает экскрецию фосфатов с мочой), гипокалиемии, гиперпаратиреозе, микседеме, рахите, остеомаляции, остром алкоголизме, синдроме мальабсорбции, пеллагре. Выделение фосфатов с мочой возрастает при ускорении катаболических процессов в организме – гипертиреоз, менингит, диабетический кетоацидоз, лейкоз, нарушение функции почек. Снижение концентрации в моче отмечается при туберкулезе, гипофункции паращитовидных желез. Оформление работы Указывают принцип метода, фиксируют результаты исследования, делают расчёты, отмечают диагностическое значение показателя и делают выводы о возможной патологии. Полученные на занятии результаты содержания кальция и фосфатов в биологических жидкостях оценивают, используя заполненную таблицу 2 (см. задания для контроля усвоения темы). Обсуждают роль гормональной регуляции (кальцитриол, паратирин, кальцитонин), синергизм и антагонизм действия гормонов в обмене Са и фосфатов, значение для здоровья костной и зубных тканей. Лабораторная работа 4. Щелочная фосфатаза (КФ 3.1.3.1) – фосфогидролаза моноэфиров фосфорной кислоты. У щелочной фосфатазы (ЩФ) различают 5 тканеспецифичных изоферментов: костный, кишечный, почечный, плацентарный, печеночный. Наиболее высокая активность фермента обнаружена в остеобластах, эпителии тонкого кишечника и канальцев почек, предстательной и молочной железах, плаценте, печени. Фракции ЩФ распределены в организме неравномерно, отличаются по каталитическим свойствам, подвижности при электрофорезе, устойчивости к тепловой инактивации. Изоформы ЩФ высвобождают неорганический фосфат из органических соединений (фосфоэтаноламин, пиридоксаль-фосфат, b‑глицерофосфат, пирофосфат и др.) путём гидролиза. R–O–PO32– + H2O Щелочная фосфатаза, выходя из клеток в плазму крови, образует комплексы с белками и липидами. Принцип метода Метод основан на способности щелочной фосфатазы гидролизовать фосфоэфирную связь в субстрате (пара‑нитрофенилфосфат) с освобождением пара‑нитрофенола, дающего в щёлочной среде жёлтое окрашивание, интенсивность которого пропорциональна активности фермента и определяется колориметрически после остановки ферментативной реакции ингибитором. Необходимые реактивы 1) Субстратно-буферный раствор для определения активности щелочной фосфатазы, рН 10,5 (готовят перед занятием), 2) раствор 4‑нитрофенилфосфата (раствор субстрата), 3) буферный раствор, 4) стандартный раствор пара‑ нитрофенола, 5) 0,02 N раствор NаОН, 6) раствор ингибитора.
Материалы для исследования Смешанная слюна, плазма крови.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 43; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.156.212 (0.031 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||
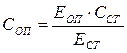 ,
, R–OH + HPO42–
R–OH + HPO42–


