Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диагностика рака прямой кишки
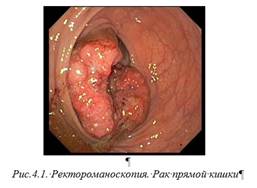
Диагностика РПК не представляет трудностей, эндоскопическое исследование - с биопсией (рис 4.1) опухоли обязательно для верификации диагноза, с целью изучения вышележащих отделов толстой кишки показана колоноскопия. Так как РПК относится к визуальным опухолям в 50-75% случаев достаточно ректального пальцевого исследования для установления диагноза. Исследование проводится в положениях на спине, на животе и при натуживании, оцениваются уровень и распространенность опухоли по стенке кишки, глубина инвазии, наличие изьязвления, подвижность. Женщинам одновременно выполняется вагинальное исследование. Пальцевое исследование предшествует ректороманоскопии. Эндоректальное УЗИ позволяет определить прорастание опухоли в смежные органы (влагалище, предстательную железу). КТ и УЗИ проводят для исключения метастазов. Ирригоскопия (контрастное исследование толстой кишки в условиях тугого заполнения бариевой взвесью) позволяет установить локализацию и протяженность опухоли, ее размеры, оценить состояние всей толстой кишки. При подозрении на острую кишечную непроходимость необходима обзорная рентгенография органов брюшной полости. Лапароскопия показана для исключения генерализации злокачественного процесса.
Ранняя диагностика и скрининг РПК Учитывая длительное бессимптомное течение РПК, выявление заболевания в ранних стадиях диктует необходимость активной диагностики (скрининга) опухолевого процесса на доклинической стадии. Американское общество по изучению рака рекомендует несколько возможных вариантов скрининга колоректального рака: ежегодный гемокульт- тест; колоноскопия (ректороманоскопия) каждые 5 лет; ежегодный гемокульт- тест + колоноскопия (ректороманоскопия) каждые 5 лет; ирригоскопия с двойным контрастированием каждые 5 лет; колоноскопия каждые 10 лет. При появлении малейших жалоб, которые указывают на патологию прямой кишки, необходимо полное обследование, включающее пальцевое ректальное исследование, ректороманоскопию и колоноскопию. Ввиду отсутствия патогномоничных симптомов РПК его скрининг может быть основан на гемокульт-тесте, который следует проводить, согласно рекомендациям Европейского комитета по борьбе с раком, ежегодно дважды всем лицам в возрасте 50-74 лет, не имеющим «кишечных жалоб». Положительный тест является показанием к обязательной ректороманоскопии.
Анализ показал, что применение гемокульт-теста привело к снижению смертности от рака толстой кишки на 14-18% за счет раннего выявления заболевания. Для больных с предопухолевой патологией обязательными должны быть регулярные эндоскопические (ректороманоскопия) исследования не реже 2 раз в год. При подозрении на генетически детерминированную предопухолевую патологию показано генетическое тестирование с последующим активным диспансерным наблюдением. ЛЕЧЕНИЕ РАКА ПРЯМОЙ КИШКИ В 350 г. до нашей эры описано формирование Праксагорасом противоестественного заднего прохода. В последующем в разные годы разрабатывались различные варианты колостом. Первые операции при раке прямой кишки выполнялись в основном из промежностного доступа с удалением копчика или крестца. В 1896-1908 гг. Кеню и Майлсом был внедрен в практику метод комбинированного брюшно-промежностного доступа. Следует отметить, что тенденция к увеличению количества сфинктеросохраняющих операций, на протяжении вот уже почти двух столетий остается постоянной. Это связано с мнением о том, что при опухолях, нижний полюс которых располагается ближе 6-8 см от ануса, необходимо выполнять брюшно-промежностную экстирпацию прямой кишки из соображений радикальности. В результате многолетних исследований в ДОПЦ была доказана возможность выполнения радикальных операций с сохранением анального сфинктера, обеспечивающих радикализм и сохранение запирательной функции (Г.В.Бондарь). Разработанные методики в сочетании с комбинированной химиолучевой терапией обеспечивают хорошие отдаленные результаты лечения, сохранение естественного механизма дефекации, высокого качества жизни и восстановления трудоспособности. В результате, удалось практически отказаться от колостомии даже при нижнеампулярном раке. В США и многих других странах, при лечении РПК, на сегодняшний день приняты следующие положения. При расположении опухоли в дистальной части прямой кишки и на расстоянии менее 7 см от заднего прохода в любой стадии заболевания (вне зависимости от анатомического типа и гистологического строения опухоли) выполняется брюшно-промежностная экстирпация прямой кишки с формированием колостомы (операция Майлса).
Сфинктеросохраняющие операции можно выполнить при локализации нижнего края опухоли на расстоянии более 7 см от заднего прохода. Брюшно-анальная резекция прямой кишки с низведением дистальных отделов ободочной кишки возможна при опухоли, расположенной на расстонии 7-12 см от заднего прохода. Передняя резекция прямой кишки производится при опухолях верхнеампулярного и ректосигмоидного отделов, нижний полюс которых располагается на расстоянии 10-12 см от заднего прохода. При малигнизированных полипах и ворсинчатых опухолях прямой кишки выполняют экономные операции: трансанальное иссечение или электрокоагуляцию опухоли через ректоскоп, иссечение стенки кишки с опухолью с помощью колотомии. Проблема обеспечения качества жизни и восстановление трудоспособности больных после радикального лечения остается одной из наиболее важных и актуальных проблем современной колопроктологии. Это, прежде всего, касается вопросов разработки и применения одномоментных первично-восстановительных и сфинктеросохраняющих операций, а также создания искусственных аналогов замыкательного аппарата прямой кишки. Традиционно сфинктеросохраняющие операции выполнялись при опухолях прямой кишки, нижний край которых расположен не ниже чем на 5-6 см от переходной складки анального канала, в остальных случаях, с точки зрения обеспечения радикализма, считалась необходимой экстирпация прямой кишки с удалением замыкательного аппарата и формированием колостомы. Экстирпация прямой кишки, по мнению большинства исследователей, является инвалидизирующей операцией, так как колостома с применением даже самого современного калоприемника значительно ухудшает качество жизни больного, ограничивая его активность и трудоспособность. Многочисленные исследования показали, что низкая сфинктеросохраняющая резекция прямой кишки с мезоректумэктомией позволяет обеспечить радикализм вмешательства. Проблема надежности анастомоза с помощью внедрения современных методик механического шва породило новую проблему, связанную с функциональной неэффективностью механических анастомозов. В мировой литературе появился новый термин - «синдром низкой передней резекции», обозначающий характерный для подобных анастомозов симптомокомплекс: частые акты дефекации; многомоментное и неполное опорожнение кишечника; императивные позывы на дефекацию; проявления анальной инконтиненции различной степени. Один из путей решения этой проблемы предложен F.Lazorthes и P.Parc, разработавшими, независимо друг от друга, в 1986 г. методику формирования тазового толстокишечного резервуара. По данным литературы, 5-летняя выживаемость после чисто хирургического лечения РПК составляет: I стадия - 85- 90%; II стадия - 70-75%; III стадия - 35-40%; IV стадия - менее 5%. При этом частота развития локорегионарных рецидивов достигает, соответственно: при I стадии - 5-15%; II стадии - 20-30%; III стадии - 20-50%. Приведенные данные убедительно иллюстрируют необходимость проведения дополнительных методов противоопухолевой терапии, направленных на предотвращение развития рецидивов рака после хирургического лечения.
Химиотерапия РПК Основным методом комбинированной терапии в настоящее время является адъювантная химиотерапия, при которой химиотерапия предназначена для воздействия на субклинические отдаленные метастазы. Установлено преимущество адьювантной химиотерапии в развитии локорегиональных рецидивов, токсичности и сердечно-сосудистых осложнений ПХТ. Показано, что капецитабин (кселода) с успехом может заменить 5-фторурацил. Оксалиплатин может быть включен в схемы нео- и адьювантной ПХТ. ПХТ с 5-фторурацилом и лейковорином («схема клиники Мейо») является на сегодняшний день самой распространенной и, по существу, стандартной схемой лечения РПК во всем мире. Современной ее альтернативой может считаться применение в том же сочетании препаратов для перорального приема (кселода). В лечении неоперабильного РПК применяются те же препараты, что и при лечении РОК. Оптимизм внушает также появление новых более эффективных химиопрепаратов (кселода, кампто, элоксатин, томудекс), однако высокая стоимость лечения служит серьезным препятствием их широкого применения.
Лучевая терапия РПК Цель пред- и послеоперационного облучения заключаются в профилактике и лечении локорегионарных рецидивов и отдаленных метастазов. Предоперационная лучевая терапия показана в качестве первого этапа комплексного лечения при раке нижне - и среднеампулярного отдела прямой кишки: РОД - 5 Гр, СОД - 25 Гр или РОД - 2 Гр, СОД - 40 Гр. Послеоперационная лучевая терапия показана в качестве второго этапа комбинированного и комплексного лечения при раке средне - и нижнеампулярного отделов прямой кишки: РОД - 2 Гр, СОД - 46-50 Гр. Лучевая терапия по радикальной программе в самостоятельном плане используется при противопоказаниях к хирургическому лечению, отказе больного от операции, функциональной неоперабельности пациента: РОД - 2 Гр, СОД - 60-70 Гр (в два этапа). Паллиативная лучевая терапия проводится на солитарные метастатические очаги в печени, костях, головном мозге, легких. В качестве радиомодифицирующих агентов, повышающих эффективность лучевой терапии, могут быть использованы химиопрепараты (5-ФУ, цисплатин, капецитабин). Послеоперационная лучевая терапия показана в качестве второго этапа комбинированного и комплексного лечения при раке нижнеампулярного отдела прямой кишки. По данным литературы, 5-летняя выживаемость после чисто хирургического лечения РПК составляет при различных стадиях: I стадия - 85- 90%; II стадия -70 -75%; III стадия - 35-40%; IV стадия - менее 5%. При этом частота развития локорегионарных рецидивов достигает, соответственно: при I стадии - 5-15%; II стадии - 20-30%; III стадии - 20-50%. Приведенные данные убедительно иллюстрируют необходимость проведения дополнительных методов противоопухолевой терапии, направленных на предотвращение развития рецидивов рака после хирургического лечения.
|
|||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 41; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.150.163 (0.013 с.) |