
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обработка результатов измерений
1. Для каждого опыта найдите D 2. Для каждого измеренного DР по формуле (8) вычислите N теор, затем Nтеор2. Расчетные данные занесите в таблицу 1. 3. Постройте графики функций Nэкс2 = j (DP) и N2теор = j (DP) на одном листе и в одном масштабе. Проанализируйте полученные графики.
КОНТРОЛЬНЫЕ ВОПРОСЫ ДЛЯ ДОПУСКА К РАБОТЕ
1. Какие измерения необходимо выполнить в работе? Расскажите порядок выполнения работы. 2. Как в работе определяется разность давлений DP? 3. На какую величину должна отличаться величина D 4. Чем отличается реальная жидкость от идеальной? 5. Какими уравнениями описывается стационарное течение жидкости?
КОНТРОЛЬНЫЕ ВОПРОСЫ ДЛЯ СДАЧИ РАБОТЫ 1. Выведите уравнение неразрывности струи. Каков его физический смысл? 2. Какая жидкость называется идеальной? 3. Какое течение называется стационарным? 4. Что такое линии тока, трубка тока, струя? 5. Выведите уравнение Бернулли. Каков его физический смысл?
7. Запишите формулы статического и динамического давлений.
ЛАБОРАТОРНАЯ РАБОТА № 1 - 11 ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ ДЛЯ ВОЗДУХА Цель работы: определить отношение теплоемкости воздуха при постоянном давлении к теплоемкости воздуха при постоянном объёме. Изучить термодинамические процессы в газах.
ВВЕДЕНИЕ Теплоемкостью тела СТ называется величина, равная количеству теплоты Обозначение Удельной теплоемкостью вещества Суд называется величина, равная количеству теплоты Молярной теплоемкостью вещества Смол называется величина, равная количеству теплоты
Величины Суд и Смол являются характеристиками вещества и зависят от процесса, в котором веществу сообщается теплота Если нагревать вещество при постоянном объёме, то все количество теплоты, сообщаемое веществу, полностью идет на увеличение его внутренней энергии. Если нагревать вещество при постоянном давлении, то количество теплоты, сообщаемое веществу, идет на увеличение его внутренней энергии и на работу изобарического расширения, поэтому СР больше, чем С V. Молярные теплоемкости СР мол и С V мол связаны между собой уравнением: С Р мол - С V мол = R, (4) где R – универсальная газовая постоянная. Уравнение (4) называется уравнением Майера. Физический смысл величины R – она равна работе, требуемой для увеличения объёма 1 моль газа при изменении его температуры на 1 К при постоянном давлении. При постоянном объёме: то, сопоставляя (3) и (5), получим: здесь Существует две формы передачи энергии от одних тел к другим: теплота и работа. Опыт показывает, что, в соответствии с законом сохранения энергии, при любом способе перехода системы из первого состояния во второе изменение внутренней энергии
Уравнение (8) выражает первый закон термодинамики: количество теплоты, сообщаемое системе, идет на изменение её внутренней энергии и на совершение системой работы против внешних сил. Среди различных термодинамических процессов чаще рассматриваются следующие: 1 - изохорный:
|
||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 48; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.219.65 (0.007 с.) |
 =
=  . Зная V и t, найдите
. Зная V и t, найдите 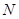 по формуле:
по формуле: 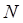 экс = V/t, а затем
экс = V/t, а затем 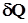 , необходимому для нагревания вещества на 1 К:
, необходимому для нагревания вещества на 1 К: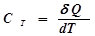 . (1)
. (1)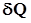 говорит о том, что теплота есть функция процесса.
говорит о том, что теплота есть функция процесса. , необходимому для нагревания 1 кг вещества на 1 К:
, необходимому для нагревания 1 кг вещества на 1 К: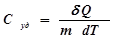 . (2)
. (2)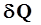 , необходимому для нагревания 1 моль вещества на 1 К:
, необходимому для нагревания 1 моль вещества на 1 К: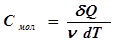 . (3)
. (3)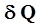 . Различают теплоемкости при постоянном объёме (С V) и постоянном давлении (С Р), если в процессе нагревания вещества его объём или давление поддерживаются постоянными.
. Различают теплоемкости при постоянном объёме (С V) и постоянном давлении (С Р), если в процессе нагревания вещества его объём или давление поддерживаются постоянными.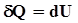 , здесь
, здесь 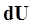 - изменение внутренней энергии. Такое обозначение говорит о том, что внутренняя энергия есть функция процесса. Поскольку изменение внутренней энергии равно:
- изменение внутренней энергии. Такое обозначение говорит о том, что внутренняя энергия есть функция процесса. Поскольку изменение внутренней энергии равно: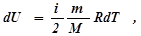 (5)
(5)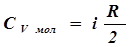 , (6)
, (6)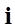 - число степеней свободы. С учетом (4) имеем:
- число степеней свободы. С учетом (4) имеем: . (7)
. (7)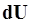 будет одинаковым и равным разности между количеством теплоты
будет одинаковым и равным разности между количеством теплоты  , полученным системой и работой
, полученным системой и работой 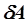 , совершаемой системой против внешних сил. Отсюда следует, что:
, совершаемой системой против внешних сил. Отсюда следует, что: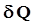 =
= 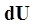 +
+  . (8)
. (8)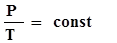 -закон Шарля. 2 - изобарный:
-закон Шарля. 2 - изобарный: 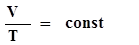 - закон Гей-Люссака. 3 - изотермический:
- закон Гей-Люссака. 3 - изотермический: 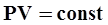 - закон Бойля-Мариотта. 4 - адиабатный:
- закон Бойля-Мариотта. 4 - адиабатный:  - закон Пуассона, здесь g - показатель адиабаты, равный отношению теплоемкостей:
- закон Пуассона, здесь g - показатель адиабаты, равный отношению теплоемкостей: 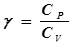 . (9)
. (9)


