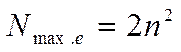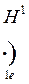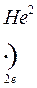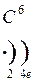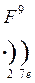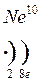Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
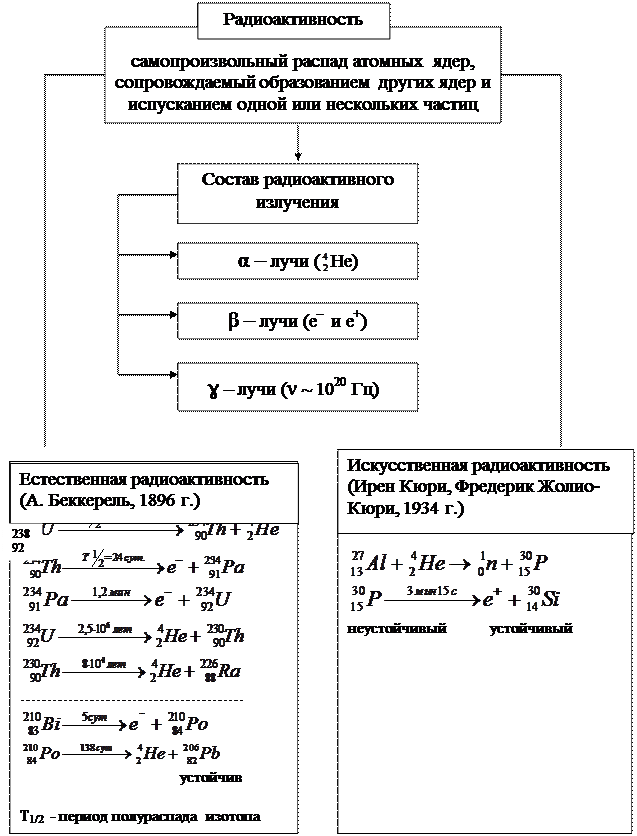
Естественная и искусственная радиоактивность
Периоды полураспада некоторых радиоактивных изотопов
Ядерные процессы
Формы записи ядерных реакций
Структура атома
атом Модели атомов
Электронная конфигурация атомов
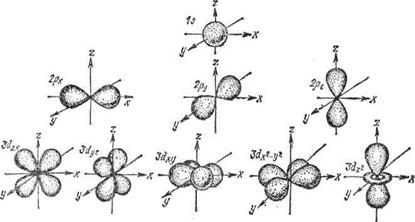
Формы и расположения атомных орбиталей Последовательность заполнения электронных уровней (подуровней) в атоме
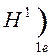 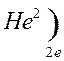
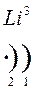 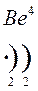 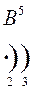 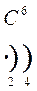 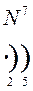 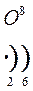 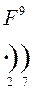 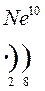
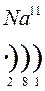 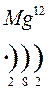 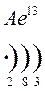 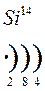 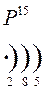 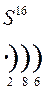 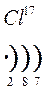 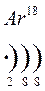
Количество энергетических уровней в атоме численно равно номеру периода, в котором находится атом в ПСЭ.
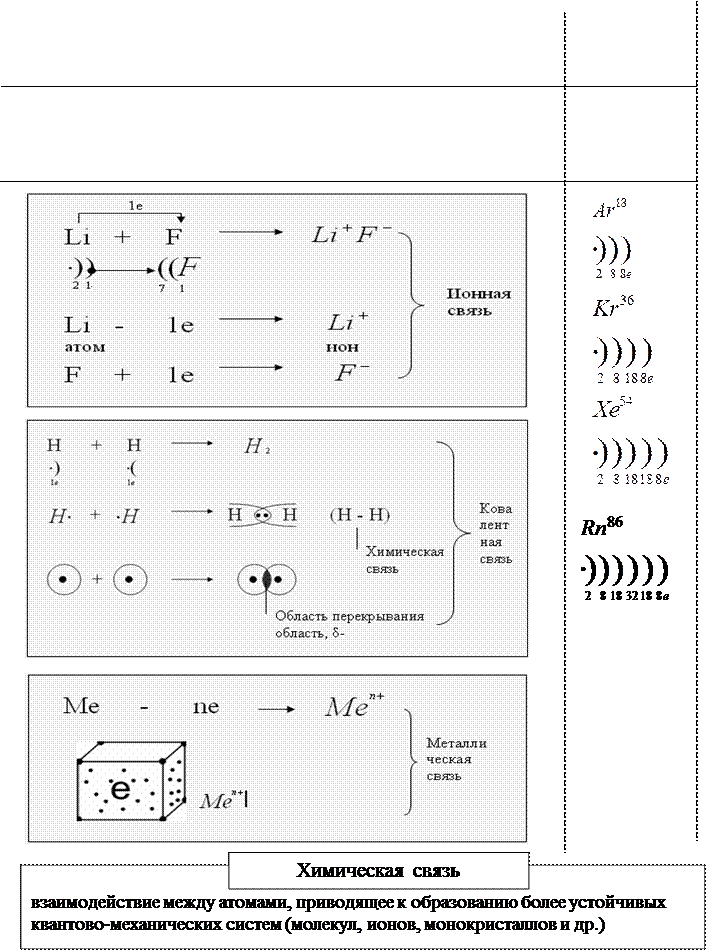
Химическая связь и ее типы
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 188; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.161.132 (0.017 с.) |
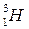
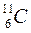
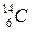
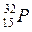
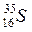
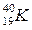
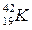
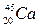
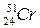

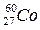
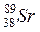
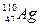
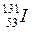
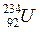
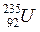
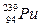


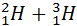 ®
® 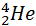 +
+ 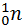 (T = 5∙107 K)
При синтезе 1г Не выделяется 4,2∙1011 Дж энергии, что соответствует сжиганию 10 т дизельного топлива
(T = 5∙107 K)
При синтезе 1г Не выделяется 4,2∙1011 Дж энергии, что соответствует сжиганию 10 т дизельного топлива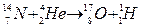

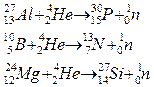
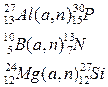
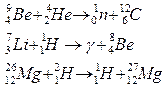
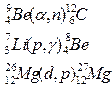
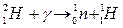
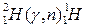
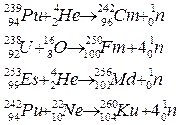
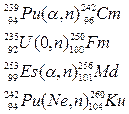
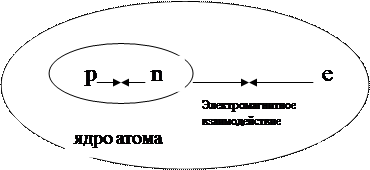
 Be4
Be4
 Z=4
(4p,4e)
Z=4
(4p,4e)

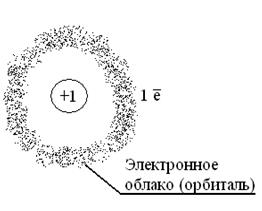 Be4
Be4
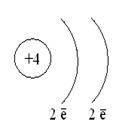
 ↑ ↓ - электроны с противоположными спинами s
s = +1/2 s = -1/2
СХЕМЫ ОРБИТАЛЕЙ
↑ ↓ - электроны с противоположными спинами s
s = +1/2 s = -1/2
СХЕМЫ ОРБИТАЛЕЙ