Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение равновесной концентрации железо-салицилового комплекса
Для определения константы равновесия (К с) образовавшегося при реакции железо-салицилового комплекса готовят серию растворов салициловой кислоты в смеси с FeCl3 в растворе HCl. Концентрации основных растворов указаны в таблице 3.2. Для смешения отбирают по 2,5 мл каждого раствора. Пипетки и кюветы перед приготовлением новой смеси необходимо тщательно промыть исследуемым раствором. Через 10 минут после приготовления исследуемых растворов приступают к фотометрированию. Измеряют оптическую плотность исследуемых растворов при длине волны λ = 480 нм. По уравнению градуировочного графика A = f (C) или графически определяют равновесную концентрацию образовавшегося при реакции железо-салицилового комплекса (С х). Результаты расчетов заносят в графу 5 таблицы 3.2.
Таблица 3.2 –Данные для определения К с
Обработка экспериментальных данных Равновесные концентрации ионов Fe3+ и салициловой кислоты в каждой реакционной смеси определяют по разности исходной и равновесной концентраций: (С Fe3+/2 – C x) и (C салиц.к-ты/2 – С х).
Равновесную концентрацию ионов водорода принимают с учетом разбавления исходного раствора HCl. Числом ионов Н+, образующихся при диссоциации салициловой кислоты можно пренебречь, так как константа диссоциации салициловой кислоты малая величина. Подставляя значения равновесных концентраций С х (из табл. 3.2) в формулу рассчитывают константы равновесия для реакционной смеси с разной начальной концентрацией компонентов. По известным значения К с, К 1, К 2 и уравнению 3.10 вычисляют константу образования комплекса (К с3), константу нестойкости железо-салицилового комплекса (К н). Для вычисления стандартного изобарно-изотермического потенциала (энергииГиббса) используют выражение:
D G о Т = – RT ln K с. (3.16)
По результатам работы сделайте выводы: – о выполнении закона Бугера-Ламберта-Бера; – о возможном направлении самопроизвольного протекания реакции комплексообразования; – об устойчивости образующегося комплекса железа с салициловой кислотой.
Таблица 3.3 – Характеристики реакции образования комплекса
Контрольные вопросы 1. Понятие о химическом равновесии. 2. Запишите выражение константы равновесия в общем виде. 3. Какие факторы влияют на константу равновесия? 4. С какой целью определяют константу равновесия химической реакции? 5. Запишите выражение закона Бугера-Ламберта-Бера. 6. Как определяют концентрацию раствора методом спектрофотометрии? 7. Напишите уравнение изотермы химической реакции. 8. Как устанавливают возможность и направление самопроизвольного протекания химической реакции?
Фазовые равновесия в многокомпонентных жидких системах
Гетерогенные жидкие системы Гетерогенными фазовыми равновесиями называются равновесия, устанавливающиеся в процессах перехода веществ из одной фазы (простой или смешанной) в другие фазы (простые или смешанные). Такие равновесия наблюдаются при кипении жидкости под постоянным давлением (жидкость «пар), плавлении кристаллов (твердое «жидкость), выделении жидкой фазы из раствора жидких компонентов при изменении температуры (жидкость «жидкость) и т.п. Гетерогенные фазовые равновесия устанавливаются в гетерогенных системах. Гетерогенной называется система, состоящая из одного или более компонентов, входящих в состав минимум двух фаз, отделенных друг от друга поверхностью раздела. Фаза – это гомогенная часть гетерогенной системы, обладающая одинаковыми физико-химическими свойствами и отделенная от остальных частей системы поверхностью раздела. В пределах одной фазы термодинамические параметры могут изменяться монотонно, при переходе через межфазную границу происходит скачкообразное изменение параметров системы.
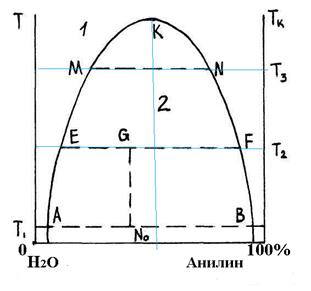
В учении о фазовых равновесиях компонентами называют химически однородные вещества, являющиеся независимыми составляющими системы. для систем, в которых происходят химические реакции, число компонентов равно числу составляющих веществ минус число реакций между ними. Для систем, в которых не происходит химической реакции, число компонентов равно числу составляющих веществ. В зависимости от своей природы жидкости смешиваются друг с другом в разных соотношениях – от практической нерастворимости в любых условиях до неограниченной взаимной растворимости. Вещества, состоящие из молекул одинаковой или близкой полярности, смешиваются неограниченно, т.е. образуют гомогенные системы, а из молекул различной полярности, вообще не смешиваются, т.е. образуют гетерогенные системы. Характерной особенностью многокомпонентных жидких систем с ограниченной растворимостью является изменение взаимной растворимости с изменением температуры. При этом часто ограниченная растворимость переходит в неограниченную. Этот переход у одних систем наблюдается при повышении температуры, а у других – при понижении. Ограниченная растворимость наблюдается в том случае, когда переход молекул из одной фазы в другую связан с совершением работы, намного превышающей среднюю энергию движения молекул жидкости при данных условиях. Чем больше будет работа перехода, тем меньше будет доля молекул, способных совершать этот переход, и тем меньше будет растворимость одной жидкости в другой. Если жидкости не взаимодействуют друг с другом, повышение температуры увеличивает долю молекул с повышенным запасом энергии движения, и такие молекулы способны осуществить работу перехода, а, следовательно, взаимная растворимость их будет увеличиваться. При некоторой температуре может наступить полное смешение жидкости, т.е. произойдет переход от гетерогенной системы к гомогенной. Максимальная температура, при которой ограниченно-смешивающиеся жидкости неограниченно взаимно растворяются, называется верхней критической температурой растворения (ВКТР) или смешения (ВКТС). В случае, когда ограниченно растворимые жидкости образуют друг с другом молекулярные соединения (ассоциаты), повышение температуры уменьшает их взаимную растворимость. Если при смешении ограниченно-смешивающихся жидкостей, взаимная растворимость наблюдается при минимальной температуре, то такая температура называется нижней критической температурой растворения (НКТР). Существуют также системы, имеющие и верхнюю и нижнюю температуры растворимости. Температура, при которой происходит фазовый переход (гетерогенная система – гомогенная система) зависит от состава смеси жидкостей с ограниченной растворимостью. Основным методом исследования фазовых равновесий является метод построения фазовых диаграмм. Фазовая диаграмма – это графическая зависимость состав – свойство, которая позволяет определить области сосуществования фаз. Любая точка на плоскости диаграммы называется фигуративной точкой и отражает состояние и условия существования равновесной системы. Диаграмма состояния или фазовая диаграмма двухкомпонентной системы жидкостей с ограниченной растворимостью в координатах состав – температура называется диаграммой растворимости. На рисунке 4.1 приведена диаграмма растворимости системы с ограниченной растворимостью: вода – анилин. Кривая расслоения АКВ, которая называется бинодаль, разделяет области существования гомогенной и гетерогенной систем. Область выше бинодали соответствует гомогенной системе, область под бинодалью – гетерогенной системе, состоящей из двух фаз.
Точки на бинодали характеризуют составы равновесных слоев (фаз). Например, при температуре Т 1 точка А соответствует составу насыщенного раствора анилина в воде (одна фаза), точка В – составу насыщенного раствора воды в анилине (вторая фаза). При смешении двух компонентов в интервале концентраций от т. А до т. В при данной температуре состав каждой фазы остается постоянным. С увеличением температуры до Т 2 растворимость компонентов увеличивается и состав фаз изменяется. Состав растворов, образующих сосуществующие фазы, определяется точками пересечения соответствующей изотермы с бинодалью (точки Е и F при Т 2; точки M и N при Т 3). При температуре Т К две точки совпадают в одну точку К. Т К – верхняя критическая температура растворения. Выше этой температуры анилин и вода неограниченно взаимно растворяются.
Рисунок 4.1 – Диаграмма растворимости системы вода–анилин Для определения ВКТР используют правило Алексеева. Для этого при различных произвольно выбранных температурах (например, Т 2 и Т 3) проводят изотермы, отрезки которых в пределах бинодали называются ноды (MN и EF). Ноды делят пополам и через их середины проводят прямую линию. Точке пересечения прямой с бинодалью (т.K) соответствует верхняя критическая температура растворения (ВКТР). По диаграмме (рисунок 4.1) можно определить состав системы и весовые соотношения соответствующих фаз. Например, точка G в гетерогенной области отвечает общему составу N о, температуре Т 2 и состоит из двух фаз: анилин в воде и вода в анилине. Состав каждой фазы определяется пересечением изотермы ЕF с кривой расслоения. Состав фазы – анилин в воде соответствует точке Е, а фазы – вода в анилине – точке F. Кроме того, по месторасположению точки G на изотерме можно определить, сколько каждой из двух фаз находится в равновесии при условии, что известен общий вес системы. Относительное количество фаз можно вычислить по правилу рычага: массы сосуществующих фаз обратно пропорциональны отрезкам, на которые фигуративная точка системы (G) делит ноду (ЕF). Количеству (массе) фазы – анилин в воде отвечает отрезок GF, фазы – вода в анилине – отрезок GE.
Фазовое равновесие и возможность фазового перехода зависят от действия внешних факторов. При изменении внешних параметров (давление или температура) равновесие в системе нарушается. Изменения в системе происходят до наступления нового равновесия. Для характеристики фазового состояния системы используют понятие о числе степеней свободы. Число степеней свободыС (вариантность) – это число параметров, которые можно произвольно менять, не изменяя при этом числа и вида фаз в системе. Число степеней свободы определяют, применяя правило фаз Гиббса: С = К – Ф + п, (4.1) где К – число компонентов системы; Ф – число фаз; п – число внешних условий, которые определяют число фаз системы. Для газообразных систем п = 2, т.к. влияние на состояние равновесия могут оказать, давление и температура. Следовательно, С = К – Ф + 2. Для конденсированных систем (жидкость, твердые тела) давление исключается из числа внешних факторов, поэтому п = 1 и С = К – Ф + 1. Например, в точке 1 на рисунке 4.1, лежащей в гомогенной области, число компонентов равно 2, число фаз – 1. Следовательно, число степеней свободы С = К – Ф + 1 =2 – 1 + 1 = 2. Это означает, что изменение двух внешних параметров (состав и температура) в определенных пределах, не изменит числа и вид фаз.
Лабораторная работа № 4.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 251; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.175.182 (0.019 с.) |
|||||||||||||||||||||||||||||||||||||
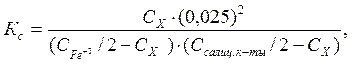 (3.15)
(3.15)