
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесие в системах пар – жидкостьСтр 1 из 4Следующая ⇒
Равновесие в системах пар – жидкость Рассмотрим бинарные смеси, не взаимодействующие химически друг с другом. По правилу фаз, число степеней свободы равно: С= К-Ф+2= 2-2+2=2 Из трех независимых параметров, определяющих состояние системы (t,p,c) только две можно выбрать произвольно, при этом определяется значение третьего параметра. Поэтому для характеристики бинарных систем пользуются фазовыми диаграммами, содержащими равновесные зависимости: · Давление пара от состава жидкости: P-X (t= const); · Температура кипения и конденсации от состава жидкости и пара: T-X-Y (P=const); · Состава пара от состава жидкости: Y-X (P=const). Вид этих зависимостей, характеризующих поведение жидкой смеси, зависит, в основном, от природы веществ, их взаимной растворимости. Различают следующие смеси жидкостей: 1. С неограниченной взаимной растворимостью 2. Взаимно нерастворимые 3. Ограниченно растворимые Смеси с неограниченной взаимной растворимостью (бинарные системы) Эти смеси делятся на идеальные и реальные. Идеальные растворы характеризуются тем, что все частицы в растворе ведут себя одинаково. Для них справедливо соотношение: Закон Рауля: Равновесная упругость компонента над раствором равна упругости насыщенного пара чистого компоненте, умноженной на его мольную долю в жидкости:
где:
По закону Дальтона общее давление есть сумма парциальных давлений компонентов: П = При постоянной температуре Фазовая диаграмма Р-х
Построим фазовую диаграмму t-x-y. Очевидно, что при равновесии равновесная упругость пара над раствором равна нормальному давлению его в паре. Поэтому можно записать (по закону Дальтона):
где: отсюда:
(1- Диаграмма строится: X= При P=const, зная температуру, находят
Нижняя ветвь отвечает температурам кипения жидкой смеси, а верхняя - температурам конденсации паровой фазы, при заданном давлении Р.
Для расчетов процесса ректификации чаще всего применяется фазовые диаграммы Y-X, где: Y – мольная доля НКК в паре, Х – мольная доля НКК в жидкости. Диаграмма Y-X строится обычно при П =const.
где: α = α – называется относительной летучестью (при Р = const). Таким образом, равновесная зависимость
Положение равновесных линий обобщается законом Коновалова: Пар обогащается тем компонентом, при добавлении которого к жидкости повышается давление пара над ней или снижается её температура кипения. Таким образом, пар обогащается НКК, концентрация НКК в паре всегда при ректификации больше, чем в жидкости, а область, соответствующая ректификации, выше диагонали. Реальные смеси. Реальные жидкие смеси с полной взаимной растворимостью не следуют закону Рауля. Значительные отклонения наблюдаются при высоких температурах и давлениях. В этих случаях вместо давления насыщенного пара По сравнению с равновесной упругостью над идеальными растворами упругость пара над реальными растворами может быть больше -> положительное отклонение от закона Рауля, меньше -> отрицательное отклонение от закона Рауля. Примеры растворов с положительным отклонением: Азот-кислород, вода-метиловый спирт, CCl4-бензол, бензол-ацетон, ацетон-этиловый спирт, вода-этиловый спирт (95,57%) С отрицательным отклонением: Вода-азотная кислота 68% вес HNO3 – азеотропная смесь), вода-хлористый водород (20% HCl – азеотроп), хлороформ-ацетон, хлороформ-бензол. Для смеси с положительным отклонением:
При положительных отклонениях разнородные молекулы взаимно притягиваются с меньшей силой, чем однородные, что облегчает переход молекул в паровую фазу (по сравнению с чистыми жидкостями).
С отрицательным отклонением:
При отрицательных отклонениях разнородные молекулы притягиваются сильнее (химические соединения, сольватация, водородные связи), что затрудняет переход молекул в паровую фазу.
Для ряда смесей большие количественные отклонения от закона Рауля приводят к качественно новым свойствам смесей. При некотором составе кривая общего давления проходит через максимум или минимум. В этих точках составы паровой и жидкой фаз одинаковы (второй закон Коновалова), т.е. обогащения паровой фазы НКК не происходит. Такие растворы называются азеотропными (нераздельнокипящими). Состав их при перегонке не меняется, и они кипят при постоянной температуре.
X
x, y x, y
М – азеотропная точка Ректификация возможна для смесей: Ректификация возможна для смесей: от х = 0 до х = М от х = М до х = 1
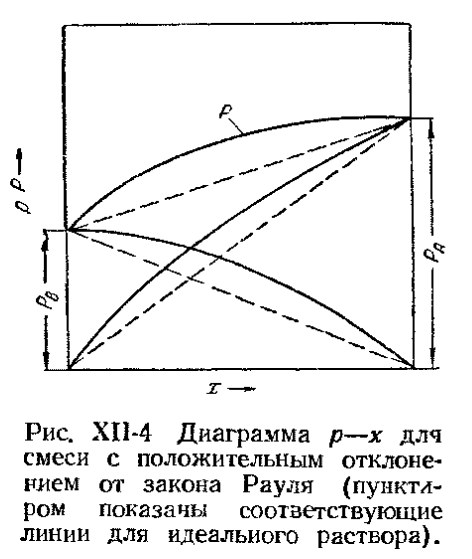
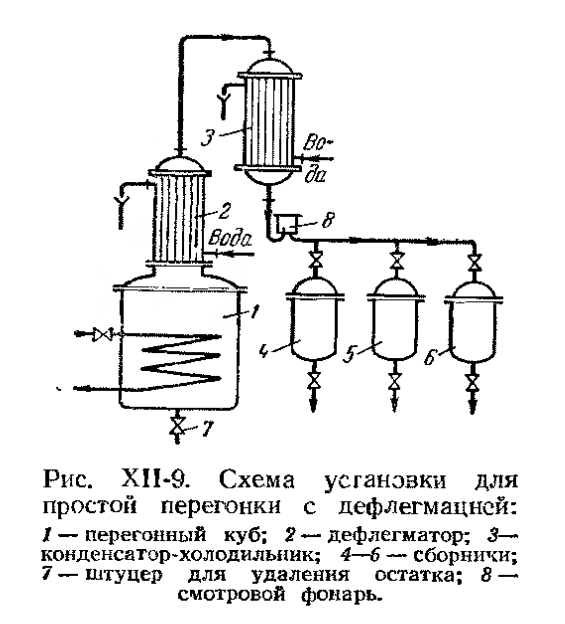
Состав азеотропных смесей зависит от температуры (давления): эта зависимость характеризуется вторым законом Вревского: При повышении температуры азеотропной смеси, обладающей максимумом давления пара, в смеси увеличивается относительное содержание того компонента, парциальная мольная теплота испарения которого больше, а для смеси с минимумом давления пара – содержание компонента, парциальная мольная теплота испарения которого меньше. Этот закон указывает на принципиальную возможность разделения азеотропных смесей путем изменения давления при перегонке. Кроме того, разделение возможно также с помощью специальных видов ректификации, которые будут рассмотрены нами позже. Перегонка · Простая перегонка Простая перегонка (или фракционная) производится периодически, путем постепенного испарения жидкости, находящейся в перегонном кубе. Образовавшиеся пары отводятся и конденсируются, при этом получается несколько фракций дистиллята.
Простая перегонка может производиться при атмосферном давлении и под вакуумом. При этом неконденсирующиеся газы отсасываются из приёмников вакуум-насосом. Под вакуумом разгоняют чувствительные к повышенной температуре смеси, одновременно используя греющий пар более низких параметров.
· Простая перегонка с дефлегмацией
Пары, уходящие из куба, частично конденсируются в дефлегматоре, причем преимущественно конденсируются ВКК. Пары, обогащенные НКК, конденсируются в холодильнике-конденсаторе. · Перегонка в токе водяного пара (или инертного газа) Применяется с целью извлечения компонентов из смесей при небольшой летучести и при условии нерастворимости их в воде. При перегонке высококипящих веществ, нерастворимых в воде, с водяным паром температура кипения смеси будет ниже температуры кипения воды при данном давлении (при Р = 1 атм.,
Исходная смесь загружается в куб и нагревается до температуры перегонки «глухим» паром, то есть через стенку.
Далее через барботёр подают «острый» пар. Смесь водяных паров и углеводородных паров конденсируется в холодильнике и поступают в сепаратор.
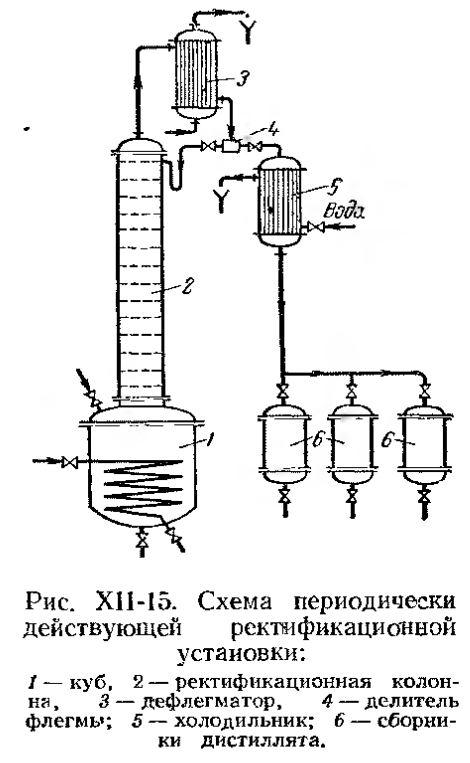
· Периодически действующая ректификационная установка
Применяются в установках небольшой производительности. Исходную смесь загружают в куб ( бинарную или многокомпонентную ). Имеются флегма, которую возвращают вверх колонны и дистиллят, который направляют в различные сборники. Ректификацию проводят до достижения определенного состава кубового остатка.
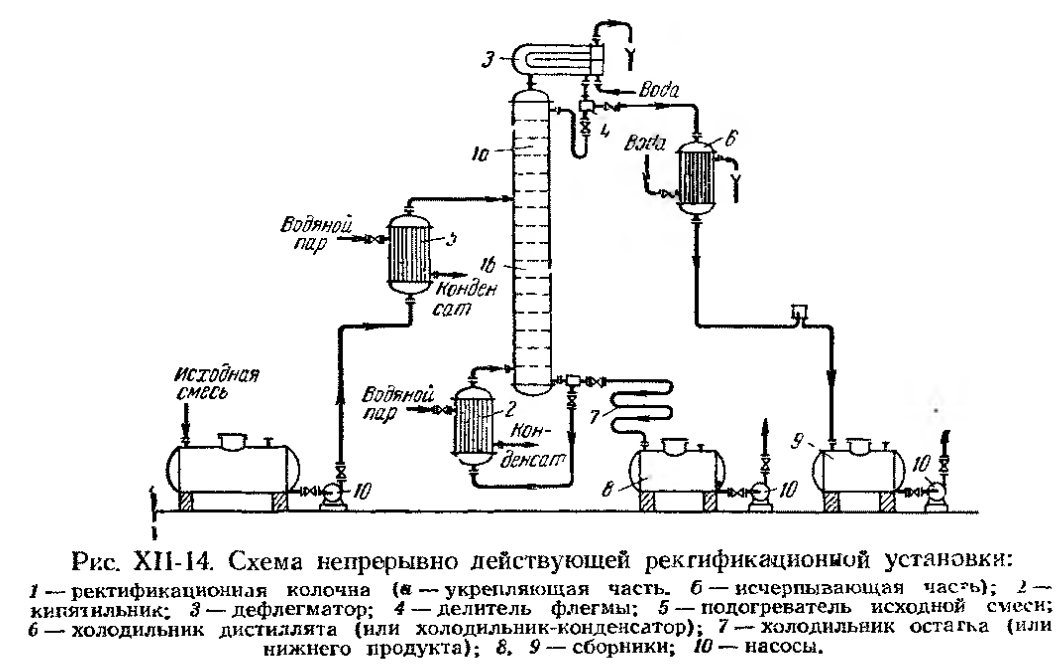
· Непрерывно действующие установки
Исходная смесь непрерывно подается на питающую ( эвапорационную ) тарелку, как правило, в подогретом до температуры кипения состоянии. Питающая тарелка условно делит колонну на 2 части: верхнюю – укрепляющую (концентрационную); нижнюю – исчерпывающую (отпарную). С помощью кипятильника создается восходящий поток пара. Внизу, в кубе, пар представляет собой практически чистый ВКК, по мере движения вверх он обогащается НКК. Жидкость вверху представляет собой практически чистый НКК, по мере движения вниз она обогащается ВКК. С помощью дефлегматора в колонне создается нисходящий поток жидкости. Флегма – по составу почти чистый НКК, соответствует составу дистиллята. Поскольку в месте подачи исходного питания соотношение материальных потоков резко изменяется, материальный баланс для верхней и нижней частей колонны рассчитывается отдельно. Уравнения рабочих линий Для построения рабочих линий колонны составим материальный баланс для элемента dF:
a) Верхняя часть:
Т.к. (R+1) (
Уравнение рабочей линии укрепляющей части колонны: прямая в координатах: y - x, tgα = b) Нижняя часть:
Обозначим F =
(R+1) (y - Т.к. (R +1) (y -
Это уравнение рабочей линии нижней (исчерпывающей) части колонны. Построение рабочих линий на y-x диаграмме
Откладываем на оси у отрезок B = Зная величину R: Верх колонны: Куб колонны:
Вторую точку нижней рабочей линии, решая совместно систему уравнений:
r wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>">
Из баланса для всей колонны:
Заменим
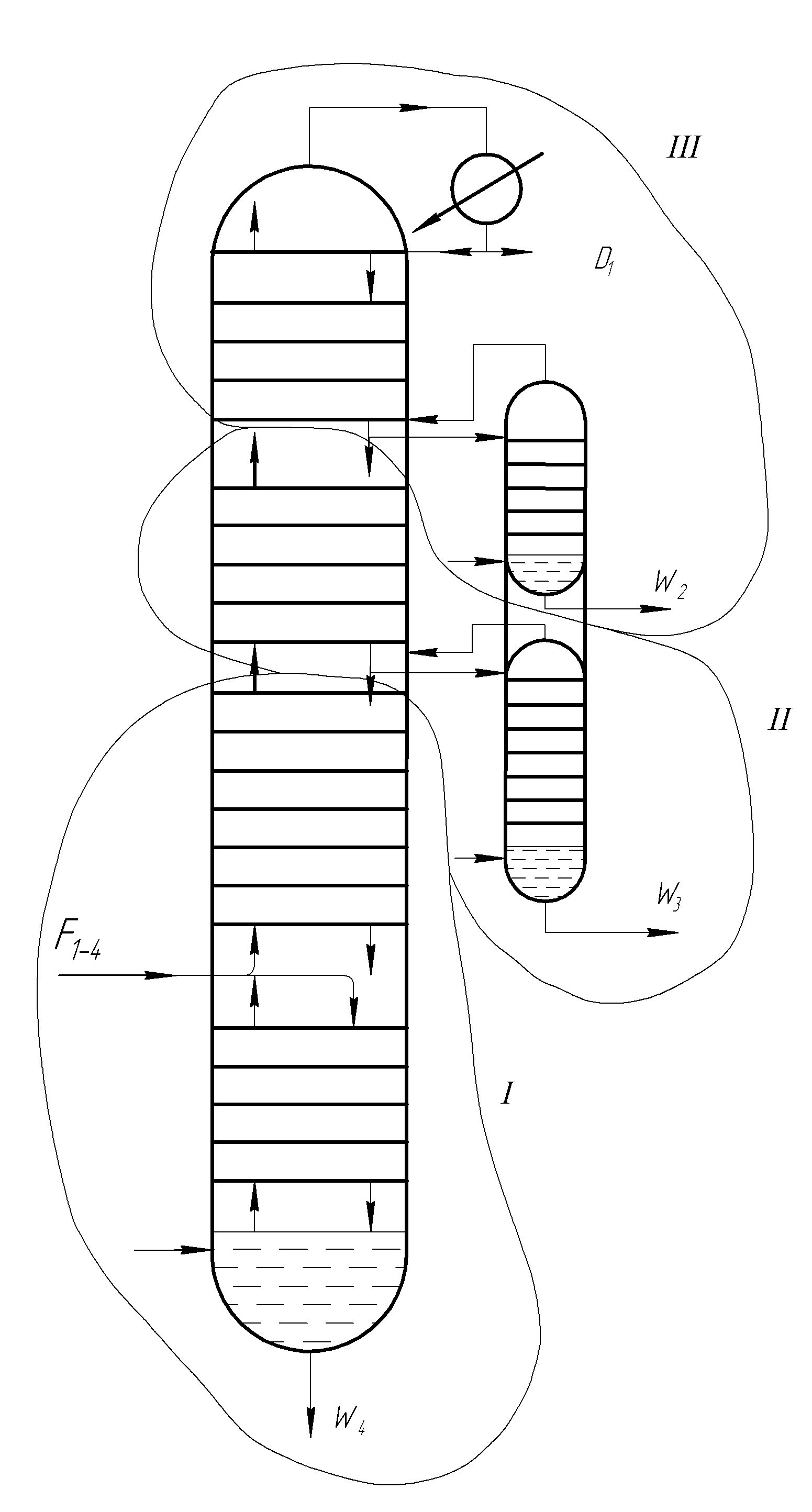
Сравнивая уравнения, находим x = xf, т.е. линия пересечения в точке, лежащей на вертикали x f. Необходимо отметить, что рабочие линии, в отличие от абсорбции, располагаются под линией равновесия: это свидетельствует, по существу, о десорбции НКК, испарению его из жидкости. При питании насыщенными парами -> пересечение на линии yf, по колонне не меняется расход жидкости. Схема сложной колонны на примере разделения четырехкомпонентной смеси: I – III – контуры, выделяющие отдельные части сложной колонны
В сущности она представляет собой простую колонне с наращенными на неё концентрационными частями последующих колонн. Отгонные части колонн выполнены в виде самостоятельных аппаратов, называемых отпарными или стриппинг-секциями. Процесс протекает следующим образом: флегма, полученная при конденсации паров вверху колонны (III), последовательно перетекает по тарелкам концентрационной части колонны (III). Достигнув последней тарелки этой колонны часть флегмы стекает дальше в колонну (II), а оставшаяся часть отбирается в отпарную секцию. Пары из этой секции возвращаются обратно в колонну (III), а компонент W 2 отводится в виде бокового продукта. Аналогичная картина наблюдается и в колонне (II). Недостатки: 1. Значительное возрастание общей высоты колонны. 2. Ухудшение четкости разделения компонентов (вследствие сложности регулирования флегмового числа в каждой части колонны). Это не так важно для нефтепродуктов, т.к. они отбираются в виде довольно широко выкипающих фракции. Экстрактивная и азеотропная ректификации Эти виды ректификации используются для разделения компонентов с очень близкими летучестями (температурами кипения), а также для разделения азеотропных смесей. В обоих случаях к исходной смеси добавляется « разделяющий агент ». Сущность метода экстрактивной ректификации заключается в том, что к исходной смеси прибавляется « разделяющий агент » с высокой температурой кипения, в котором один из разделяемых компонентов растворим хорошо, а другой – либо нерастворим, либо труднорастворим. Присутствие экстрагирующего компонента приводит к уменьшению сил притяжения частиц нерастворимого компонента в растворе по отношению к остальным частицам и, в результате, к увеличению его относительной летучести в системе. Резкое изменение летучести значительно облегчает разделение исходных компонентов, а растворитель удаляется с кубовым остатком.
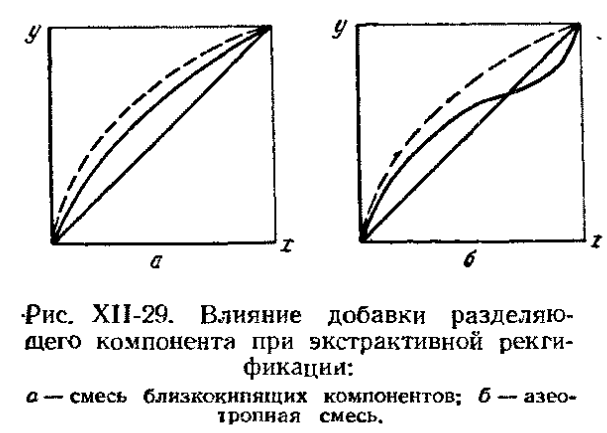
При азеотропной ректификации применяют разделяющий агент, образующие с одним из компонентов новую азеотропную смесь с минимальной температурой кипения. На рисунке показано влияние добавки разделяющего агент на изменение относительной летучести компонентов бинарной смеси:
Экстрактивной ректификации (на примере разделения бензола и циклогексана в присутствии разделяющего агента – фенола ). Фенол хорошо растворяет циклогексан и превращает его в ВКК.
Процесс проводится в двух колоннах: ректификационной (1) и отгонной (2).
А – бензол; В – циклогексан; С – фенол.
При азеотропной ректификации применяют растворители, образующие с одним из компонентов новую азеотропную смесь с минимальной температурой кипения. Например, для получения безводного (абсолютного) этилового спирта из его азеотропной смеси с водой применяют в качества такого растворителя бензол, образующий с водой новую азеотропную смесь с более низкой температурой кипения (63°С). В результате этого вода с бензолом переходят в дистиллят (т.е. растворитель-бензол удаляется с дистиллятом, а в кубовом остатке получается безводный спирт). Поле этого бензол отделяется от воды отстаиванием.
А – вода; В – этиловый спирт; С - бензол. Графическая ошибка в работе сепаратора 2! Если же растворитель и отогнанный компонент взаиморастворимы, то полученный дистиллят подвергают разделению в отдельной колонне, в которой в кубовом остатке получают компонент, а в дистилляте – азеотропную смесь этого компонента с растворителем, которую возвращают в первую колонну.
Основным преимуществом экстрактивной ректификации перед азеотропной является меньший расход тепла, т.к. при экстрактивной ректификации не требуется испарять растворитель.
Можно также применять большое число растворителей.
Материальный баланс F=W+P (1) По НКК: F F( W = F Из уравнений (1) и (2) можно найти P и W по выбранным концентрациям
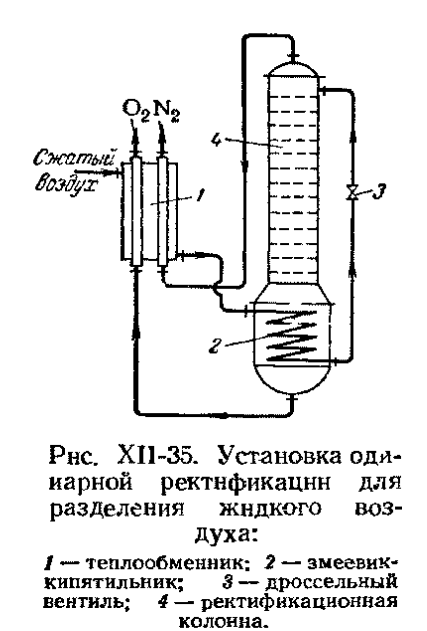
Материальный баланс F=W+P По легколетучему компоненту: F F( > Можно вычислить P и W по выбранным концентрациям Эти колонны применяются в криогенной технике для разделения воздуха.
Одноколонный аппарат:
Куб обогревается сжатым воздухом, а исходная смесь подается на верх колонны. Продукты: чистый кислород, а также азот с примесью (7-10%). При такой организации разделения воздуха большие потери кислорода ( Двухколонный аппарат:
Аппарат двойной ректификации состоит из двух колонн, орошаемых азотной флегмой. Температура кипения (конденсации) при различных давлениях → в табл.
Воздух поступает в змеевик. Смесь в кубе имеет температуру -173° и кипит. Воздух охлаждается и частично конденсируется, далее оросселируется и подается в нижнюю колонну. В парах содержится 95%
Равновесие в системах пар – жидкость Рассмотрим бинарные смеси, не взаимодействующие химически друг с другом. По правилу фаз, число степеней свободы равно: С= К-Ф+2= 2-2+2=2 Из трех независимых параметров, определяющих состояние системы (t,p,c) только две можно выбрать произвольно, при этом определяется значение третьего параметра. Поэтому для характеристики бинарных систем пользуются фазовыми диаграммами, содержащими равновесные зависимости: · Давление пара от состава жидкости: P-X (t= const); · Температура кипения и конденсации от состава жидкости и пара: T-X-Y (P=const); · Состава пара от состава жидкости: Y-X (P=const). Вид этих зависимостей, характеризующих поведение жидкой смеси, зависит, в основном, от природы веществ, их взаимной растворимости. Различают следующие смеси жидкостей: 1. С неограниченной взаимной растворимостью 2. Взаимно нерастворимые 3. Ограниченно растворимые
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 1149; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.107.241 (0.134 с.) |
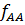 =
= 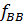 =
= 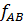 .
.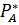 =
= 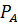
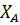 ;
;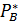 =
= 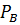 (1-
(1- 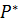 - равновесная упругость
- равновесная упругость - упругость насыщенных паров чистого компонента при данной температуре (по справочникам)
- упругость насыщенных паров чистого компонента при данной температуре (по справочникам) - мольная доля компонента. А (НКК)
- мольная доля компонента. А (НКК)
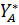
 ),
),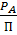 Х;
Х;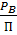 (1-
(1- 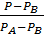 ; Y=
; Y= 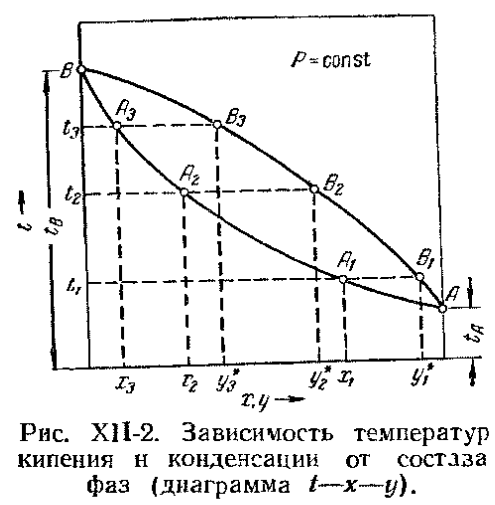
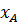 =
= 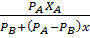 =
= 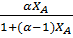 ;
; ;
; = f(x) - кривая,
= f(x) - кривая,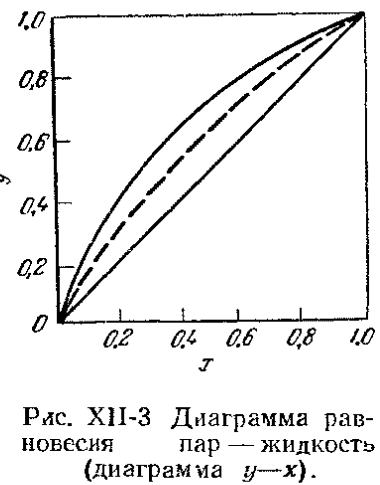
 ≠ X
≠ X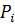 вводят активности компонентов
вводят активности компонентов  .
.
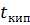 < 100°C).
< 100°C).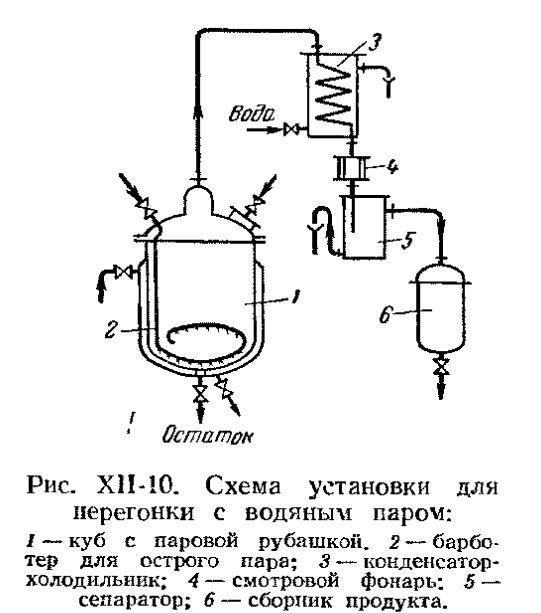
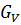 dy = Ldx.
dy = Ldx.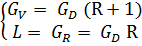 ;
;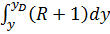 =
= 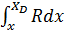 ;
;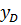 =
= 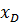 , то:
, то: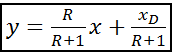 ;
;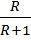 ; B =
; B = 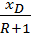 ;
;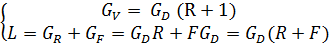 ;
;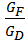 ;
;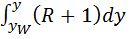 =
= 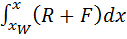 ;
; ) = (R+F)(x -
) = (R+F)(x -  );
);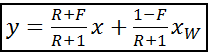 ; где F =
; где F = 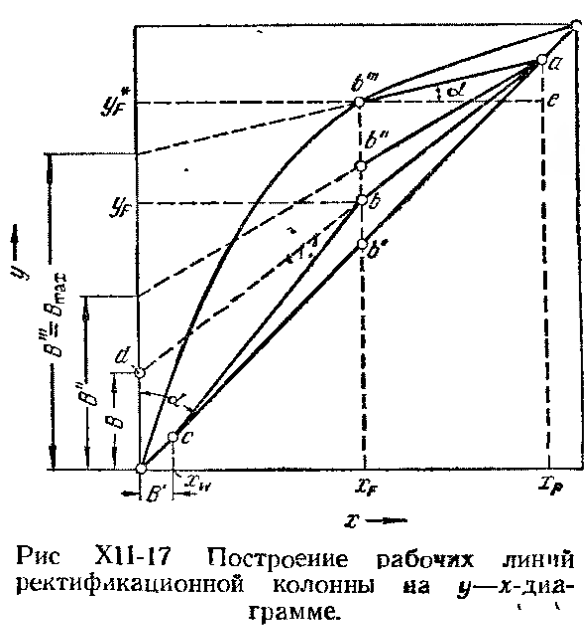
 =
=  ;
;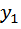 =
= 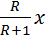 +
+ 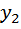 =
= 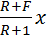 +
+ 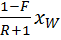 ;
;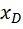 = f x +
= f x + 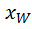 ;
;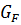
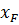 =
= 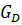
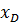 +
+ 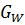
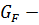
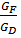 = f
= f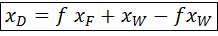 ;
;


 = W
= W  + P
+ P  ; заменяя P=F-W получаем:
; заменяя P=F-W получаем: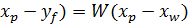 (2)
(2)
 .
.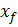 = F
= F  + W
+ W 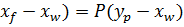

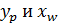 .
.
 его уходит с азотом).
его уходит с азотом).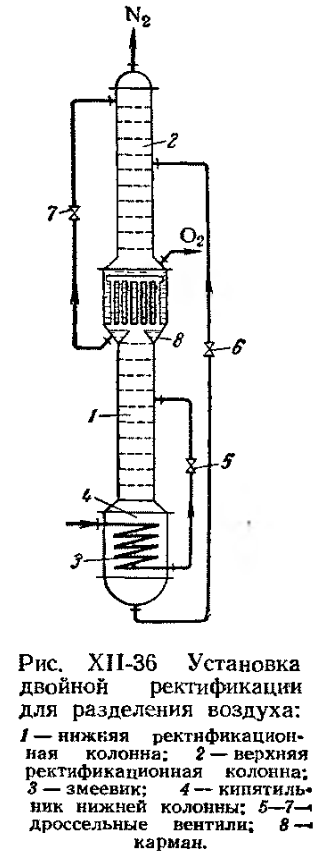

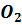
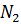 , в кубе 35-45%
, в кубе 35-45% 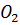 .
.


