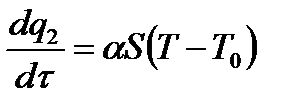Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы возникновения горения
Во всех случаях для процесса горения характерны три стадии: 1. Возникновение горения. 2. Распространение пламени. 3. Погасание пламени (прекращение горения). Импульс началу реакции горения (воспламенения) горючей смеси дает: - либо нагрев самой смеси горючего и окислителя (самовоспламенение, самовозгорание); - либо внешний источник воспламенения: искра, пламя, нагретое тело, ударная волна (зажигание). 1) Тепловое самовоспламенение (тепловой взрыв) Самовоспламенение – это явление резкого увеличения скорости экзотермических реакций, приводящее к самопроизвольному возникновению горения вещества в отсутствии источника зажигания. Теория теплового самовоспламенения разработана академиком Семеновым Н.Н., который исходил из представления об ускорении реакций окисления с температурой и преобладания скорости тепловыделения над теплоотводом. При окислительной реакции, проходящей с полной отдачей образующегося тепла, горение не возникает. Горение возникает лишь в условиях резкого самоускорения химического процесса, связанного с накоплением либо тепла в системе (так называемое тепловое самовоспламенение), либо катализирующих промежуточных продуктов реакции (цепное самовоспламенение). Суть тепловой теории заключается в следующем. Рассмотрим поведение горючей смеси, заключенной в сосуд объемом V с постоянной температурой во всех точках сосуда Т. В смеси протекает химическая реакция с выделением тепла. Выделившееся тепло Количество тепла, отводимое от поверхности сосуда в единицу времени, выражается линейной зависимостью:
где: α – коэффициент теплоотдачи; S – площадь поверхности стенок сосуда, T 0 – температура окружающей среды. Решающим условием возникновения процесса горения является превышение скорости выделения тепла реакции над скоростью отдачи тепла реагирующей системой в окружающую среду. 2) Цепное самовоспламенение (цепной взрыв)
По теории Аррениуса скорость химической реакций определяется числом молекул, обладающих энергией активации. Однако саморазогрев горючей смеси при экзотермической реакции из-за недостаточного теплоотвода (по тепловой теории самовоспламенения) – не единственно возможный механизм ускорения реакций.
Согласно цепной теории самовоспламенения, химическая реакция самоускоряется не путем непосредственного взаимодействия исходных молекул с выделением тепла, а с помощью активных "осколков" (радикалов, атомарных частиц и др.), образующихся при распаде этих молекул. При этом скорость реакций может прогрессивно возрастать и в изотермических условиях. Таким образом, причиной самоускорения реакций может быть накопление в системе как тепла реакции, так и химически активных продуктов реакции. Цепной механизм реакции объясняется перераспределением избыточной энергии, которая реализуется в реакции следующим образом: запас химической энергии, сосредоточенный в молекуле продукта первичной реакции, передается одной из реагирующих молекул, которая переходит в химически активное состояние. Подобные условия более благоприятны для протекания реакции, чем условия, при которых химическая энергия взаимодействия переходит в энергию теплового хаотического движения. При таком механизме передачи энергии реакция приводит к образованию одной или нескольких новых активных частиц – возбужденных молекул, свободных радикалов или атомов. Таковы, например, атомарный водород, кислород, хлор, радикалы и гидроксил, и т.д. Все эти вещества, являясь химически ненасыщенными, отличаются высокой реакционной способностью и могут реагировать с компонентами смеси, образуя в свою очередь, свободные радикалы и атомы. Так образуется цепочка последовательных реакций. Цепная реакция протекает различно, в зависимости от того, сколько активных вторичных центров образуется на каждый израсходованный активный центр – один или больше одного. В первом случае общее число активных центров остается неизменным, и реакция протекает с постоянной (при данных температуре и концентрации) скоростью, т.е. стационарно. Во втором случае число активных центров непрерывно возрастает, цепь разветвляется и реакция самоускоряется. Это неограниченное, до полного израсходования реагирующих компонентов, самоускорение воспринимается как самовоспламенение. Внешне реакция протекает так же, как и при тепловом самовоспламенении. Различие состоит в том, что при тепловом механизме в реагирующей смеси накапливается тепло, а при цепном механизме – активные центры. Оба фактора ведут к ускорению реакции. Цепное воспламенение принципиально может осуществляться при постоянной температуре без заметного разогрева смеси.
Условием ускорения реакции является в данном случае превышение числа разветвления цепей над числом их обрывов (при образовании конечного продукта, на стенках реакционного сосуда и т.д.). Цепные реакции могут протекать и при полном отводе тепла, т.е. в изотермических условиях, тогда как при тепловом механизме реакция должна была бы прекратиться. По цепной теории появление тепла – только следствие процесса, а не причина возникновения горения.
|
||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 258; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.144.197 (0.005 с.) |
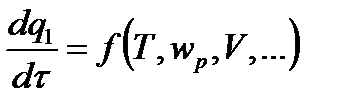 (где w p – скорость реакции) расходуется на нагрев смеси и потери в окружающую среду за счет теплопроводности и излучения.
(где w p – скорость реакции) расходуется на нагрев смеси и потери в окружающую среду за счет теплопроводности и излучения.