
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение состояния и изопроцессы
Простейшей идеализированной моделью вещества является идеальный газ. Идеальный газ - этогаз, в котором взаимодействие между молекулами пренебрежимо мало, а размеры молекул много меньше размеров сосуда. Для описания сложной системы (термодинамической системы), состоящей из большого числа молекул, используют усреднённые параметры системы. Основные из этих параметров - объём, давление и температура. Уравнение состояния – функциональная зависимость между параметрами состояния при равновесии. Общий вид уравнения состояния термодинамической системы F (P, V, T) = 0. (1) Конкретный вид уравнения зависит от физических свойств рассматриваемой системы. Большинство газов при нормальных условиях с достаточной точностью могут быть описаны уравнением состояния идеального газа. Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона)
где R – универсальная газовая постоянная, R = 8,31 Дж / (моль×К); Универсальная газовая постоянная это физическая величина, характеризующая работу одного моля газа при его изобарном нагревании на один Кельвин. Другая форма уравнения состояния
где Т – термодинамическая температура, k –постоянная Больцмана, k = 1,38·10-23Дж/К. Все законы идеальных газов для изопроцессов могут быть получены из уравнения состояния идеального газа. Таблица 1 Частные случаи уравнения состояния идеального газа
ТЕПЛОЕМКОСТЬ
Теплоемкостью системы тел (тела) называется физическая величина, характеризующая количество теплоты которое нужно затратить для изменения температуры системы тел (тела) на один Кельвин.
Удельной теплоёмкостью вещества с называется скалярная физическая величина, характеризующая количество теплоты, которое нужно затратить для изменения температуры одного килограмма однородного тела на один Кельвин.
Молярной теплоёмкостью называется скалярная физическая величина, характеризующая количество теплоты, которое нужно затратить для изменения температуры одного моля веществана один Кельвин.
Количество теплоты и значения теплоемкостей зависят от типа процесса. Если теплообмен происходит при постоянном давлении (изобарный процесс) или постоянном объеме (изохорный процесс), то разность соответствующих молярных теплоемкостей С P и С V определяется уравнением Майера.
ПОЛИТРОПНЫЙ ПРОЦЕСС Политропным называется термодинамический процесс, при котором теплоемкость тела остаётся постоянной
Показатель политропы
где С P и С V – молярные теплоёмкости тела при постоянном давлении и постоянном объеме. Уравнение политропы
где п – показатель политропы. Частными случаями политропного процесса являются все изопроцессы и адиабатический процесс (табл. 2).
Таблица 2 Частные случаи политропного процесса
АДИАБАТИЧЕСКИЙ ПРОЦЕСС
Адиабатическим называется процесс, протекающий без теплообмена с внешней средой
Диаграмма этого процесса в координатах р - V представлена на рисунке 1.
Уравнение адиабатического процесса (уравнение Пуассона) имеет вид
Работа адиабатического расширения
где А 12– работа адиабатического расширения (на рисунке 1 это площадь заштрихованной фигуры), т – масса газа, М – молярная Ошибка! Закладка не определена. масса, R – универсальная газовая постоянная, g – показатель адиабаты (коэффициент Пуассона), T 1 и Т 2 – температура в состояниях 1 и 2. Учитывая распределение внутренней энергии по степеням свободы и уравнение Майера, можно получить распределение теплоёмкостей С P и CV по степеням свободы. Значения C V, С P и g для различных молекул представлены в таблице 10 справочных материалов. Величина γ определяется числом и характером степеней свободы молекулы
где i – число степеней свободы молекулы, С V – молярная теплоемкость при постоянном объеме, С P – молярная теплоемкость при постоянном давлении.
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 147; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.66.206 (0.008 с.) |
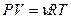 или
или 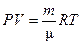 . (2)
. (2)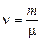 – количество вещества; m – масса газа;
– количество вещества; m – масса газа; 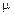 – молярная масса газа.
– молярная масса газа.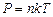 . (3)
. (3)
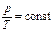
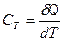 , [ C Т ] = Дж/K. (4)
, [ C Т ] = Дж/K. (4)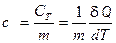 , [ с ] = Дж∙кг–1∙К–1 (5)
, [ с ] = Дж∙кг–1∙К–1 (5)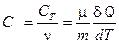 ,[ С ] = Дж·моль–1∙К–1. (6)
,[ С ] = Дж·моль–1∙К–1. (6)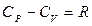 . (7)
. (7)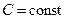 .
.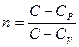 , (8)
, (8)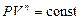 , (9)
, (9)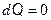 ,
, 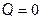 . (10)
. (10)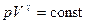 . (11)
. (11)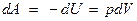 . (12)
. (12)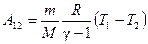 . (13)
. (13)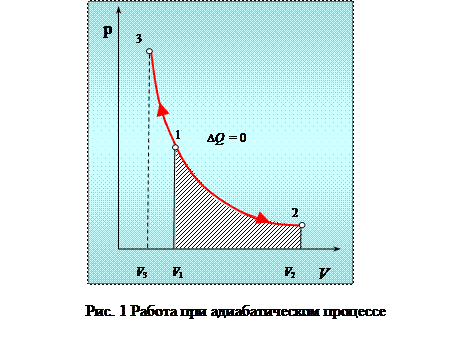
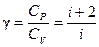 . (14)
. (14)


