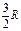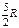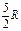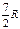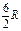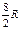Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первое высшее техническое учебное заведение РоссииСтр 1 из 6Следующая ⇒
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей и технической физики
Лаборатория виртуальных экспериментов ЛАБОРАТОРНАЯ РАБОТА №8 ФИЗИКА. ТЕРМОДИНАМИКА. ПОЛИТРОПНЫЙ ПРОЦЕСС Методические указания к виртуальной лабораторной работе
САНКТ-ПЕТЕРБУРГ 2019
ВВЕДЕНИЕ
Общая цель выполнения любой работы из лабораторного практикума, как и преподавания дисциплины в целом - обеспечить приобретение знаний и умений по физике в соответствии с Федеральным государственным образовательным стандартом (ФГОС). Лабораторный практикум является одной из форм образовательных технологий и направлен на формирование общих и профессиональных компетенций. В результате выполнения лабораторной работы студенты приобретают навыки использования современной научной аппаратуры для проведения физического эксперимента и научных исследований; осваивают методы физического исследования, которые включают планирование, постановку и обработку результатов эксперимента (компьютерную, аналитическую, графическую); учатся систематизировать информацию по теме исследований. При этом формируются способности к самостоятельной и познавательной деятельности студентов. Методические указания к лабораторной работе предназначены для самостоятельной работы студентов. Они содержат основные теоретические сведения по теме, а также порядок выполнения и оформления лабораторной работы. При выполнении лабораторной работы, студент должен понимать физический смысл данного явления или процесса, рассматриваемого в лабораторной работе. Поэтому к выполнению работы целесообразно приступать только после изучения теоретического и методического материала, соответствующего данному разделу, используя при этом как данную методическую разработку, так и рекомендуемую учебную литературу.
ТЕПЛОЕМКОСТЬ
Теплоемкостью системы тел (тела) называется физическая величина, характеризующая количество теплоты которое нужно затратить для изменения температуры системы тел (тела) на один Кельвин.
Удельной теплоёмкостью вещества с называется скалярная физическая величина, характеризующая количество теплоты, которое нужно затратить для изменения температуры одного килограмма однородного тела на один Кельвин.
Молярной теплоёмкостью называется скалярная физическая величина, характеризующая количество теплоты, которое нужно затратить для изменения температуры одного моля веществана один Кельвин.
Количество теплоты и значения теплоемкостей зависят от типа процесса. Если теплообмен происходит при постоянном давлении (изобарный процесс) или постоянном объеме (изохорный процесс), то разность соответствующих молярных теплоемкостей С P и С V определяется уравнением Майера.
ПОЛИТРОПНЫЙ ПРОЦЕСС Политропным называется термодинамический процесс, при котором теплоемкость тела остаётся постоянной
Показатель политропы
где С P и С V – молярные теплоёмкости тела при постоянном давлении и постоянном объеме. Уравнение политропы
где п – показатель политропы. Частными случаями политропного процесса являются все изопроцессы и адиабатический процесс (табл. 2).
Таблица 2 Частные случаи политропного процесса
АДИАБАТИЧЕСКИЙ ПРОЦЕСС
Адиабатическим называется процесс, протекающий без теплообмена с внешней средой
Диаграмма этого процесса в координатах р - V представлена на рисунке 1.
Уравнение адиабатического процесса (уравнение Пуассона) имеет вид
Работа адиабатического расширения
где А 12– работа адиабатического расширения (на рисунке 1 это площадь заштрихованной фигуры), т – масса газа, М – молярная Ошибка! Закладка не определена. масса, R – универсальная газовая постоянная, g – показатель адиабаты (коэффициент Пуассона), T 1 и Т 2 – температура в состояниях 1 и 2. Учитывая распределение внутренней энергии по степеням свободы и уравнение Майера, можно получить распределение теплоёмкостей С P и CV по степеням свободы. Значения C V, С P и g для различных молекул представлены в таблице 10 справочных материалов. Величина γ определяется числом и характером степеней свободы молекулы
где i – число степеней свободы молекулы, С V – молярная теплоемкость при постоянном объеме, С P – молярная теплоемкость при постоянном давлении.
Вывод рабочей формулы Рассмотрим метод Клемана–Дезорма. Откроем кран 10 и впустим воздух в стеклянный сосуд 1 (см. рис. 2), после чего закроем кран. При быстром сжатии температура воздуха повышается. Поэтому после прекращения напуска разность уровней жидкости в манометре будет постепенно уменьшаться, пока температура воздуха внутри сосуда не сравняется с температурой окружающего воздуха. Назовем состояние воздуха в сосуде после выравнивания температур состоянием 1. Параметры состояния 1: V 1 - объем единицы массы воздуха; Т 1 - температура воздуха; Р 1 - давление в сосуде. Откроем кран 3и, как только давление в сосуде сравняется с атмосферным, закроем его. Так как расширение происходит очень быстро, то процесс близок к адиабатическому и, следовательно, температура понизится до Т 2. Объем единицы массы воздуха станет равным V 2. Воздух, оставшийся в сосуде, перейдет в состояние 2 с параметрами V 2, Т 2, Р 2 (Р 2 – атмосферное давление). Так как температура Т 2 меньше наружной, то воздух в сосуде будет постепенно нагреваться (вследствие теплообмена с окружающей средой) до температуры окружающего воздуха Т 1. Это нагревание происходит изохорно, так как кран закрыт. Давление воздуха в сосуде увеличивается по сравнению с атмосферным, и в манометре возникает разность уровней h 2, т.е. воздух переходит в состояние 3 с параметрами V 2, Т 1, Р 3. Таким образом, мы имеем три состояния газа с различными параметрами Р, V и Т (см. таблицу 3). В состояниях 1 и 3 воздух имеет одинаковую температуру, следовательно, параметры этих состояний можно связать уравнением изотермического процесса (уравнением Бойля–Мариотта).
Таблица 3 Параметры процесса в трёх состояниях
Переход от состояния 1 к состоянию 2 происходит адиабатически, поэтому параметры состояния связаны уравнением Пуассона (11):
Из уравнений (15) и (16) получим
Прологарифмировав равенство (17), получим
Если давление измерять жидкостным манометром, то вместо р можно писать соответствующую высоту столба жидкости. Тогда можно ввести обозначения
где H – атмосферное давление, h 1 – разность уровней манометра в первом состоянии, h 2 – разность уровней в третьем состоянии. Выражение (18) перепишем в виде
Так как величины h 1 и h 2, выраженные в миллиметрах ртутного столба, очень малы по сравнению с атмосферным давлением H, и, следовательно, дроби
где х - малая величина. Поскольку х 2 и, тем более, х 3 - величины высших порядков малости, ими можно пренебречь, тогда lg(1+ x) @ x и, следовательно,
Пренебрегая величиной h 2 в сумме H + h 2, получим расчетную формулу
ТРЕБОВАНИЯ К СОДЕРЖАНИЮ ОТЧЁТА ПО ЛАБОРАТОРНОЙ РАБОТЕ
Отчёт оформляется в печатном виде на листах формата А4 в соответствии с указанными ниже требованиями. Помимо стандартного титульного листа в содержании отчёта должны быть раскрыты пункты, перечисленные ниже. Цель работы. 2. Краткое теоретическое содержание. 1) Явление, изучаемое в работе. 2) Определения основных физических понятий, объектов, процессов и величин. 3) Законы и соотношения, описывающие изучаемые процессы, на основании которых, получены расчётные формулы. 4) Пояснения к физическим величинам и их единицы измерений. Схема установки. Расчётные формулы. Таблицы с результатами измерений и вычислений. (Таблицы должны иметь номер и название. Единицы измерения физических величин должны быть указаны в отдельной строке таблицы под строкой с обозначениями физических величин.) 7. Пример вычисления (для одного опыта). 1) Исходные данные.
2) Вычисления. 3) Окончательный результат. Графический материал. 1) Записать аналитическое выражение функциональной зависимости, которая представлена на графике. 2) На осях координат указать масштаб, физические величины и единицы измерения. 3) На координатной плоскости должны быть нанесены экспериментальные точки. 4) По результатам эксперимента, представленным на координатной плоскости, провести плавную линию, аппроксимирующую функциональную теоретическую зависимость в соответствии с методом наименьших квадратов. ПРАВИЛА ПОСТРОЕНИЯ ГРАФИКОВ
1. Графики строятся с использованием компьютера. 2. Перед построением графика необходимо четко определить, какая переменная величина является аргументом, а какая функцией. Значения аргумента откладываются на оси абсцисс (ось х), значения функции - на оси ординат (ось у). 3. Из экспериментальных данных определить пределы изменения аргумента и функции. 4. Указать физические величины, откладываемые на координатных осях, и обозначить единицы величин. 5. На осях координат указать масштаб (при очень больших или очень малых величинах, показательную часть в записи величины указать рядом с единицами измерений на оси). 6. Нанести на график экспериментальные точки, обозначив их (крестиком, кружочком, жирной точкой). 7. Провести через экспериментальные точки плавную линию, в соответствии с выбранной аппроксимирующей (приближающей) функцией, описывающей зависимость между величинами, полученными в результате экспериментальных измерений. (Определение параметров приближающей функции выполняется одним из наиболее распространённых математических методов - методом наименьших квадратов. В компьютерной программе Еxcel реализация метода осуществляется при использовании режима линии тренда и выбранного вид аппроксимирующей функции.) РЕКОМЕНДАЦИИ ПО ЗАЩИТЕ ОТЧЕТА
К защите допускаются студенты, подготовившие отчет в соответствии с требованиями к его содержанию в установленные сроки. После проверки преподавателем содержания отчёта, при наличии ошибок и недочетов, работа возвращается студенту на доработку. При правильном выполнении лабораторной работы, соблюдении всех требований к содержанию и оформлению отчёта, студент допускается к защите. Для успешной защиты отчета необходимо изучить теоретический материал по теме работы, а так же освоить математический аппарат, необходимый для вывода расчётных формул работы. При подготовке к защите, помимо данного методического пособия, необходимо использовать учебники и другие учебные пособия, рекомендованные к учебному процессу кафедрой ОТФ. Во время защиты студент должен уметь ответить на вопросы преподавателя в полном объёме теоретического и методического содержания данной лабораторной работы, уметь самостоятельно вывести необходимые расчётные формулы, выполнить анализ полученных зависимостей и прокомментировать полученные результаты.
СПРАВОЧНЫЕ ТАБЛИЦЫ
Таблица Множители и приставки для образования десятичных и кратных единиц
Таблица 6 Основные величины, их обозначения и единицы величин в СИ
Таблица 7 Число степеней свободы
* для молекул с жесткой связью между атомами ** для твердого тела с жесткой связью между атомами
Таблица 8 Основные физические постоянные
Таблица 9 Производные единицы СИ, имеющие наименование
Таблица 10 Значения CV, С P и g для различных молекул
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Детлаф А.А. Курс физики / А.А. Детлаф, Б.М. Яворский. М.: Высшая школа, 2009. 2. Иродов И.Е. Задачи по общей физике. СПб., М.: Лань, 2009. 3. Калашников Н.П. Физика. Интернет-тестирование базовых знаний / Н.П. Калашников, Н.М. Кожевников. СПб., М.: Лань, 2009. Сайт Росаккредагенства. www.fepo.ru. 4. Смирнова Н.Н., Фицак В.В. Физика. Механика поступательного движения. Методические указания по выполнению лабораторных работ. Национальный минерально-сырьевой университет ”Горный”. СПб, 2012. 61 с. 5. Савельев И.В. Курс физики. Т. 2, 3. СПб.: М.: Лань, 2008. 6. Сена Л.А. Единицы физических величин и их размерности. М.: Наука, 1977. 7. Трофимова Т.И. Краткий курс физики. М.: Высшая школа, 2010. 8. Трофимова Т.И. Курс физики. М.: Высшая школа, 2009. 9. Трофимова Т.И. Курс физики: задачи и решения. М.: Академия, 2009. 10. Чертов А.Г. Задачник по физике / А.Г. Чертов, А.А. Воробьёв. М.: Физматлит, 2009. 11. Фриш С.Э. Курс общей физики / С.Э. Фриш, А.В. Тимофеева СПб., М.: Лань, 2008. 12. Фицак В.В. Физика. Определение теплоемкости твердых тел. Методические указания к лабораторной работе. Национальный минерально-сырьевой университет ”Горный”. С-Пб, 2015, 19 с. СОДЕРЖАНИЕ
1. Введение. 2 2. Термодинамическая система и её параметры.. 2 3. Уравнение состояния и изопроцессы.. 3 4. Теплоемкость. 3 5. Политропный процесс. 4 6. Адиабатический процесс. 5 7. Лабораторная работа. Определение показателя адиабаты при адиабатическом расширении газа методом Клемана - Дезорма 6 Контрольные вопросы.. 9 8. Требования к содержанию отчёта по лабораторной работе. 9 9. Правила построения графиков. 10 10. Рекомендации по защите отчета. 11 11. Справочные таблицы.. 11 12. Библиографический список. 13 содержание. 13 ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей и технической физики
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 157; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.8.247 (0.1 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

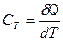 , [ C Т ] = Дж/K. (4)
, [ C Т ] = Дж/K. (4)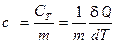 , [ с ] = Дж∙кг–1∙К–1 (5)
, [ с ] = Дж∙кг–1∙К–1 (5)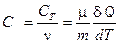 ,[ С ] = Дж·моль–1∙К–1. (6)
,[ С ] = Дж·моль–1∙К–1. (6)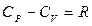 . (7)
. (7)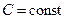 .
.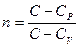 , (8)
, (8)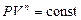 , (9)
, (9)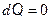 ,
, 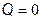 . (10)
. (10)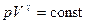 . (11)
. (11)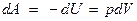 . (12)
. (12)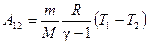 . (13)
. (13)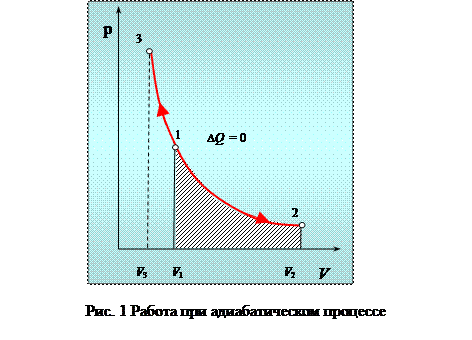
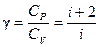 . (14)
. (14)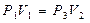 или
или 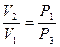 . (15)
. (15)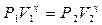 или
или 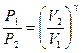 . (16)
. (16)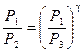 . (17)
. (17)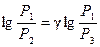 . (18)
. (18)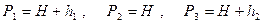
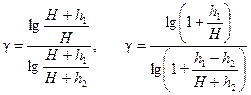 . (19)
. (19)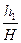 и
и 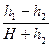 также незначительны, для нахождения величины логарифма можно воспользоваться приближенным выражением
также незначительны, для нахождения величины логарифма можно воспользоваться приближенным выражением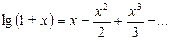 , (20)
, (20)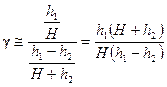 . (21)
. (21)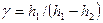 . (22)
. (22)
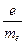 = 1,7588028(54)∙1011 Кл∙кг-1.
= 1,7588028(54)∙1011 Кл∙кг-1.