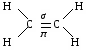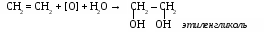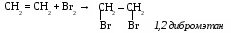Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 2. 3. Решение задач, связанных с понятием
"ВЫХОД ПРОДУКТА РЕАКЦИИ". η (выход продукта) - масса, или объем продукта реакции. выход теоретический - всегда 100 % выход практический –
Задача 1. При обжиге 500 кг СаСО3 получили 240 кг СаО. Определить выход оксида кальция в %от теоретически возможного. Дано:
Решение:
Ответ: ηСаО = 85,7% ηСаО =?
Задача 3. Сколько граммов CaC2 ввели в реакцию, если при этом получили 5,6 л С2Н2, что составляет 80%от теоретически возможного выхода?
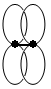
Лекция.ТЕМА 2.4: ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ Углеводороды, содержащие в углеродной цепи одну или несколько кратных (двойных или тройных) углерод-углеродных связей, называют непредельными. Термин «непредельные» означает, что атомы углерода не до предела насыщены атомами водорода и, как следствие, склонны к реакциям присоединения. Характеристика двойной связи. Двойная связь состоит из одной сигма-связи и одной пи-связи. Сигма-связь более прочная, она осуществляется по линии, соединяющей ядра атомов. Пи-связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Свободное вращение атомов углерода относительно двойной связи невозможно. s-связь
p-связь ЭТИЛЕН. Строение молекулы этилена. Молекула этилена имеет плоское строение, углы между направлениями связей равны 120º. Между атомами углерода располагается двойная связь, длина которой составляет 0,133 нм,
Физические свойства этилена. Этилен – газ без цвета и запаха, немного легче воздуха, нерастворим в воде, растворим в спирте и эфире. При концентрации 80%обладает наркотическим действием. Химические свойства этилена. 1. горение С2H4 + 3O2 → 2 CO2 + 2H2O 2. реакции присоединения а) окисление перманганатом калия
б) галогенирование
в) гидрогалогенирование CH2 = CH2 + НBr → CH3 – CH2Br бромэтан г) гидрирование CH2 = CH2 + Н2 → CH3 – CH3 этан д) гидратапия CH2 = CH2 + H2O → CH3 – CH2ОН этиловый спирт е) полимеризация n CH2 = CH2 → (– CH2 – CH2 –)n полиэтилен Получение этилена.
Применение этилена.
Этилен используется для получения растворителей, ядохимикатов, антифризов, полиэтилена, этилового спирта, дляускорения созревания овощей и фруктов.
Задача 2. При дегидратации 92 г этилового спирта получили этилен объемом 40 л. Вычислите выход этилена в %от теоретически возможного. Гомологический ряд этилена. Предельные углеводороды Не предельные углеводороды С2Н6 этан С2Н4 этилен, этен С3Н8 пропан С3Н6 пропилен, пропен С4Н10 бутан С4Н8 бутилен, бутен С5Н12 пентан С5Н10 амилен, пентен С6Н14 гексан С6Н12 гексилен, гексен СnН2n - общая формула этиленовых углеводородов
|
|||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 131; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.106.100 (0.005 с.) |