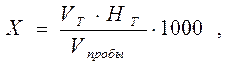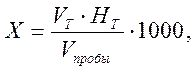Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение кислотности воды
Сущность метода. Кислотность определяется титрованием воды гидроксидом натрия в присутствии индикаторов. Кислотность определяется, если рН воды меньше 8,3, в противном случае ее кислотность равна нулю. Реактивы и оборудование Индикаторы: фенолфталеин, метилоранж или заменяющие их Гидроксид натрия, раствор с концентрацией 0,1 моль-экв./дм3 Ход определения Предварительно ориентировочно устанавливают рН воды. Кислотность определяют, если рН меньше 8,3. Если вода мутная, ее фильтруют, а если окрашенная – разбавляют дистиллированной водой. Разбавление проводят в мерных колбах вместимостью 100 – 200 см3. Сначала наливают в мерную колбу 20 – 30 см3 дистиллированной воды, потом точно отмеренный объем анализируемой воды, раствор перемешивают, доливают дистиллированную воду до метки и снова перемешивают. Взятый объем анализируемой воды учитывают при вычислении результата анализа. При определении кислотности титрование с разными индикаторами лучше проводить в отдельных порциях анализируемой воды. Определение общей кислотности. К 50 –100 см3 анализируемой воды прибавляют 10 капель раствора фенолфталеина и титруют раствором едкого натра на белом фоне до появления неисчезающего малинового (при использовании фенолфталеина) окрашивания. Определение свободной кислотности. К другой пробе анализируемой воды (50 – 100 см3) прибавляют 5 – 6 капель метилоранжа (или одного из заменяющих его индикаторов). При наличии в воде сильных кислот появляется розовая окраска. В этом случае пробу титруют раствором гидроксида натрия до изменения окраски индикатора по сравнению с раствором сравнения. Для приготовления раствора сравнения отбирают такой же объем воды и добавляют столько же капель индикатора.
Расчет. Содержание кислот (Х) в ммоль-экв./дм3 вычисляют по формуле: где V Т – объем титранта, см3; НТ – концентрация титранта, моль-экв./дм3; V пробы – объем пробы, см3; 1000 – коэффициент для перехода от моль-экв. к ммоль-экв.
Щелочность
Щелочностью воды называют содержание в ней веществ, вступающих в реакцию с сильными кислотами. К этим веществам относят: 1) сильные основания (гидроксид натрия, гидроксид калия и т.п.); 2) слабые основания (аммиак, анилин, пиридин и т.п.);
3) анионы слабых кислот (НСО3-, СО32-, Н2РО4-, НРО42-, НSO3-, SO32-, анионы гуминовых кислот, HS-, S2- и т.д.), которые гидролизуются с образованием гидроксид-анионов, например: НСО3– + Н2О = Н2СО3 + ОН– При титровании сильной кислотой реакции протекающие между нею и различными веществами, обуславливающими щелочность воды заканчиваются при различных значениях рН раствора. При оттитровывании сильных оснований кислотой реакция среды будет нейтральной. При титровании веществ второй группы соляной кислотой в конце титрования раствор должен содержать соответствующие этим основаниям положительно заряженные ионы, например: NH3 + H+ = NH4+ C6H5NH2 + H+ = C6H5NH3+ которые, гидролизуясь, придают раствору слабокислую реакцию: NH4+ + H2O = NH4OH + H+
Слабокислая реакция создается в растворе и в конце титрования анионов, входящих в третью группу, так как при таком титровании образуются соответствующие слабые кислоты, частично диссоциирующие с образованием ионов водорода, например: СН3СООН = СН3СОО– + Н + Общая щелочность поверхностных вод обычно связана с присутствием в ней гидрокарбонатов щелочноземельных металлов, в меньшей степени – щелочных. В этом случае значение рН воды не превышает 8,3. Растворимые карбонаты и гидроксиды (в случае сточных вод) повышают значение рН. Ионы ОН- и СО32 – титруют соляной кислотой в присутствии индикатора фенолфталеина или потенциометрическим методом до рН = 8,3. Количественное содержание этих ионов называется свободной щелочностью, или щелочностью воды по фенолфталеину. При этом протекают следующие реакции: ОН- + Н+ = Н2О; СО32 – + Н+ = НСО3 – Ионы НСО3– титруются соляной кислотой в присутствии индикатора метилового оранжевого или потенциометрическим методом до рН = 4,5. Протекающую при этом реакцию можно выразить уравнением: НСО3 – + Н+ = СО2 + Н2О Количество кислоты, необходимое для достижения рН 4,5, эквивалентно общей щелочности. Определение щелочности полезно при дозировании химических веществ, необходимых для обработки вод в целях водоснабжения, а также при реагентной очистке некоторых сточных вод. Определение щелочности важно при установлении пригодности воды для ирригации.
Если щелочность по фенолфталеину равна нулю, то общая щелочность определяется присутствием в воде только гидрокарбонат-ионов. Поскольку для подавляющего большинства природных вод гидрокарбонат-ионы связаны только с катионами кальция и магния, то в случае щелочности по фенолфталеину, равной нулю, можно считать, что общая щелочность воды равна ее карбонатной жесткости.
Лабораторная работа № 8 Определение щелочности Сущность метода. Щелочность определяют при рН воды больше 4,5. Щелочность устанавливают титрованием воды раствором сильной кислоты в присутствии подходящих индикаторов. Реактивы и оборудование Индикаторы Фенолфталеин Метилоранж Соляная или серная кислота, 0,1 моль-экв./дм3 Бюретки, конические колбы для титрования Ход определения Предварительно ориентировочно определяют рН воды. Если рН воды меньше 4,5, щелочность равна нулю. Если вода мутная, ее фильтруют, а если окрашенная – разбавляют дистиллированной водой. Определение свободной щелочности. В коническую колбу помещают 100 анализируемой воды, взятой непосредственно или предварительно разбавленной, как описано выше; приливают 5 капель фенолфталеина. Если появляется малиновая или розовая окраска, то содержимое колбы титруют на белом фоне соляной или серной кислотой до исчезновения окраски. Израсходованное на титрование количество кислоты соответствует щелочности воды по фенолфталеину, Определение общей щелочности. В коническую колбу помещают 100 см3 анализируемой воды, приливают 5 – 6 капель раствора метилоранжа или заменяющего его индикатора (метилового желтого, бромфенолового синего или смешанного индикатора). В другую коническую колбу наливают такой же объем анализируемой воды и столько же индикатора, сколько было введено в первый раствор. Ставят обе колбы на белую бумагу и титруют жидкость в первой колбе кислотой до тех пор, пока цвет ее не станет отличаться от цвета жидкости во второй колбе. Расчет. Содержание оснований (Х) в ммоль-экв./дм3 вычисляют по формуле:
где V Т – объем титранта, см3; НТ – концентрация титранта, моль-экв./дм3; V пробы – объем пробы, см3; 1000 – коэффициент для перевода от моль-экв. к ммоль-экв.
5.3. Определение растворенного кислорода
Количество кислорода, растворенного в воде, имеет большое значение для оценки состояния водоема. На его содержание в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее. К первой группе процессов, обогащающих воду кислородом, следует отнести: · процесс абсорбции кислорода из атмосферы; · выделение кислорода водной растительностью в процессе фотосинтеза; · поступление в водоемы с дождевыми и снеговыми водами, которые обычно пересыщены кислородом. Абсорбция кислорода из атмосферы происходит на поверхности водного объекта, ее скорость повышается с понижением температуры, с повышением давления и понижением минерализации. Фотосинтетическое выделение кислорода прикрепленными, плавающими растениями и фитопланктоном происходит тем сильнее, чем выше температура воды, интенсивность солнечного освещения и больше питательных веществ в воде.
К группе процессов, уменьшающих содержание кислорода в воде, относятся реакции окисления органических веществ – дыхание организмов, биохимическое окисление и химическое окисление (окисление Fe2+, Mn2+, NO3–, NH4+,CH4, H2S). Содержание растворенного кислорода подвержено сезонным и суточным колебаниям. Его снижение указывает на резкое изменение биологических процессов в водоемах, а также на загрязнение водоемов. Концентрация кислорода определяет величину окислительно-восстановительного потенциала и в значительной мере направление и скорость процессов химического и биохимического окисления органических и неорганических соединений. Кислородный режим оказывает огромное влияние на жизнь водоема. Минимальное содержание растворенного кислорода, обеспечивающее нормальное развитее рыб, составляет около 5 мг/дм3, понижение до 2 мг/дм3 вызывает массовую гибель (замор) рыбы. Концентрация растворенного кислорода в воде водоемов питьевого и культурно-бытового пользования в пробе, отобранной до 12 часов дня, должна быть не менее 4 мг/дм3в любой период года; для водоемов рыбохозяйственного назначения – не должна быть ниже 4 мг/дм3 в зимний период (при ледоставе) и 6 мг/дм3- в летний.
Лабораторная работа № 9
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 1283; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.54.6 (0.016 с.) |