
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Часть первая, техническая термодинамикаСтр 1 из 15Следующая ⇒
Введение
Ведущим звеном народного хозяйства является теплоэнергетика, базирующаяся на использовании тепловых процессов для производства тепловой и электрической энергии. Кроме того, большинство технологических процессов многих производств сопровождаются подводом и отводом теплоты. В настоящее время для снабжения теплом народного хозяйства затрачивается примерно треть всех используемых в стране топливно-энергетических ресурсов, в связи, с чем одной из важнейших задач социально-экономического развития страны является энергосбережение. Поэтому проблема оптимального использования теплоты во всех отраслях и сферах народного хозяйства имеет первостепенное значение. Вопросами промышленного использования тепловой энергии в различных технологических процессах и в теплоэнергетике, разработкой наиболее экономичных и эффективных теплоэнергетических и теплоиспользующих агрегатов и энергосберегающих технологий занимается обширная область науки и техники – теплотехника. Теоретическую базу теплотехники составляют две важные теоретические дисциплины – техническая термодинамика и теплопередача (теория теплообмена). Техническая термодинамика изучает закономерности взаимного превращения тепла в работу, взаимосвязь между тепловыми, механическими и химическими процессами, протекающими в тепловых двигателях и теплотехническом оборудовании, физические свойства и термодинамические процессы, протекающие в газах и парах. Вторым теоретическим разделом теплотехники является теплопередача, изучающая процессы распространения тепла в твёрдых, жидких и газообразных телах, основы расчёта теплообменных и теплоиспользующих установок. Задача изучения дисциплины – обеспечить теоретическую и практическую подготовку студентов в изучении термодинамических и теплообменных процессов, с целью разработки энергосберегающих технологий, а также технических решений по безопасному функционированию теплоэнергетического и технологического оборудования и объектов коммунально-бытовой сферы. ЧАСТЬ ПЕРВАЯ, ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕХНИЧЕСКОЙ ТЕРМОДИНАМИКИ
Предмет технической термодинамики и ее задачи
Термодинамика, являясь разделом теоретической физики, представляет собой одну из самых обширных областей современного естествознания – науку о превращениях различных видов энергии друг в друга. Это наука рассматривает самые разнообразные явления природы и охватывает огромную область химических, механических и физико-химических явлений. Техническая термодинамика – раздел общей термодинамики, изучающий закономерности взаимного превращения теплоты в работу. Она устанавливает взаимосвязь между тепловыми, механическими и химическими процессами, которые совершаются в тепловых и холодильных машинах, изучает процессы, происходящие в газах и парах, а также свойства этих тел при различных физических условиях. В теоретической части техническая термодинамика является общим отделом науки об энергии, а в прикладной части представляет собой теоретический фундамент всей теплотехники, изучающей процессы, протекающие в тепловых двигателях и тепловых машинах.
Термодинамическая система
Объект изучения в термодинамике называется термодинамической системой, а все, что лежит вне его границ, – окружающей средой. Термодинамической системой называется совокупность макроскопических тел, обменивающихся энергией как друг с другом, так и с окружающей (внешней) средой. Простейшим примером термодинамической системы (тела) может служить газ, находящийся в цилиндре с поршнем. К окружающей среде следует отнести цилиндр и поршень, воздух, который окружает их, стены помещения, где находится цилиндр с поршнем, и т. д. Если термодинамическая система не имеет никаких взаимодействий с окружающей средой, то ее называют изолированной, или замкнутой, системой. Система, окруженная так называемой адиабатной оболочкой, исключающей теплообмен с окружающей средой, называется теплоизолированной, или адиабатной. Системой. Примером теплоизолированной системы является рабочее тело, находящееся в сосуде, стенки которого покрыты идеальной тепловой изоляцией, исключающей теплообмен между рабочим телом и окружающей средой.
Термодинамический процесс
Основные термодинамические параметры состояния р, υ и Т однородного тела зависят один от другого и взаимно связаны определенным математическим уравнением вида
F(ρ,υ,Т)=0, (1.8) которое в термодинамике называют уравнением состояния. Если известно уравнение состояния, то для определения состояния рабочего тела достаточно знать две независимые переменные из числа трех:
р= f1 (υ, T); υ= f2 (p, T); T= f3 (υ, p). (1.9)
Если внешние условия, в которых находится термодинамическая система, изменяются, то будет изменяться и состояние системы. Совокупность изменений состояния термодинамической системы при переходе из одного равновесного состояния в другое называют термодинамическим процессом. Под равновесным состоянием тела понимают такое, при котором во всех точках его объема давление, температура, удельный объем и все другие физические свойства одинаковы. Процесс изменения состояния системы может быть равновесным и неравновесным. Если процесс, протекая, проходит через равновесные состояния, то его называют равновесным или обратимым. Термодинамика в первую очередь рассматривает равновесные состояния и равновесные процессы изменения состояния термодинамической системы. Только равновесные состояния могут быть описаны количественно с помощью уравнения состояния. Равновесный процесс можно осуществить при бесконечно медленном изменении внешних условий или когда изменения параметров, характеризующих состояние системы, бесконечно малы по сравнению со значениями самих параметров. Следовательно, реальные процессы, будучи неравновесными, могут лишь в той или иной степени приближаться к равновесным, никогда в точности с ними не совпадая. Их называют необратимыми процессами. С математической точки зрения уравнение состояния (1.8) в трехосной системе координат р, υ и Т выражает некоторую поверхность, которая называется термодинамической поверхностью. В технической термодинамике для исследования равновесных термодинамических процессов чаще всего применяют двухосную систему координат pυ, в которой осью абсцисс является удельный объем, а осью ординат – давление. Изменение параметра состояния в любом термодинамическом процессе не зависит от вида процесса, а целиком определяется начальным и конечным состояниями. Поэтому можно сказать, что любой параметр состояния является также функцией состояния.
Теплота и работа
Диалектический материализм учит, что неотъемлемым свойством материи является движение; оно неуничтожаемо, как сама материя. Движение материи проявляется в разных формах, которые могут переходить одна в другую. Мерой движения материи является энергия. Как показывают опыты, при протекании термодинамического процесса тела, участвующие в этом процессе, обмениваются между собой энергией. В результате энергия одних тел увеличивается, а других – уменьшается. Передача энергии в процессе от одного тела к другому может происходить двумя способами. Первый способ передачи энергии реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел. При этом энергия передается от более нагретого тела к менее нагретому, т. е. от тела, имеющего большую среднюю кинетическую энергию молекул, к телу, с меньшей средней кинетической энергией молекул. Количество энергии, переданной первым способом от одного тела к другому, называют количеством теплоты, а сам способ – передачей энергии в форме теплоты. Количество энергии, полученное телом в форме теплоты, будем в дальнейшем называть подведенной (сообщенной) теплотой, а количество энергии, отданное телом в форме теплоты, – отведенной (отнятой) теплотой.
Теплота, так же как и любая энергия, измеряется в джоулях или килоджоулях. Принято обозначать произвольное количество теплоты через Q, а удельное (отнесенное к 1 кг) – через q. Подведенная теплота считается положительной, отведенная – отрицательной. Второй способ передачи энергии связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объем под действием внешнего давления. Иначе говоря, передача энергии в этом случае происходит при условии перемещения всего тела или его части в пространстве. Этот способ называется передачей энергии в форме работы, а количество переданной энергии в процессе – работой. Количество энергии, полученное телом в форме работы, будем называть далее совершенной над телом работой, а отданную энергию в форме работы – затраченной телом работой. Работа также измеряется в джоулях или килоджоулях. Затраченная телом работа считается положительной, а совершенная над телом работа – отрицательной. Произвольное количество энергии, переданное в форме работы, обозначают через L, а удельное – через l. В общем случае передача энергии в форме теплоты и в форме работы может происходить одновременно. При этом важно отметить, что в различных термодинамических процессах в зависимости от условий их протекания количество теплоты и работы будет различно. Следовательно, теплота и работа характеризуют качественно и количественно две различные формы передачи движения от одних тел материального мира к другим. Работа представляет собой макрофизическую форму передачи энергии, а теплота есть совокупность микрофизических процессов, поскольку передача энергии этим способом происходит на молекулярном уровне без видимого движения тел. Количества теплоты и работы являются мерами энергии, переданной телам в форме работы и в форме теплоты.
Количество теплоты, полученное телом, и работа, произведенная телом, зависят от условий перехода тела из начального в конечное состояние, т. е. зависят от характера процесса.
СМЕСЬ ИДЕАЛЬНЫХ ГАЗОВ
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Внутренняя энергия Под внутренней энергией газа понимается вся энергия, заключенная в теле или системе тел. Эту энергию можно представить в виде суммы отдельных видов энергий: кинетической энергии молекул, включающей энергию поступательного и вращательного движения молекул, а также колебательного движения атомов в самой молекуле; энергии, электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами; потенциальной энергии или энергии положения молекул в каком-либо внешнем поле сил; энергии электромагнитного излучения. Полная внутренняя энергия тела равна
где В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии. Поэтому в понятие внутренней энергии будем в дальнейшем включать для идеальных газов кинетическую энергию движения молекул и энергию колебательных движений атомов в молекуле, а для реальных газов еще дополнительно и потенциальную составляющую энергии, связанную с наличием сил взаимодействия между молекулами и зависящую от расстояния между ними. Отсчет внутренней энергии при этом может производиться от любого условного нуля. Так, например, для идеальных газов принято считать внутреннюю энергию при t0=0° C равной нулю. Внутренняя энергия данной массы газа U измеряется в кДж, а 1 кг газа (удельная внутренняя энергия) u = U/ M – в кДж/кг. Из закона сохранения энергии следует, что термодинамическая система в каждом своем состоянии может иметь только одно значение внутренней энергии. Изменение внутренней энергии газа не будет зависеть от характера или пути процесса, полностью определяясь заданными начальным и конечным его состояниями. Следовательно, внутренняя энергия, являясь параметром состояния, представляет собой одновременно однозначную непрерывную и конечную функцию состояния системы.
Энтальпия В позапрошлом столетии известный физик Томас Гиббс ввел в практику тепловых расчетов новую функцию, которую назвал энтальпией. Удельная энтальпия, т. е. энтальпия, отнесенная к 1 кг, обозначается буквой
Поскольку входящие в энтальпию величины
Энтальпия идеального газа так же, как и внутренняя энергия, является функцией только температуры и не зависит от других параметров. Если в качестве независимых параметров выбрать давление
Отсюда
или
Интеграл При
Дифференциал энтальпии
т.е энтальпия – “теплосодержание”.
Рис. 4.3
Физический смысл энтальпии будет понятен из рассмотрения следующего примера. На перемещающийся поршень в цилиндре с 1 кг газа помещена гиря массой
Произведение
Произведение давления на объем есть работа, которую надо затратить, чтобы ввести газ объемом Если рассматривать газ, находящийся в цилиндре, и поршень с грузом как одну систему, которую будем называть расширенной системой, то полная энергия
Отсюда видно, что энтальпия Значения энтальпии для паров, газов, газовых смесей приводятся в технической и справочной литературе. При t0=0 °C величину энтальпии i0 принимают равной нулю. Энтальпия имеет большое значение и применение при расчётах тепловых машин, холодильных и калориферных установок и позволяет значительно упростить тепловые расчёты. Она позволяет применять графические методы при исследовании различных термодинамических поцессов и циклов (например is – и id – диаграммы для водяного пара и влажного воздуха).
Аналитические выражения для теплоемкостей с υ и ср Как указывалось, теплоемкости зависят от характера процесса.
равная отношению количества теплоты dqv в процессе при постоянном объеме к изменению температуры dT тела, и теплоемкость при постоянном давлении
равная отношению количества теплоты dqp в процессе при постоянном давлении к изменению температуры dT тела. Из уравнения (5.4) следует, что в процессе при υ=const, в котором тело не совершает внешней работы, вся теплота, сообщаемая телу, идет на изменение его внутренней энергии:
или при cυ = const
Изменение внутренней энергии идеального газа равно произведению теплоемкости сv при постоянном объеме на разность температур тела в любом процессе. Дифференцируя уравнение I закона термодинамики по температуре при p=const и применяя уравнение Клайперона, получим для идеального газа:
Это уравнение носит название уравнения Майера. Оно может быть записано и для 1 кмоль:
Следовательно, для идеальных газов разность между μср и μсυ есть Для приближенных расчетов при не очень высоких температурах можно рекомендовать использование постоянных мольных теплоемкостей μСυ и μCр, полученных с некоторой корректировкой для трех- и многоатомных газов на основании молекулярно-кинетической теории теплоемкости. Эти данные приведены в табл. 5.1. Точные значения теплоемкостей идеальных газов в зависимости температуры приводятся в специальных таблицах. Таблица 5.1.
Энтропия.
Разделив обе части уравнения первого закона термодинамики на Т, получим:
Отсюда выражение dq/T при обратимом изменении состояния газа есть полный дифференциал некоторой функции переменных Т и υ (сυ зависит только от температуры, а R— величина постоянная). Клаузиус назвал эту функцию энтропией и обозначил буквой S. Измеряется полная энтропия S в джоулях на градус (Дж/град), а удельная энтропия s — в джоулях на килограмм на градус [Дж/(кг · град)]. Таким образом, дифференциал энтропии для обратимого изменения состояния определяется как
Энтропия есть однозначная функция состояния газа, принимающая для каждого его состояния вполне определенное значение. Энтропия может быть определена как функция основных параметров состояния:
Величина дифференциальа энтропии как функции Т и υ определяется уравнением:
Интегрируя при сυ = const найдем для идеального газа
В случае когда энтропия является функцией p и T, полуаем:
Интегрируя при ср = const, находим
При условии s=f (p,υ), будем иметь
Интегрируя, определяем
Тепловая Т s-диаграмма
то на Тs-диаграмме площадь 1234, ограниченная линией процесса, крайними ординатами и осью s, в некотором масштабе изображает теплоту, участвующую в процессе. Из уравнения dq = Тds следует, что dq и ds имеют одинаковые знаки. Если в процессе энтропия s увеличивается, то теплота к газу подводится. Если энтропия s уменьшается, то это указывает на отвод теплоты от рабочего тела. Для идеальных газов условно принято считать энтропию равной нулю при нормальных физических условиях.
ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ ИДЕАЛЬНЫХ ГАЗОВ 6.1. Основные определения
Первый закон термодинамики устанавливает взаимосвязь между количеством теплоты, изменением внутренней энергии и внешней работой газа, причем количество теплоты, подводимое к телу или отводимое от него, зависит от характера процесса. К основным процессам, имеющим большое значение, как для теоретических исследований, так и для практических работ в технике, относятся: изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермный, протекающий при постоянной температуре; адиабатный, протекающий при отсутствии теплообмена с внешней средой. Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными и характеризуются постоянством теплоемкости в процессе. Изохорный процесс
Процесс, протекающий при постоянном объеме, называют изохорным (dυ = 0, или υ = const). Кривая процесса называется изохорой. На рис. 6.1 представлен график процесса.
Внешняя работа газа при υ=const равна нулю, так как dυ = 0, т.е. l=0. Основное уравнение первого закона термодинамики (4.6) при d l = 0 принимает вид
dqυ = duυ = cυdt.
Количество теплоты, участвующее в процессе при постоянной теплоемкости, равно
Вся внешняя теплота расходуется только на изменение внутренней энергии тела. Если процесс 1-2, осуществляется с увеличением давления, теплота в нём подводится, при этом увеличивается внутренняя энергия и температура. Если давление газа в процессе понижается, то теплота отводится, уменьшается внутренняя энергия и температура (рис.6.1) Изменение энтропии в изохорном процессе определяем из уравнения (5.21):
но при υ=const ln υ2/υ1=0, поэтому изменение энтропии при постоянной теплоемкости равно
Как видно из данного уравнения, изохора на Тs-диаграмме представляет собой логарифмическую кривую.
Изобарный процесс
Рис. 6.2
Процесс, протекающий при постоянном давлении, называют изобарным (dр = 0, или р = const). Кривая процесса называется изобарой. На рис. 6.2 изображен график процесса. Из уравнения состояния идеального газа для изобарного процесса находим
В соответствии с з аконом Гей-Люссака, в изобарном процессе объемы одного и того же количества газа изменяются прямо пропорционально абсолютным температурам:
При расширении газа его температура возрастает, при сжатии — уменьшается. Удельная работа изменения объема при этом выражается следующим уравнением: или
Основное уравнение первого закона термодинамики при р=const (dр=0) имеет вид
Следовательно, количество теплоты, сообщенное телу в изобарном процессе при постоянной теплоемкости, равно
при переменной теплоемкости
Для обратимого изобарного процесса при постоянной теплоемкости изменение энтропии находится по уравнению (5.23):
но при р = const lnp2/p1=0, поэтому
Изобара на Тs-диаграмме также, как и изохора, изображается логарифмической кривой. Площадь под изобарой в некотором масштабе изображает количество теплоты qр, сообщаемое газу, равное изменению энтальпии i 2- i 1. Из сопоставления уравнений (6.3) и (6.9) следует, что в случае осуществления изохорного и изобарного процессов в одном интервале температур возрастание энтропии будет больше в изобарном процессе, так как ср всегда больше сυ. Изобары являются более пологими кривыми, чем изохоры (см. рис. 6.3).
Рис. 6.3
Изотермный процесс
Процесс, протекающий при постоянной температуре, называют изотермным (Т = const, или dТ = 0). Кривая процесса называется изотермой (рис. 6.4). Для изотермного процесса
На рυ-диаграмме изотермный процесс представляет собой равнобокую гиперболу.
Количество подведенной к идеальному газу теплоты численно равно работе изменения объема. Зная уравнение изотермного процесса для идеального газа, и применяя уравнение состояния, определим удельную работу газа.
Энтальпия и внутренняя энергия идеального газа не меняются, Изотермный процесс на Ts-диаграмме изображается горизонтальной прямой, параллельной оси абсцисс. Для определения изменения энтропии следует воспользоваться уравнениями (5.21) и (5.23) при T=const, после чего плучаем:
Теплота, участвующая в изотермном процессе, равна произведению изменения энтропии (s2 – s1) на абсолютную температуру Т:
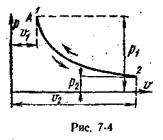
Адиабатный процесс
Процесс, протекающий без подвода и отвода теплоты, т. е. при отсутствии теплообмена рабочего тела с окружающей средой, называют адиабатным, а кривая этого процесса называется адиабатой. Для получения адиабатного процесса необходимым и обязательным условием является dq = 0 и, следовательно, q= 0. Обратимый адиабатный процесс можно осуществить в цилиндре с абсолютно нетеплопроводными стенками при бесконечно медленном перемещении поршня. Уравнение адиабаты выводится на основе уравнения первого закона термодинамики и имеет вид:
pυ k= const. (6.14)
При адиабатном процессе произведение давления на объем газа в степени k есть величина постоянная. Величину k называют показателем адиабаты. Показатель адиабаты k= cp/ cυ (см. раздел5.5). В соответствии с уравнением (6.14) адиабата в pυ – диаграмме графически изображена неравнобокой гиперболой АВ (см. рис. 6.5, а). Рассмотрим зависимость между основными параметрами в адиабатном процессе. Из уравнения адиабаты следует, что
Зависимость между температурой, объёмом и давлением газа в процессе выражается соотношением:
Уравнение первого закона термодинамики для адиабатного процесса принимает вид:
или
l = u1 – u2. (6.17)
Это значит, что работа изменения объема в адиабатном процессе получается за счет убыли внутренней энергии тела;
Если газ расширяется, то его внутренняя энергия и температура убывают; если газ сжимается, то его внутренняя энергия и температура возрастают. Работу газа также можно определить из следующих соотношений:
или
Графически внешняя работа изображается на рυ-диаграмме пл. 12v2v1 (рис. 6.5, а). Из рис. 6.5 видно, что поскольку в уравнении адиабаты k > 1, она на рυ-диаграмме идет круче, чем изотерма. Для обратимого адиабатного процесса dq =0, поэтому
ds = dq/T = 0 и s2-s1 = const,
т. е. обратимый адиабатный процесс является одновременно изоэнтропным (или при постоянной энтропии) и изображается в Тs-диаграмме вертикальной прямой 1 – 2, параллельной оси ординат (см. рис. 6.5, б).
Рис. 6.5
Политропные процессы
Условились всякий процесс идеального газа, в котором теплоемкость является постоянной величиной, называть политропным процессом, а линию процесса — политропой. Из определения политропного процесса следует, что основные термодинамические процессы — изохорный, изобарный, изотермический и адиабатный, если они протекают при постоянной теплоемкости, являются частными случаями политропного процесса. Теплоемкость политропного процесса сn может принимать самые разнообразные положительные и отрицательные значения от + ∞ до - ∞. В результате преобразования аналитических выражений первого закона термодинамики получаем выражение:
Полученное уравнение является уравнением политропного процесса. Величина n в уравнении (6.21) называется показателем политропы; он равен
Показатель политропы n принимает для каждого процесса определенное числовое значение. Для основных процессов: изохорных n=±∞, изобарных n = 0, изотермных n = 1 и адиабатных n = k.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 145; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.229.253 (0.271 с.) |
|||||||||||||||||||||||||||
 ,
, – внутренняя кинетическая энергия молекул;
– внутренняя кинетическая энергия молекул; 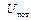 – внутренняя потенциальная энергия молекул.
– внутренняя потенциальная энергия молекул.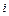 и измеряется в килоджоулях на килограмм (кДж/кг); она представляет собой, по определению, сложную функцию вида
и измеряется в килоджоулях на килограмм (кДж/кг); она представляет собой, по определению, сложную функцию вида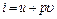 . (4.7)
. (4.7)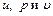 являются параметрами (функциями) состояния, следовательно, и сама энтальпия будет также параметром (функцией) состояния.
являются параметрами (функциями) состояния, следовательно, и сама энтальпия будет также параметром (функцией) состояния.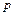 и температуру
и температуру 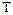 , то можно получить другой вид аналитического выражения первого закона термодинамики:
, то можно получить другой вид аналитического выражения первого закона термодинамики: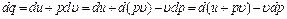 .
.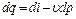 , (4.8)
, (4.8)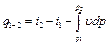 . (4.9)
. (4.9)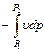 представляет собой чисто математическую величину и приобретает конкретное физическое содержание лишь при рассмотрении процессов истечения рабочего тела (см. разд. 10).
представляет собой чисто математическую величину и приобретает конкретное физическое содержание лишь при рассмотрении процессов истечения рабочего тела (см. разд. 10).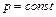 уравнение (4.8) превращается в
уравнение (4.8) превращается в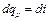 . (4.10)
. (4.10)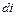 есть элементарное количество теплоты, участвующее в процессе при постоянном давлении. Вся теплота в процессе при постоянном давлении расходуется на изменение энтальпии:
есть элементарное количество теплоты, участвующее в процессе при постоянном давлении. Вся теплота в процессе при постоянном давлении расходуется на изменение энтальпии: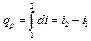 , (4.11)
, (4.11)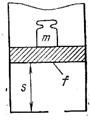
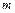 кг (рис. 4.3). Площадь поршня
кг (рис. 4.3). Площадь поршня 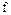 , внутренняя энергия рабочего тела
, внутренняя энергия рабочего тела 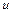 . Потенциальная энергия гири равна произведению массы гири
. Потенциальная энергия гири равна произведению массы гири 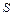 . Так как давление газа
. Так как давление газа 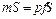 .
.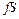 есть удельный объем газа. Отсюда
есть удельный объем газа. Отсюда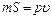 .
.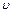 во внешнюю среду с давлением
во внешнюю среду с давлением 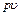 есть потенциальная энергия газа, зависящая от сил, действующих на поршень. Чем больше эти внешние силы, тем больше давление
есть потенциальная энергия газа, зависящая от сил, действующих на поршень. Чем больше эти внешние силы, тем больше давление 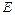 этой системы складывается из внутренней энергии газа u и потенциальной энергии поршня с грузом, равной
этой системы складывается из внутренней энергии газа u и потенциальной энергии поршня с грузом, равной 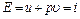 . (4.12)
. (4.12)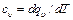 , (5.4)
, (5.4)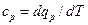 , (5.5)
, (5.5)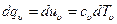 , (5.6)
, (5.6)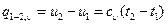 .
.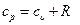 и
и 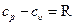 . (5.7)
. (5.7)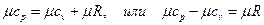 (5.8)
(5.8)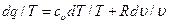 . (5.18)
. (5.18)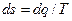 . (5.19)
. (5.19)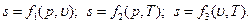
 . (5.20)
. (5.20)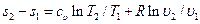 . (5.21)
. (5.21)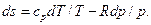 (5.22)
(5.22)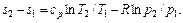 (5.23)
(5.23) (5.24)
(5.24) (5.25)
(5.25) Энтропию можно применять совместно с одним из основных параметров для графического изображения процессов. Удобнее всего энтропию сочетать с абсолютной температурой Т. Если энтропию s откладывать по оси абсцисс, а абсолютную температуру—по оси ординат, то получаем координатную систему: Т s, т.е. Ts-диаграмму, где состояние газа графически изобразится точкой, а процесс — в виде кривой, уравнение которой можно представить как Т = f(s). Элементарная теплота процесса dq= Тds изобразится на диаграмме элементарной площадкой, высота которой равна Т, а основание ds (рис. 5.2). Поскольку количество тепла, подводимого в этом процессе
Энтропию можно применять совместно с одним из основных параметров для графического изображения процессов. Удобнее всего энтропию сочетать с абсолютной температурой Т. Если энтропию s откладывать по оси абсцисс, а абсолютную температуру—по оси ординат, то получаем координатную систему: Т s, т.е. Ts-диаграмму, где состояние газа графически изобразится точкой, а процесс — в виде кривой, уравнение которой можно представить как Т = f(s). Элементарная теплота процесса dq= Тds изобразится на диаграмме элементарной площадкой, высота которой равна Т, а основание ds (рис. 5.2). Поскольку количество тепла, подводимого в этом процессе , (5.26)
, (5.26) Согласно закону Шарля, при постоянном объеме давление газа изменяется прямо пропорционально абсолютным температурам:
Согласно закону Шарля, при постоянном объеме давление газа изменяется прямо пропорционально абсолютным температурам: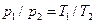 . (6.1)
. (6.1)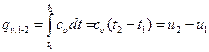 . (6.2)
. (6.2) . (6.3)
. (6.3)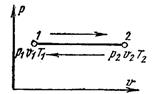
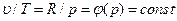
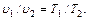 (6.4)
(6.4)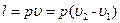 , (6.5)
, (6.5)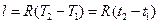 . (6.6)
. (6.6) .
.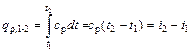 ; (6.7)
; (6.7) . (6.8)
. (6.8)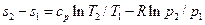 ,
,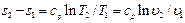 . (6.9)
. (6.9)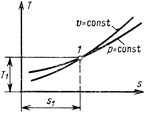
 объем газа изменяется обратно пропорционально его давлению (закон Бойля — Мариотта):
объем газа изменяется обратно пропорционально его давлению (закон Бойля — Мариотта): . (6.10)
. (6.10)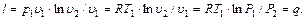 (6.11)
(6.11)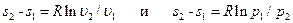 . (6.12)
. (6.12)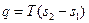 . (6.13)
. (6.13)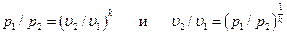 . (6.15)
. (6.15)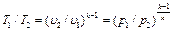 . (6.16)
. (6.16)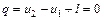
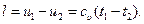 (6.18)
(6.18)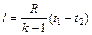 (6.19)
(6.19)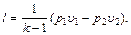 (6.20)
(6.20)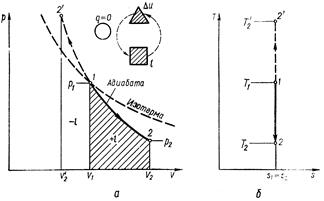
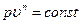 . (6.21)
. (6.21)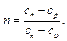 (6.22)
(6.22)


