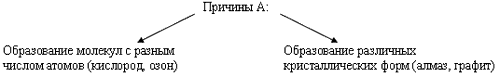Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
Вопрос 2.Зависимость свойств галогенов от их положения в Периодической системе. Общая характеристика элементов Галогены — элементы VIIA группы периодической системы: фторF, хлорCl, бромBr, иодI и астатAt. Астат является радиоактивным элементом и встречается в природе редко.
Все галогены относятся к неметаллам. В атомах галогенов на внешнем энергетическом уровне находится по 7 электронов: F +9)2)7 Cl +17)2)8)7 Br +35)2)8)18)7 I +53)2)8)18)18)7 Валентные электроны галогенов образуют три электронные пары, а один электрон внешнего энергетического уровня остаётся неспаренным. С возрастанием порядкового номера от фтора к иоду увеличиваются радиусы атомов, снижается их электроотрицательность. Значит, неметаллические свойства галогенов по группе сверху вниз ослабеваю т. До завершения внешнего электронного слоя атомам галогенов не хватает только одного электрона, поэтому им наиболее характерна степень окисления –1. У фтор а электроотрицательность больше, чем у остальных элементов, и поэтому степень окисления –1 — его единственная возможная степень окисления в соединениях. Атомы других галогенов способны также и отдавать валентные электроны, проявляя при этом положительные степени окисления +1, +3, +5, +7. Так, положительные степени окисления атомы хлора проявляют в соединениях с более электроотрицательными фтором, кислородом и азотом. Галогены образуют с металлами соединения с ионной связью, а с другими неметаллами — соединения с ковалентной полярной связью.
Общая характеристика простых веществ Атомы галогенов соединяются попарно и образуют двухатомные молекулы: F2, Cl2, Br2, I2. Связь в молекулах ковалентная неполярная, одинарная. Кристаллическая решётка — молекулярная. Поэтому у галогенов невысокие температуры кипения и плавления.
При обычных условиях фтор представляет собой светло-жёлтый газ, хлор — жёлто-зелёный газ, бром — красно-коричневую жидкость, иод — тёмно-фиолетовые кристаллы.
Фтор Хлор Бром
Иод
Твёрдый иод при нагревании легко возгоняется (переходит в газообразное состояние и обратно в твёрдое, не превращаясь в жидкость).
Возгонка иода У всех галогенов — резкий неприятный запах, и они очень токсичны. В ряду галогенов с увеличением относительной молекулярной массы возрастают температуры кипения и плавления, увеличивается плотность, более интенсивной становится окраска. В воде галогены растворяются слабо. Фтор с водой вступает в химическую реакцию и вытесняет из неё кислород:
2F2+2H2O=4HF+O2↑.
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 355; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.174.174 (0.005 с.) |