
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействий в растворе электролита
Структура раствора электролита в общем случае связывается с наличием в растворе сольватированных ионов. Частным случаем сольватации является гидратация - взаимодействие ионов электролита с водой. Характер этого взаимодействия определяется, прежде всего, факторами: · электростатическим взаимодействием диполей воды и иона; · образованием водородных связей между отдельными молекулами воды; · интенсивностью теплового движения. Суммарное действие этих факторов приводит к тому, что структура водной оболочки вокруг иона меняется с расстоянием от иона. Обычно выделяют несколько слоев воды, различающихся структурой. К иону примыкает область первичной гидратации, где молекулы воды чрезвычайно прочно связаны с ионами электростатическими силами и фактически могут считаться фиксированными. Ионная гидратация в этой зоне характеризуется, прежде всего, координацией молекул воды вокруг иона с образованием в ближнем окружении химических связей. Схематично гидратацию иона можно показать на следующей схеме (рис. 6.3).
Рис. 6.3. Схема гидратации иона Природа связей может быть самой различной. Нередко ионы образуют вместе с растворителем комплексные соединения с ковалентными связями. В этом случае понятия гидратации и комплексообразования неразделимы. Следует отметить, что при ионной гидратации не происходит разрыва химических связей в ионах растворяемого вещества и молекулах воды, но могут образовываться ассоциаты и агрегаты. Вместе с тем из понятия ионной гидратации автоматически исключается ряд сопутствующих ей процессов, например, гидролиз. Область первичной гидратации граничит с пространством, заполненным частично деструктурированной водой. В этой зоне существенно возрастает роль теплового движения молекул воды. Дальше от иона располагается область, обычной воды, где сохраняется ее первоначальная структура. В достаточно концентрированных системах сольватированные ионы взаимодействуют и образуются ионные ассоциаты - нейтральные или заряженные частицы. В ассоциатах ионы удерживаются слабыми силами электростатического притяжения, а также силами межмолекулярного взаимодействия, которые возникают между молекулами растворителя входящими в сольватные оболочки разных ионов. Поэтому процессы сольватации и ассоциирования в растворах электролитов – это звенья одной цепи. Например, растворение 1,1 – валентного электролита МА в растворителе L можно представить следующими стадиями:
1) поверхностная сольватация: МА + n L =MAL n; (6.6) 2) переход частично сольватированных ионов в раствор, завершение сольватации ионов: MAL n + m L = ML x + + AL y - ; (6.7) 3) образование ассоциатов[7] (двойников - ML x +AL y -, тройников - ML x +AL y -ML x +, квадруполей - ML x +AL y -ML x +AL y - и т.д.): ML x + + ALy- = ML x +AL y - ML x +AL y - + ML x + = ML x +AL y -ML x + (6.8) ML x +AL y - + ML x +AL y - = ML x +AL y -ML x +AL y - . Как видно из рассмотренной схемы, ассоциаты образуются из сольватированных ионов. Поэтому они могут быть заряженными или незаряженными. Число ионов, образующих ассоциат, возрастает с увеличением концентрации раствора. Ассоциирование ионов приводит к тому, что эффективная концентрация ионов в растворе, называемая активностью, оказывается меньше аналитической. Это обстоятельство часто определяет механизмы многих физико- химических процессов в растворах электролитов. Например, как будет показано в разделе 8.4, падение удельной электропроводности с увеличением концентрации растворяемого вещества нельзя объяснить с позиций, не учитывающих ассоциирование ионов. Правило ионной силы Способ учесть всю гамму взаимодействий в растворе нашел Дж. Н. Льюис. Он сформулировал правило ионной силы: в разбавленных растворах коэффициент активности сильного электролита одинаков для всех растворов одной и той же ионной силы. Ионная сила [†] раствора электролита (I с) выражается через полусумму произведения концентрации (с i) каждого из присутствующих в растворе ионов на квадрат заряда zi этого иона, т.е.:
В соответствии с этим правиломактивность отдельных ионов можно рассчитать по формулам: а + = у + × с +; а - = у - × с -, (6.10) где: с + и с - - концентрации катиона и аниона, выраженные в моль/л,[8] а у + и у -- соответствующие этим ионам коэффициенты активности, которые можно рассчитать по формулам, включающим ионную силу раствора.
Ниже приведена методика расчета ионной силы на примере раствора, содержащего 1М С6Н12О6,, 0,01 М СН3СООН, 0,10 М СН3СОOK, а также 0,20 М СаС12. Учитывается, что в общем случае концентрации отдельных ионов равны произведению аналитической концентрации электролита на число ионов образующихся при диссоциации молекулы, по уравнению: М l А m = l M m + + m A l -. Решение. Известно, что сахар С6Н12О6 на ионы не распадается, а диссоциация уксусной кислоты ничтожно мала. Поэтому можно принять, что в приведенных условиях ионная сила зависит только от концентрации ионов, получающихся при растворении СН3СОOK и СаС12: с (К+) = 0,1 М, с (С1-) =2·0,2=0,4 М, с (СН3СОО-) = 0,1 М, с (Са2+) =0,2 М. В итоге имеем I = 1/2 × (0,1×12 + 0,4×12 + 0,1×12+0,2×22) = 0,7 M. Вычисления усложняются в случаях, если необходимо учесть действительную степень диссоциации слабого электролита. Коэффициент активности (yi) для отдельного иона i врастворе ионная сила которого не превышает 0,1 можно найти по формуле Дебая и Хюккеля:
где A и B – константы, зависящие от свойств растворителя и температуры раствора. (для воды при 298 К они соответственно равны 0,509 и 0,328); z -заряд иона; I с - ионная сила раствора; d - параметр, соответствующий диаметру гидратированного иона (табл.6.1). Таблица 6.1. Значения параметра d для различных ионов [31]
Формула (6.11) для расчета коэффициента активности отдельного иона имеет сугубо теоретическую ценность, и ее проблематично использовать для практических расчетов, поскольку в растворе одновременно присутствуют разнозаряженные ионы растворенного вещества. Поэтому вводят понятия средней ионной активности и среднего коэффициента активности. Среднюю активность электролита а ± оценивают исходя из общей активности электролита
где l и m - соответственно число положительных и отрицательных ионов, Подставляя выражения для активностей отдельных ионов из (6.9) в (6.12) получим a ± = = у ± с ±; a = a ±( l + m ), где у ± и × с ± - средний ионный коэффициент активности[9] и средняя ионная концентрация соответственно. В этом случае формулу Дебая и Хюккеля (6.11) следует переписать следующим образом:
Формула Дебая и Хюккеля дает удовлетворительные результаты для растворов ионной силы до 0,1М. Для интервала от 0,1 М до 1 М расчет часто выполняют по формуле Дэви
В случае разбавленных растворов можно принять, что lg y ±= Формула (6.15) представляет предельный закон Дебая и Хюккеля. Ее часто используют для грубых оценок коэффициентов активности. Контрольное задание 21 Выберите и обоснуйте правильное утверждение.
21.1. При смешивании равных объемов 2 моль/л растворов сахара и хлористого калия значение ионной силы раствора становится равным (моль/л): а) 0,5; б) 1,0; в) 2,0. 21.2. Увеличение ионной силы раствора электролита способствует образованию: а) сольватов; б) ассоциатов; в) не влияет на характер взаимодействий в растворе. Гидролиз солей
Гидролиз электролитов[10] можно определить как взаимодействие с водой ионов растворяемой соли с образованием слабодиссоциирующей кислоты или основания, а иногда слабодиссоц иирующих кислоты и основания одновременно. Важнейшим следствием гидролиза по одному из ионов соли является изменение рН раствора. Этот признак может отсутствовать при одновременном гидролизе по аниону и катиону. Поэтому его нельзя считать достаточным для доказательства отсутствия гидролиза. Другой характерный признак гидролиза - сжатие раствора, которое вызывается уплотнением растворителя вокруг ионов, подвергающихся гидролизу и приводит к существенному изменению структуры растворителя, а нередко и самих ионов, Механизм гидролиза включает две стадии: 1) диссоциацию молекул растворяемого электролита на ионы; 2) взаимодействие ионов с водой (протолиз). Первая стадия по сути представляет собой растворение вещества в воде. Эта стадия описана ранее. Здесь же акцент будет сделан на стадии протолиза, которая определяет характер гидролиза в целом. Без учета эффекта гидратации для бинарной соли 1,1 – валентного электролита типа МеА отдельные стадии гидролиза можно для различных случаев записать следующим образом: 1) диссоциация молекул электролита: МеА = Ме+ + Аˉ; 2) протолиз (взаимодействие ионов с водой). Таблица 6.2
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-17; просмотров: 154; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.114.125 (0.031 с.) |

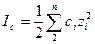 . (6.9)
. (6.9)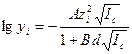 , (6.11)
, (6.11)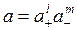 по формуле:
по формуле: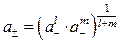 , (6.12)
, (6.12)  . (6.13)
. (6.13) (6.14)
(6.14) . Поэтому формула Дебая и Хюккеля становится проще. Учитывая (например для бинарных 1-1 – электролитов), что Ic = c,можно получить:
. Поэтому формула Дебая и Хюккеля становится проще. Учитывая (например для бинарных 1-1 – электролитов), что Ic = c,можно получить: (6.15)
(6.15)


