Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реанимация и интенсивная терапия у детейСтр 1 из 13Следующая ⇒
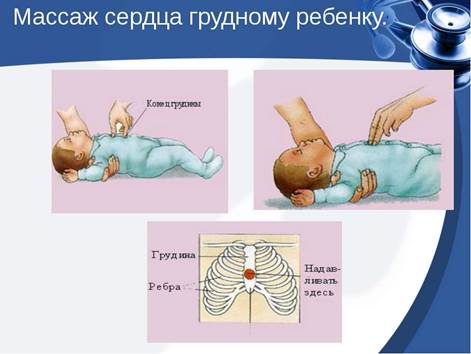
Реанимация и интенсивная терапия у детей Базовый реанимационный комплекс у детей. Последовательность действий. ОСОБЕННОСТИ СЕРДЕЧНО-ЛЕГОЧНОЙ РЕАНИМАЦИИ У ДЕТЕЙ В детском возрасте более частой причиной клинической смерти является асфиксия. Поэтому этой категории пациентов особенно важно проводить весь комплекс реанимационных мер — и наружный массаж сердца, и искусственное дыхание. Обратите внимание: если взрослого человека допускается оставить на очень короткое время для того, чтобы позвать на помощь, то ребенку сначала надо в течение двух минут проводить СЛР, и лишь после этого можно отлучиться на несколько секунд. Проводить нажатия грудной клетки у ребенка следует с той же частотой и амплитудой, что и у взрослых. В зависимости от его возраста нажимать можно двумя или одной рукой. У грудничков эффективен метод, при котором грудную клетку малыша обхватывают обеими ладонями, помещая большие пальцы на середину грудины, а остальные плотно прижимают к бокам и спинке. Нажатия производят большими пальцами.
Соотношение нажатий и дыхательных движений у детей может быть либо 30:2, либо если реаниматоров двое — 15:2. У новорожденных соотношение составляет 3 нажатия на одно дыхательное движение. Одним из наиболее важных элементов базовой сердечно-легочной реанимации у детей является своевременная и максимально ранняя диагностика остановки кровообращения или ее предвестников, что является залогом успеха реанимационных меропри- ятий. Необходимо подчеркнуть, что отсутствие пульса на периферических или магистральных артериях при его пальпации в течение 10 сек не является надежным критерием неадекватной циркуляции, поэтому необходимо ориентироваться на другие признаки жизни: Наличие реакции на окружающее (уровень сознания) Наличие спонтанного адекватного дыхания (редкое дыхание или любой тип патологического дыхания является абсолютным показанием для проведения СЛР) Наличие спонтанной двигательной реакции. Перед началом проведения СЛР необходимо убедиться в безопасности ситуации для спасателя. При подозрении на критическое состояние или остановку кровообращения первым элементом диагностики является обращение к ребенку (с учетом его возраста) с вопросом: «У тебя все в порядке?». Если пациент не отвечает на вопрос и сознание отсутствует, дыхание отсутствует или патологическое, СЛР должна быть начата незамедлительно, при этом основное внимание должно быть уделено одновременному обеспечению проходимости дыхательных путей и оксигенации ребенка, вместе с про-
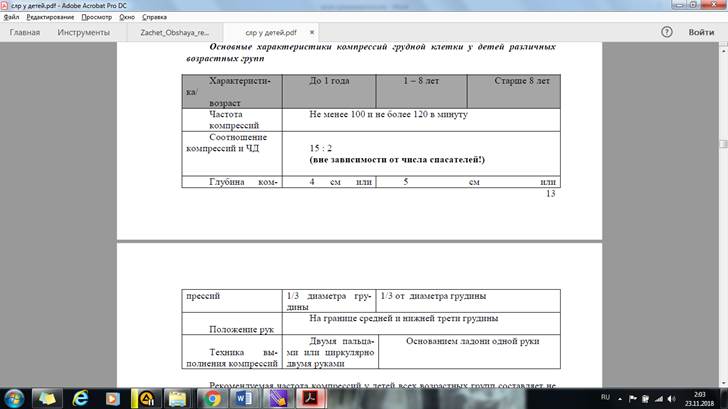
ведением КГК (Класс I, LOE С), хотя в оптимальном варианте необходимо параллельно проводить и искусственную вентиляцию легких (Класс I, LOEB). Базовую СЛР у детей начинают с 5 искусственных вдохов, после чего снова проверяют признаки жизни. Если они отсутствуют (нет сознания, нет дыхания, нет пульса на магистральных сосудах) – начинают компрессии грудной клетки. Восстановление кровообращения Сразу после выявления остановки кровообращения должны быть начаты КГК. Симптомы, свидетельствующие о внезапной остановке сердца и время их появления, представлено в табл. 5. Таблица 5 Время появления симптомов, при внезапной остановке кровообращения Симптомы Время появления Отсутствие пульса на центральных артериях Немедленно Потеря сознания 10-20 с Диспноэ, остановка дыхания 15-30 с Расширенные, не реагирующие на свет зрачки 60-90 с Компрессии грудной клетки характеризуются частотой, глубиной воздействия и положением рук врача относительно анатомических структур больного, который предварительно должен быть уложен на жесткую поверхность. Основные характеристики, выполнение которых необходимо при выполнении КГК у детей различного возраста представлены в табл. 6 и на рис. 2.
Рекомендуемая частота компрессий у детей всех возрастных групп составляет не менее 100 и не более 120 в 1 минуту. Оптимальная глубина компрессий должна составлять не менее 1/3 от поперечного размера грудной клетки (Класс IIa, LOEC). NB! Не бойтесь совершить глубокую компрессию! Методика ИВЛ При отсутствии дыхания у пациента необходимо проводить КГК в сочетании с ИВЛ в соотношении 15:2 (вне зависимости от числа спасателей!), с соблюдением следующих правил: Длительность одного вдоха должна быть около 1,0-1,5 сек; Следует использовать минимальный дыхательный объем и минимальное
давление в дыхательных путях, позволяющие увидеть экскурсию грудной клетки (Класс I, LOEС); при проведении ИВЛ следует избегать гипервентиляции (Класс III, LOEC); После каждого вдоха следует убедиться в наличии экскурсии грудной клетки; критерием эффективности ИВЛ является экскурсия грудной клетки ребенка во время вдоха. При отсутствии экскурсии грудной клетки ребенка в процессе выпол- 22 А. Воздуховоды Орофарингеальный (ротоглоточный) воздуховод может быть использован у ново- рожденных или детей старшего возраста без сознания, если до этого манипуляции по обеспечению проходимости дыхательных путей (запрокидывание назад головы, выве- дение нижней челюсти) не привели к успеху. Нужно также убедиться в том, что отсут- ствует обструкция дыхательных путей инородным телом. Орофарингеальный воздуховод нельзя использовать у детей в сознании или с не- значительной степенью угнетения сознания, так как он может стимулировать срыгива- ние и рвоту. Противопоказанием для использования воздуховода является наличие кашлевого и рвотного рефлексов. 24 Б. Ларингеальная маска Все ларингеальные маски являются допустимой альтернативой обеспечения про- ходимости и протекции ВДП при СЛР. Новые LMA ProSeal, а также LMA Fastrach обеспечивают высокий дыхательный объём даже при увеличении внутригрудного дав- ления, вызванного постоянной компрессией грудной клетки при СЛР у детей. В. Интубация трахеи Интубация трахеи эндотрахеальной трубкой позволяет обеспечить проходимость дыхательных путей больного, адекватную вентиляцию легких и предупредить попада- ние желудочного содержимого в ДП пациента. Показания для интубации трахеи: Угнетение дыхательного центра ЦНС (брадипноэ, диспноэ, апноэ); Функциональная или анатомическая обструкция дыхательных путей; Утрата/угнетение защитных рефлексов (кашлевой, рвотный); Дыхательная недостаточность III-IV ст. различного генеза; Необходимость в высоком пиковом давлении вдоха; Необходимость защиты дыхательных путей и контроль ИВЛ во время глубокой седации для выполнения диагностических процедур. Потенциальная угроза возникновения любого из вышеперечисленных факторов при транспортировке пациента в условиях ИВЛ лицевой маской. Г. Коникотомия При неэффективности вышеперечисленных методов для обеспечения проходимо- сти дыхательных путей, включающих в себя прием запрокидывание назад головы и вы- ведение нижней челюсти, использования ротовых и носовых воздуховодов, интубации трахеи/или невозможности ее осуществить - следует использовать коникотомию. Раз- новидностью коникотомии является коникокрикотомия, или крикотомия – рассечение по средней линии дуги перстневидного хряща. Типа Амбу. ИВЛ мешком типа Амбу позволяет добиться нормальных значений О2 и СО2 ми- нимизировав риск респираторных повреждений. При ИВЛ мешком типа Амбу изначально следует правильно выбрать надлежаще- го размера маску и достаточного объема мешок. Маска должна полностью закрывать рот и нос ребенка не затрагивая глаз и подбородка и обеспечивать герметичность при- легания к мягким тканям лица.
Минимальный объем самораздувающегося мешка для проведения ИВЛ во время СЛР составляет 450–500 мл. 25 Вне зависимости от размера мешка, необходимо ориентироваться на силу его сдавления, результатом которой будет дыхательный объем достаточный для адекватно- го "раздувания" и появления экскурсий грудной клетки. Правильно провести вентиляцию мешком типа Амбу можно используя, так назы- ваемую, технику «Е-С обхвата». Большой и указательный пальцы руки (левой у «прав- шей») принимают форму буквы «С» и используются для плотного прижатия маски к лицу. Оставшимися тремя пальцами этой же руки, принявшими форму буквы «Е», необходимо вывести нижнюю челюсть, подтягивая ее вперед-вверх к маске (рис. 12). Чтобы выполнить вентиляцию маской, используя «технику Е-С обхвата», необхо- димо: встать у изголовья ребенка; если у ребенка нет травмы головы и шеи, запрокиньте его голову назад и положите плоскую подушку или валик ниже головы ребенка или под спину. При Алгоритм использования АНД. 1. Как только на место происшествия доставлен АНД: включить АНД и наложить электроды на грудную клетку пострадавшего. При наличии второго спасателя во время наложения электродов следует продолжать непре- рывные компрессии грудной клетки; далее следовать голосовым и визуальным командам АНД; убедиться, что во время анализа ритма никто не прикасается к пострадавшему – это может нарушить алгоритм анализа ритма; автоматический наружный дефибриллятор проводит автоматизированный ана- лиз ритма пострадавшего по специально разработанному компьютерному алгоритму: ФЖ и ЖТ без пульса распознаются как ритмы, требующие дефибрилляции. если дефибрилляция показана (ФЖ или ЖТ без пульса), убедиться, что никто не прикасается к пострадавшему, и нажать на кнопку (в случае автоматического режи- ма работы АНД нажимать на кнопку не нужно); после нанесения разряда продолжить СЛР в соотношении 15:2 без промедления; также следовать голосовым и визуальным командам АНД; если дефибрилляция не показана, продолжить СЛР в соотношении 15:2 без промедления, следовать голосовым и визуальным командам АНД. 28 АНД может быть использован у детей в возрасте от 1 до 8 лет, у которых отсут- ствуют признаки кровообращения. В настоящее время, количество публикаций об использовании АНД у детей меньше 1 года пока недостаточно для того, чтобы сделать однозначные выводы о воз-
можности его использования в этой возрастной группе, поэтому предпочтительнее ис- пользовать ручные дефибрилляторы (Класс IIB, LOEC). При отсутствии ручных дефибрилляторов с регулятором мощности разряда мож- но использовать АНД без регулятора мощности (Класс IIB, LOEC). Необходимо подчеркнуть, что основой поддержания жизни являются искус- ственное дыхание (ИВЛ) и компрессии грудной клетки, без непрерывного проведения которых, даже наличие дефибриллятора, не обеспечивает эффективности СЛР. Препарат Доза Примечание Адреналин Внутривенно, внутрикостно: 0,01 мг/кг (0,01 мл/кг 1:10000) Эндотрахеально: 0,1 мг/кг (0,1 мл/кг 1:1000)* Максимальная доза: Внутривенно, внутрикостно: 1мг Эндотрахеально: 2,5 мг* Можно повторять каждые 3-5 ми- нут. NB!: Несовместим в одном При асистолии НЕ применяется! Внутривенно, внутрикостно: 0,02 мг/кг Эндотрахеально: 0,04-0,06 мг/кг* При необходимости препарат может быть введен повторно. Максимальная доза: 0,5 мг 1. Максимальный эффект развива- ется через 2-4 минуты после внут- ривенного введения препарата. 2. Более высокие дозы можно ис- пользовать при отравлении фос- форорганическими соединениями. Аденозин Первая доза: 0,1 мг/кг (максимум 6 мг) Вторая доза: 0,2 мг/кг (макси- мум 12мг) 1. Мониторинг ЭКГ 2. Быстрое внутривенное или внутрикостное введение («толч- ком»). 3. Оптимальный вариант введения – в магистральный венозный со- суд, как можно ближе к сердцу. 4. После введения препарата кате- тер необходимо промыть 0,9% раствором хлорида натрия. 5. Время действия аденозина со- ставляет 15 с 6. Период полувыведения - 10 сек Амиодарон Стартовая доза: 5 мг/кг, внут- ривенно, внутрикостно. При необходимости можно по- вторить дважды до 15 мг/кг. 1. Мониторинг ЭКГ и А/Д 2. В случае остановки сердца пре- парат вводится внутривенно, бо- люсно. 30 Вводится только при наличии подтвержденной гипогликемии! Лидокаин Внутривенно, болюсно: 1мг/кг Внутривенно, микроструйно: 20- 50 мкг/кг/мин Обладает меньшей эффективно- стью по сравнению с амиодаро- ном. Сульфат магния Внутривенно, внутрикостно: 25- 50 мг/кг при мерцании желудоч- ков в течение 20 и более минут. Максимальная доза: 2 г Применяется для лечения уста- новленной гипомагниемии или фибрилляции желудочков (поли- морфная желудочковая тахикар- дия с длинным QT интервалом). NB!: При быстром внутривенном введении может привести к разви- тию артериальной гипотонии. Налоксон Менее 5 лет или менее 20 кг: 0,1 мг/кг, внутривенно, внутрикост- но, эндотрахеально*. Более 5 лет или более 20 кг: 2,0 мг, внутривенно, внутрикостно, эндотрахеально*. Для профилактики угнетения ды- хания при использовании опиои- дов необходимо использовать меньшие дозы. Прокаинамид Внутривенно, внутрикостно: 15мг/кг 1. Мониторинг ЭКГ и А/Д 2. Вводить очень медленно (в те- чение 30-60 минут) 3. Необходимо соблюдать осто- рожность при одновременном
назначении с любыми другими 31 препаратами, увеличивающими интервал Q-T. * - вводить в разведенном виде в 5 мл 0,9% раствора хлорида натрия с последу- ющим проведением ИВЛ (не менее 5 вдохов). Рутинное введение препаратов кальция при проведении СЛР в настоящее время не рекомендуется. Назначение кальция во время СЛР может быть показано только Таблица 1 Таблица 2 Алгоритм использования АНД. 1. Как только на место происшествия доставлен АНД: 7. включить АНД и наложить электроды на грудную клетку пострадавшего. При наличии второго спасателя во время наложения электродов следует продолжать непре- рывные компрессии грудной клетки; 8. далее следовать голосовым и визуальным командам АНД; 9. убедиться, что во время анализа ритма никто не прикасается к пострадавшему 3. это может нарушить алгоритм анализа ритма; • автоматический наружный дефибриллятор проводит автоматизированный ана- лиз ритма пострадавшего по специально разработанному компьютерному алгоритму: ФЖ и ЖТ без пульса распознаются как ритмы, требующие дефибрилляции. • если дефибрилляция показана (ФЖ или ЖТ без пульса), убедиться, что никто не прикасается к пострадавшему, и нажать на кнопку (в случае автоматического режи- ма работы АНД нажимать на кнопку не нужно); после нанесения разряда продолжить СЛР в соотношении 15:2 без промедления; также следовать голосовым и визуальным командам АНД; • если дефибрилляция не показана, продолжить СЛР в соотношении 15:2 без промедления, следовать голосовым и визуальным командам АНД.
АНД может быть использован у детей в возрасте от 1 до 8 лет, у которых отсут- ствуют признаки кровообращения. В настоящее время, количество публикаций об использовании АНД у детей меньше 1 года пока недостаточно для того, чтобы сделать однозначные выводы о воз- можности его использования в этой возрастной группе, поэтому предпочтительнее ис- пользовать ручные дефибрилляторы (Класс IIB, LOEC). При отсутствии ручных дефибрилляторов с регулятором мощности разряда мож- но использовать АНД без регулятора мощности (Класс IIB, LOEC). Необходимо подчеркнуть, что основой поддержания жизни являются искус- ственное дыхание (ИВЛ) и компрессии грудной клетки, без непрерывного проведения которых, даже наличие дефибриллятора, не обеспечивает эффективности СЛР. Верхние пути Нос малыша маленького размера, его ходы узкие и короткие, поэтому самый незначительный отек может привести к непроходимости, что затруднит процесс сосания. Строение верхних путей у ребенка:
6. Гортань новорожденного расположена выше, чем у взрослого индивидуума, за счет мышечного каркаса очень подвижна. Имеет вид воронки диаметром в 0,4 см, сужение направлено в сторону голосовых связок. Связки короткие, что объясняет высокий тембр голоса. При небольшом отеке, во время острых респираторных заболеваний, возникают симптомы крупа, стеноза, что характеризуется тяжелым, свистящим дыханием с невозможностью выполнить полноценный вдох. Как следствие происходит развитие гипоксии. Гортанные хрящи закруглены, их заострение у мальчиков совершается к 10–12 годам. 7. Трахея к моменту рождения уже сформирована, располагается на уровне 4-го шейного позвонка, подвижна, в форме воронки, затем приобретает цилиндрический вид. Просвет значительно сужен в отличие от взрослого человека, в ней расположено мало железистых участков. При кашле может сокращаться на треть. Учитывая анатомические особенности, при воспалительных процессах, неизбежно сужение и возникновение лающего кашля, симптомов гипоксии (цианоз, одышка). Каркас трахеи состоит из хрящевых полуколец, мышечных структур, соединительнотканной оболочки. Бифуркация при рождении находится выше, чем у старших детей. Бронхиальное дерево является продолжением бифуркации трахеи, делится на правый и левый бронх. Правый – шире и короче, левый – уже и длиннее. Хорошо развит мерцательный эпителий, продуцирующий физиологическую слизь, очищающую бронхиальный просвет. Слизь ресничками продвигается кнаружи со скоростью до 0,9 см в минуту. Особенностью органов дыхания у детей является слабый кашлевой толчок, из-за плохо развитой мускулатуры торса, незаконченным покрытием миелином нервных волокон десятой пары черепных нервов. Как следствие инфицированная мокрота не отходит, накапливается в просвете бронхов разного калибра и возникает закупорка густым секретом. В структуре бронха есть хрящевые кольца, за исключением конечных отделов, которые состоят только из гладких мышц. При их раздражении может возникать резкое сужение хода – появляется астматическая картина. Легкие представляют собой воздушную ткань, их дифференцировка продолжается до 9-ти летнего возраста, состоят из:
Бронхиолы заканчиваются у малыша мешочком. С ростом ребенка разрастается ткань легкого, мешочки превращаются в альвеолярные грозди, увеличиваются показатели жизненной емкости. Активное развитие с 5 недели жизни. При рождении вес парного органа составляет 60–70 грамм, хорошо кровоснабжается и васкуляризирован лимфой. Таким образом, является полнокровным, а не воздушным как у старшего возраста. Важным моментом является то, что легкие не иннервируются, воспалительные реакции протекают безболезненно, и в таком случае, можно пропустить тяжелое заболевание. Ввиду анатомо-физиологического строения, патологические процессы развиваются в базальных отделах, нередки случаи ателектаза и эмфиземы. Функциональные особенности Особенности функции органов дыхания у детей:
На первом году жизни возникает дыхательная аритмия, что считается нормой, однако ее сохранение и возникновение апноэ после годовалого возраста чревато остановкой дыхания и смертью. Частота дыхательных движений напрямую зависит от возраста малыша – чем моложе, тем чаще осуществляется вдох. ЧДД норма:
8. 9.
МЕТОДЫ ИНТЕНСИВНОЙ ТЕРАПИИ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ Все методы дыхательной терапии у детей можно условно разделить на несколько групп: восстановление и поддержание свободной проходимости дыхательных путей, методы оксигенотерапии и респираторной поддержки. Обеспечение и поддержание свободной проходимости дыхательных путей. Наиболее простой способ восстановления свободной проходимости дыхательных путей – максимальное разгибание головы ребенка в атлантоокципитальном сочленении с одновременным выдвижением вперед нижней челюсти. В результате натяжения тканей между гортанью и нижней челюстью корень языка отходит от задней стенки глотки. Для облегчения разгибания головы под плечи ребенка подкладывают валик. Этот способ обычно используют во время реанимации, при проведении прямой ларингоскопии и интубации трахеи. Для предупреждения западения корня языка используют также ротовые воздуховоды. Воздуховодами пользуются при реанимации или проведении наркоза с сохранением спонтанного дыхания. Анестезиолог должен помнить, что воздуховоды могут провоцировать возникновение рвоты. Большое значение для предупреждения обструкции дыхательных путей имеет положение ребенка в кроватке или кювезе. После операции или наркоза ребенка обычно укладывают горизонтально на бок или живот (Рис. 8.1.). Новорожденных, склонных к срыгиванию, обычно укладывают в кровати с приподнятым головным концом. При пневмониях, бронхитах, ателектазах, когда в трахеобронхиальном дереве большое количество мокроты, полезно периодически укладывать ребенка в дренажное положение (постуральный дренаж). Схемы дренажных положений при различной локализации патологического процесса представлены на рис.8.2. Даже при отсутствии мокроты не следует допускать, чтобы дети длительно находились в каком-либо одном положении, так как это ухудшает вентиляционно-перфузионные отношения в легких и способствует развитию инфекционных осложнений. Перевод ребенка в дренажное положение обычно сочетают с такими процедурами, как вибрационный или перкуссионный массаж, стимулирование кашлевого рефлекса. При вибрационном массаже мокрота перемещается из самых мелких бронхов в более крупные. Массаж осуществляется с помощью вибромассажера по направлению от подмышечных впадин к подмышечной линии. Перкуссионный массаж выполняют путем надавливания или постукивания ребром ладони по участкам грудной клетки, соответствующим дренируемым отделам легкого. Катетеризацию дыхательных путей проводят для отсасывания густой мокроты или аспирационных масс (Рис 8.3.). Катетеризацию рото- и носоглотки обычно выполняют вслепую, а введение катетера в гортань, трахею и бронхи – под контролем ларингоскопа. Аспирацию мокроты выполняют катетером, который присоединяется к отсосу с помощью тройника, закрывая пальцем открытый конец только в момент отсасывания. В противном случае возможно присасывание катетера к слизистой оболочке и ее травмирование. Для аспирации может быть использован любой электрический или инжекционный отсос, создающий максимальное разряжение порядка 50-60 мм рт. ст. Чтобы предотвратить развитие у ребенка гипоксемии необходимо за 2-3 минуты до начала процедуры увеличить концентрацию кислорода в дыхательной смеси на 20-30%. Продолжительность манипуляции не должна превышать 10-15 секунд. Прямая ларингоскопия с катетеризацией трахеи и бронхов у детей обычно выполняется под наркозом. Смещая трахею вправо, катетер проводят в левый бронх, смещая в лево - в правый. Вся процедура аспирации мокроты из трахеобронхиального дерева должна проводиться в асептических условиях. Катетеры и растворы, применяемые для промывания бронхов, должны быть стерильными. Катетер выбирарается в соответствии с возрастом ребенка, важно, чтобы его наружный диаметр составлял не более 2/3 от диаметра главного бронха. Лаваж легких, т.е. промывание трахеобронхиального дерева большим количеством жидкости применяется в таких ситуациях как астматический статус или аспирация желудочного содержимого. Продленная назотрахеальная интубация является одним из самых распространенных методов длительного поддержания свободной проходимости дыхательных путей. Применение современных интубационных трубок позволяет проводить эту методику в течение многих дней и даже недель. Для продленной назотрахеальной интубации у детей обычно используют трубки без манжетки. Интубацию выполняют под наркозом с использованием мышечных релаксантов. Трубку проводят вслепую через один из носовых ходов, а затем под контролем ларингоскопа щипцами Магила направляют в трахею. Удостоверившись, что дыхание одинаково хорошо проводится над всей поверхностью легких, трубку надежно фиксируют полосками лейкопластыря. Успешное ведение больных, находящихся на назотрахеальной интубации, возможно только при самом строгом соблюдении правил асептики, хорошем кондиционировании дыхательной смеси и постоянном контроле проходимости дыхательных путей. Аспирацию мокроты из трубки проводят только по мере необходимости. Необходимо все время помнить, что у ребенка, находящегося на назотрахеальной интубации в любой момент может произойти перегиб трубки или полная ее обтурация, экстубация или соскальзывание трубки в правый бронх. Поэтому кроме постоянного врачебного и сестринского наблюдения необходимо наладить мониторный контроль функции дыхания и сердечной деятельности. Предпочтение следует отдать газоанализаторам, поскольку импедансные датчики могут регистрировать как дыхательные движения судорожные сокращения мыщц грудной клетки при обструкции дыхательных путей. Согревание и увлажнение дыхательной смеси происходит преимущественно в верхних дыхательных путях.Понятно, что у ребенка, который дышит через интубационную трубку или трахеостомическую канюлю, естественные механизмы кондиционирования дыхательных газов резко нарушаются. Поэтому обязательным условием при лечении таких больных является использование специальных устройств (увлажнителей), согревающих и увлажняющих воздушно-кислородную смесь еще до поступления ее в эндотрахеальную трубку. Температура газовой смеси, поступающей в трахею должна составлять 36,5-37,0 Со, а относительная влажность – приближаться к 100%. Ингаляция сухих и охлажденных газов резко повышает вязкость мокроты, увеличивает риск обтурации эндотрахеальной трубки, может вызвать бронхоспазм, а также привести к общему охлаждению ребенка. Напротив, перегревание смеси вызывает повреждение эпителия дыхательных путей и дисфункцию сурфактантной системы легких. Аэрозольная терапия применяется главным образом для разжижения мокроты введения в дыхательную смесь лекарственных препаратов. Чаще всего применяются вещества, обладающие муколитическими (растворяющими мокроту), бронхолитическими, противовоспалительными и антибактериальными свойствами. Показанием к применению аэрозольной терапии являются острые и хронические заболевания бронхов и легких, сопровождающиеся накоплением вязкой мокроты. Проводятся аэрозольные ингаляции с помощью пневматических или ультразвуковых распылителей. Муколитические вещества улучшают реологические свойства мокроты и облегчают ее эвакуацию. В настоящее время для этих целей чаще всего применяют растворы гидрокарбоната натрия и ацетилцистеин. Из препаратов, обладающих бронхолитическим или противовоспалительным действием обычно используют селективные бета2-адреномиметики (сальбутамол,тербуталин), производные пуринов (теофиллин) и глюкокортикоидные гормоны. Недостатки, связанные с ингаляционным способом введения лекарственных препаратов, определяются прежде всего неравномерностью распределения аэрозолей в легких – большая часть попадает в области, где лучше вентиляция и меньше обструкция. Кроме того, практически невозможно определить какое количество препаратов осело в легких и сколько затем попало в системный кровоток. Ультразвуковые ингаляции у детей младшего возраста должны применяться с осторожностью в связи с опасностью развития гипергидратации. Отмечено также, что использование этих ингаляторов в ряде случаев может способствовать распространению инфекции. Оксигенотерапия Артериальная гипоксемия – наиболее частое проявление дыхательной недостаточности и поэтому ингаляции кислорода являются практически непременным компонентом респираторной терапии. Однако, кислород, как и любое другое лекарственное средство, должен вводиться в соответствующих дозах. Положительные эффекты оксигенотерапии, связанные с устранением гипоксемии, хорошо изучены и легко отмечаются при наблюдении за больным (исчезновение цианоза, уменьшение одышки, тахикардии и т.д.). Напротив, отрицательное влияние гипероксических дыхательных смесей и избыточного напряжения кислорода на функционирование различных систем организма, как правило, не имеет отчетливых клинических проявлений, отсрочено по времени и диагностируется либо с помощью специальных исследований, либо когда это негативное воздействие уже приобретает угрожающий характер. Гипероксические дыхательные смеси (концентрация О2 > 40% при лечении новорожденных и выше 50% - у более старших детей) приводят к вымыванию азота (денитрогенизации) сначала из дыхательных путей, а затем и из тканей организма. При этом возникает полнокровие и отечность слизистых оболочек, нарушается нормальное функционирование реснитчатого эпителия дыхательных путей, увеличивается скорость разрушения сурфактанта. Денитрогенизация альвеол ведет к развитию адсорбционных микроателектазов, ухудшаются вентиляционно-перфузионные отношения в легких, возрастает величина внутрилегочного шунтирования. Еще более опасные последствия имеет гипероксемия (РаО2 > 100 мм рт.ст.). При назначении кислорода врачу необходимо четко представлять величину парциального давления О2 в альвеолярном газе (РАО2) и, соответственно, вероятный уровень гипероксемии. В упрощенном варианте формула для расчета РAО2 может быть представлена в следующем виде: РАО2 = РiO2 – PaCO2, где РiO2 – парциальное давление кислорода во вдыхаемом газе. При этом допустимо считать, что РАО2 » РаО2, а РiO2 в 7 раз выше концентрации кислорода во вдыхаемом воздухе. Например, если ребенок дышит 50% -ной кислородно-воздушной смесью, а PaCO2 равно 40 мм рт. ст., то РАО2 будет (50 ´ 7 – 40) = 310 мм рт. ст. При улучшении легочной функции артериальное рО2 будет приближаться к этой величине, т.е. разовьется опасная гипероксемия. Чрезмерно высокий уровень РаО2 неизбежно приводит к системным и органным нарушениям, степень выраженности которых зависит от метода и продолжительности оксигенотерапии, возраста и степени зрелости пациента, характера патологии и многих других факторов. Повышение содержания кислорода в крови нарушает нормальное течение окислительно-восстановительных реакций, происходит образование большого количества свободных радикалов, обладающих агрессивными свойствами. Естественной защитной реакцией организма на гипероксемию является сосудистый спазм, степень выраженности которого не одинакова в различных органах и тканях. В частности, спазм сосудов проявляется нарушением терморегуляции, судорожным синдромом или даже развитием коматозного состояния. Особенно опасна избыточная оксигенация у недоношенных и незрелых детей. Известны, по меньшей мере, два тяжелых заболевания (ретинопатия и хроническое заболевание легких новорожденных), этиопатогенез которых напрямую связан с агрессивной кислородотерапией. Поэтому анестезиолог-реаниматолог, назначая кислород, должен постоянно помнить о возможных осложнениях, контролировать параметры оксигенации (FiO2, PaO2, SaO2) и своевременно корректировать терапию. Способы ингаляционной кислородной терапии. В педиатрической практике для ингаляций кислорода наиболее часто используются носовые канюли и катетеры, лицевые маски, палатки, кювезы (Рис. 8.4.). Носовые катетеры бывают спаренные, которые вводят в оба наружных носовых хода, или одиночные, которые обычно проводят назофарингеально. Глубину введения одиночного катетера можно определить, измерив расстояние от крыла носа до козелка ушной раковины. Носовые катетеры мало беспокоят больного и позволяют поддерживать невысокие (до 35-40%) концентрации кислорода в дыхательной смеси. Недостатками этих способов является то, что они затрудняют носовое дыхание и не дают возможности контролировать концентрацию кислорода. Применение лицевых масок позволяет стабильно поддерживать различные, в том числе и высокие, концентрации кислорода в дыхательной смес
|
|||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 357; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.228.95 (0.137 с.) |