
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение порядка химической реакции окисления загрязняющих веществ в процессах очистки сточной воды (графический метод ) ⇐ ПредыдущаяСтр 6 из 6
Целью работы является получение представлений о процессах очистки, в основе которых лежат химические реакции, а также о способах определния порядка этих реакций. Одним из наиболее простых способов определения характера реакции является графический метод. Графический метод определения порядка и константы скорости реакции удобен, если реакции первого или второго порядка. При равных значениях начальной концентрации реагирующих веществ
Интегрируя эти уравнения, получаем
Одновременно из выражений (4.10) и (4.11) можно получить формулы для определения костанты k скорости реакции
Порядок выполнения работы Методические указания к работе предусматривают два варианта ее выполнения. В первом случае зависимость С = C(t) определяется опытным путем и работа выполняется в соответствии с указаниями пунктов 1-7. Во втором случае данные зависимости С = C(t) приводятся как известные в таблице исходных данных и работа выполняется в соответствии с пунктами 5-7. 1. Приготавливаются два равных объема воды с равными концентрациями окисляемого вещества и вещества-окислителя в них. 2. Измеряется начальное содержание окислителя в объеме воды, содержащем вещество-окислитель. 3. Содержимое двух емкостей сливается в одну и начинается отсчет времени реакции окисления в этой емкости. 4. Периодически измеряется содержание окислителя С в объеме реакции. 6. Результаты наблюдений, полученные экспериментально или как исходные данные (см. табл.4.6), за изменением концентрации С в зависимости от времени t записываются в таблицу результатов наблюдения, форма которой приведена ниже.
Таблица результатов наблюдения за реакцией окисления
6. Рассчитываются значения In С и 1 /С, по которым строятся графики зависимостей InС = f(t) и 1/С = f(t). 7. По виду зависимостей In С = f(t) и 1/С = f(t) определяют порядок реакции. В зависимости от ставшего известным порядка реакции и пользуясь выражением (4.12) или (4.13), определяют константу k скорости реакции окисления. 8. Все расчеты и оформление работы осуществляются в строгом соответствии с примером расчета и оформления работы, который приводится ниже. Таблица 4.6 Данные о зависимости концентрации окислителя С от времени реакции t
продолжение табл. 4.6
продолжение табл. 4.6
Пример расчета и оформления работы 1. Исходные данные для выполнения работы и приведены в нижеследующей таблице. Результаты расчета параметров InС и 1/С приведены в этой таблице.
2. графики зависимостей InС = f(t) и 1/С = f(t) InС
InС = f(t)
1/С = f(t)
100 200 400 600 800 1000
3. Выводы: анализ зависимостей InС = f(t) и 1/С = f(t) показывает, зависимость InС = f(t) в большей степени, чем зависимость 1/С = f(t), носит линейный характер. Следовательно, исследуемая реакция является реакцией первого порядка. Константа скорости реакции окисления можно определить, пользуясь уравнением (4.12)
При t = 400 сек, InС = - 0,39, k = (lnC 0 - lnC): t =(0,079 - 0,27):400 =0,87·10 –3 л/ммоль·сек.
4.5. Исследование процесса нейтрализации технологической сточной воды Целью работы является освоение способов расчета и организации процессов нейтрализации сточной воды предприятия. Для очистки производственной (технологической) сточной воды от щелочей и кислот чащевсего применяется нейтрализация. Нейтрализация может быть осуществлена: 1) при смешивании щелочных и кислотных стоков, 2) добавлении к сточным водам приготовленного раствора нейтрализатора или 3) фильтровании через нейтрализирующие материалы. При нейтрализации стока путем смешивания взаимонейтрализующих сточных вод, как правило, в общем после смешивания стоке будет наблюдаться избыток одного из веществ - кислоты или щелочи. Поэтому, этот избыток требует последующей его нейтрализации. Определить, какое из веществ окажется в общем стоке в избытке можно по величине однеого из отношений
где В - концентрация щелочи в стоке, кг/м3; А - концентрация кислоты в сточной воде, кг/м3; qВ - удельный расход щелочи для нейтрализации стока, кг/кг (см. табл. 4.7);
Если первое из отношений (4.14) больше единицы, то в общем стоке будет наблюдаться избыток щелочи. Аналогично, при величине второго отношения больше единицы, в стоке будет избыток кислоты. Количество остаточной щелочи (или кислоты) будет равно
где При расчете нейтрализации путем смешивания стоков необходимо учитывать, что отношения (4.14) и формулы (4.15) и (4.16) применяются в том случае, когда смешиваются равные количества нейтрализуемых стоков.
При нейтрализации кислых сточных вод раствором щелочи-нейтрализатора количество щелочи, которое необходимо для нейтрализации, можно рассчитать по формуле
где b - расход щелочи-реагента, кг; k - коэффициент запаса по расходу реагента,принимается равным k = 1,1 – 1,5; m - количество активной части реагента в товарном продукте, принимается равным m = 78 - 85 %; QА - количество нейтрализуемых кислых сточных вод, м3; Для нейтрализации щелочного стока количество кислоты-нейтрализатора определяется по формуле
где а - расход кислоты, кг; QВ - количество нейтрализуемых щелочных стоков. При нейтрализации кислого стока в вертикальном фильтре с загрузкой из щелочного нейтрализирующего материала общая высота загрузки определяется по формуле
где Н - высота загрузки, м; k - значение эмпирического коэффициента для доломита, принимается равным k = 0,62 – для щелковского доломита или k = 1,31 – для уральского доломита; n - эмпирический коэффициент, принимается равным n = 1,47; СА - концентрация кислоты, г - экв/л (СА = Высоту h одного фильтра рекомендуется принимать не более 1,5-1,8 м, поэтому количество фильтров в технологической схеме определяется по формуле Диаметр фильтра D рассчитывается по формуле
Порядок выполнения работы
1. Познакомиться с основными положениями выполняемой работы. 2. Записать исходные данные в соответствии с индивидуальным вариантом задания (см. табл. 4.8). 3. Выбрать вариант технологии нейтрализации стоков (см. рис. 4.6) в зависимости от соотношения QA и QB. Нарисовать принятую схему технологии нейтрализации. 4. Пользуясь выражениями (4.14) - (4.16), рассчитать процесс нейтрализации при смешивании стоков: определить характер стока после смешивания и остаточную концентрацию кислоты А ост или щелочи В ост. 5. Пользуясь выражениями (4.17) или (4.18), рассчитать процесс нейтрализации раствором соответствующего нейтарализатора: определить расход b (или а) реагента общий, а также расход реагента на 1 м3 сточной воды. 6. Пользуясь выражениями (4.19) – (4.21), рассчитать процесс нейтрализации сточной воды фильтрованием через нейтрализующие материалы: определить высоту фильтрующей загрузки Н, количество фильтров n ф и диаметр фильтра D.
4. Все расчеты и оформление работы осуществляются в строгом соответствии с примером расчета и оформления работы, который приводится ниже. Таблица 4.7 Удельный расход щелочи (qВ , кг/кг) для полной нейтрализации кислоты
Таблица 4.8 Данные для расчета процесса нейтрализации
продолжение табл. 4.8
продолжение табл. 4.8
1 вариант технологии нейтрализации (QA > QB)
Q ′A =QB; A QB; B
(Q′A + QB)= 2 QB; A ост
Q ′ A + Q ″ A = Q A 2 вариант технологии нейтрализации ( QA < QB)
 Q′B + Q″B = Q B Q′B + Q″B = Q B
Рис. 4.6. Технологии нейтрализации производственных стоков Пример расчета и оформления работы Исходные данные: QA = 5,6 м3; A = 2,6 г/ м3 - HNO3; Q B = 2,4 м3; B = 1,6 г/ м3 - кальцинированная сода. Выбираем вариант технологии нейтрализации: так как QA > QB, то принимается 1 вариант технологии нейтрализации (см. схему).
Q″A; A
Q′A + Q″A = Q A ; А
Расчет 1 этапа нейтрализации – при смешивании стоков: смешивается весь объем щелочного стока QB = 2,4 м3 с концентрацией щелочи B =1,6 г/ м3 с таким же количеством кислого стока, то есть Q ′ A = 2,4 м3 с концентрацией кислоты A= 2,6 г/ м3. Отношение где Расчет 2 этапа нейтрализации – фильтрованием кислого стока объемом Q′A + QB = 2,4 + 2,4= 4,8 м3 и концентрацией A ост= 0,58 г/ м3 Высота фильтрующей загрузки
принимаем количество фильтров nф = 2 каждый высотой 3,30:2=1,65м; диаметр фильтра Расчет 3 этапа нейтрализации – кислого стока раствором щелочи-нейтрализатора. Объем нейтрализуемого стока составляет Q″A = Q A - Q′A = 5,6 – 2,4 = 3,2 м3 с концентрацией кислоты А=2,6 г/ м3 Количество реагента-щелочи, которое необходимо для нейтрализации 3,2 м3 стока составляет
Для нейтрализации 1 м3 потребуется 4,64 кг нейтрализатора-щелочи – кальцинированной соды.
СОДЕРЖАНИЕ 1. Экология водных объектов 1.1. Исследование загрязнения водоемов при сбросе сточной воды (метод Фролова-Родзиллера).......................................... 3 1.2. Исследование загрязнения водоемов при сбросе сточной воды (по уравнению конвективно-диффузионного переноса).................... 12 1.3. Исследование отрицательного влияния предприятия на природные водные объекты................................................ 18 1.4. Расчет предельно-допустимого сброса (ПДС) загрязняющих веществ в водоем при сбросе сточной воды предприятия.................... 34 1.5. Исследование загрязнения водоемов при эксплуатации судовой энергетической установки .......................................... 39 2. Экология атмосферного воздуха 2.1. Исследование загрязнения атмосферы источниками выбросов предприятия....................................................... 51 2.2. Исследование загрязнения атмосферы при эксплуатации судовой энергетической установки.................................... 67 3. Экологический контроль за состоянием природной среды и инженерных объектов 3.1. Обработка результатов экологического контроля ............. 76 3.2. Анализ экспериментальных результатов экологического контроля природной среды и инженерных объектов ......................... 85 Технология и техника очистки воды 4.1. Исследование процесса очистки воды седиментацией ....... 103 4.2. Исследование работы адсорбционного фильтра ............. 114 4.3. Исследование процесса очистки воды при окислении загрязняющих веществ ..................................................... 121 4.4. Определение порядка химической реакции окисления загрязняющих веществ в процессах очистки сточной воды (графический метод)..... 130 4.5. Исследование процесса нейтрализации производственных стоков.. 137
РЕШНЯК Валерий Иванович ЭКОЛОГИЯ
Практикум
[R1]
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 121; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.233.41 (0.145 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
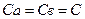 скорость реакций первого и второго порядков соответственно будет отражена уравнениями
скорость реакций первого и второго порядков соответственно будет отражена уравнениями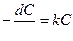
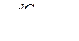
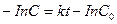 (4.10)
(4.10)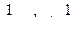 (4.11)
(4.11) Анализ уравнений (4.10) и (4.11) показывает, что они линейны соответственно в координатах (In С; t) и (1/С; t). Поэтому, если экспериментальные данные, изображенные в координатах (In С; t), укладываются на прямую, то исследуемая реакция является реакцией первого порядка. Если экспериментальные точки ложатся на прямую в координатах (1/С; t), то такая реакция имеет второй порядок.
Анализ уравнений (4.10) и (4.11) показывает, что они линейны соответственно в координатах (In С; t) и (1/С; t). Поэтому, если экспериментальные данные, изображенные в координатах (In С; t), укладываются на прямую, то исследуемая реакция является реакцией первого порядка. Если экспериментальные точки ложатся на прямую в координатах (1/С; t), то такая реакция имеет второй порядок.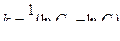 (4.12)
(4.12)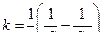 (4.13)
(4.13)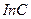
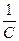
 Время t, сек
Вариант
задания
Время t, сек
Вариант
задания



 lnC0 100 200 400 600 800 1000
lnC0 100 200 400 600 800 1000 

 -0,10
-0,10  -0,20
-0,20



 t, сек
t, сек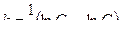
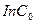 =0,079 (по графику) константа скорости реакции
=0,079 (по графику) константа скорости реакции 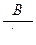 или
или 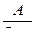 (4.14)
(4.14)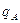 - удельный расход кислоты, кг/кг. Удельные расходы кислоты
- удельный расход кислоты, кг/кг. Удельные расходы кислоты 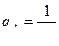 .
.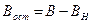 (4.15)
(4.15)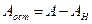 (4.16)
(4.16)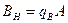 - нейтрализуемая часть щелочи;
- нейтрализуемая часть щелочи; 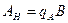 - нейтрализуемая часть кислоты.
- нейтрализуемая часть кислоты. , (4.17)
, (4.17) , ( 4.18)
, ( 4.18)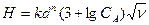 , (4.19)
, (4.19)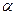 А, где А - концентрация кислоты в г/л (кг/м3);
А, где А - концентрация кислоты в г/л (кг/м3); 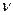 = 4-8 м/ч; d - размер зерен загрузки, принимается равным d=2 - 6 мм.
= 4-8 м/ч; d - размер зерен загрузки, принимается равным d=2 - 6 мм.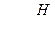 (4.20)
(4.20)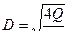 . (4.21)
. (4.21) щелочь
Кислота
щелочь
Кислота

 (Q A + Q′ B)=2 Q A; A ост
(Q A + Q′ B)=2 Q A; A ост
 (Q′A + QB); A ост
(Q′A + QB); A ост
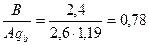 . Значение qB = 1,19 принято по табл. 4.7 для нейтрализации азотной кислоты раствором кальцинированной соды. Так как это отношение меньше единицы, то общий сток будет кислым. Остаточная концентрация кислоты составит
. Значение qB = 1,19 принято по табл. 4.7 для нейтрализации азотной кислоты раствором кальцинированной соды. Так как это отношение меньше единицы, то общий сток будет кислым. Остаточная концентрация кислоты составит 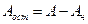 = 2,6 – 2,02 = 0,58 г/ м3
= 2,6 – 2,02 = 0,58 г/ м3 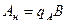 = 0,84·2,4 = 2,02 г/ м3
= 0,84·2,4 = 2,02 г/ м3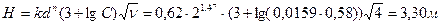
 .
.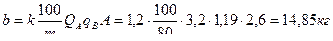 ,
, 


