Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Жизненно необходимые элементы
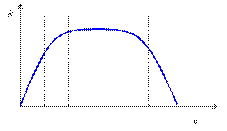
Несомненно, время внесет коррективы в современные представления о числе и биологической роли определенных химических элементов в организме человека. В данной статье мы будем исходить из того, что уже достоверно известно. Роль макроэлементов, входящих в состав неорганических веществ, очевидна. Например, основное количество кальция и фосфора входит в кости (гидроксофосфат кальция Ca10(PO4)6(OH)2), а хлор в виде соляной кислоты содержится в желудочном соке. Микроэлементы вошли в отмеченный выше ряд 22 элементов, обязательно присутствующих в организме человека. Заметим, что большинство из них – металлы, а из металлов больше половины являются d-элементами. Последние в организме образуют координационные соединения со сложными органическими молекулами. Так, установлено, что многие биологические катализаторы – ферменты содержат ионы переходных металлов (d-элементов). Например, известно, что марганец входит в состав 12 различных ферментов, железо – в 70, медь – в 30, а цинк – более чем в 100. Микроэлементы называют жизненно необходимыми, если при их отсутствии или недостатке нарушается нормальная жизнедеятельность организма. Характерным признаком необходимого элемента является колоколообразный вид кривой доза (n) – ответная реакция (R, эффект) (рис. 1).
Рис. 1. Зависимость ответной реакции (R) от дозы (n) для жизненно необходимых элементов При малом поступлении данного элемента организму наносится существенный ущерб. Он функционирует на грани выживания. В основном это объясняется снижением активности ферментов, в состав которых входит данный элемент. При повышении дозы элемента ответная реакция возрастает и достигает нормы (плато). При дальнейшем увеличении дозы проявляется токсическое действие избытка данного элемента, в результате чего не исключается и летальный исход. Кривую на рис. 1 можно трактовать так: все должно быть в меру и очень мало и очень много вредно. Например, недостаток в организме железа приводит к анемии, так как оно входит в состав гемоглобина крови, а точнее, его составной части – гема. У взрослого человека в крови содержится около 2,6 г железа. В процессе жизнедеятельности в организме происходят постоянный распад и синтез гемоглобина. Для восполнения железа, потерянного с распадом гемоглобина, человеку необходимо суточное поступление в организм с пищей в среднем около 12 мг этого элемента. Связь анемии с недостатком железа была известна врачам давно, так как еще в XVII веке в некоторых европейских странах при малокровии прописывали настой железных опилок в красном вине. Однако избыток железа в организме тоже вреден. С ним связан сидероз глаз и легких – заболевания, вызываемые отложением соединений железа в тканях этих органов. Главный регулятор содержания железа в крови – печень.
Недостаток в организме меди приводит к деструкции кровеносных сосудов, патологическому росту костей, дефектам в соединительных тканях. Кроме того, считают, что дефицит меди служит одной из причин раковых заболеваний. В некоторых случаях поражение легких раком у людей пожилого возраста врачи связывают с возрастным снижением содержания меди в организме. Однако избыток меди в организме приводит к нарушению психики и параличу некоторых органов (болезнь Вильсона). Человеку причиняют вред лишь относительно большие количества соединений меди. В малых дозах их используют в медицине как вяжущее и бактериостазное (задерживающее рост и размножение бактерий) средство. Так, например, сульфат меди (II) применяют при лечении конъюктивитов в виде глазных капель (25%-ный раствор), а также для прижиганий при трахоме в виде глазных карандашей (сплав сульфата меди(II), нитрата калия, квасцов и камфоры). При ожогах кожи фосфором проводят ее обильное смачивание 5%-ным раствором сульфата меди (II). Таблица 2. Характерные симптомы дефицита химических элементов в организме человека
Биологическая функция других щелочных металлов в здоровом организме пока неясна. Однако имеются указания, что введением в организм ионов лития удается лечить одну из форм маниакально-депрессивного психоза. Приведем табл. 2, из которой видна важная роль других жизненно необходимых элементов.
Примесные элементы Имеется большое число химических элементов, особенно среди тяжелых, являющихся ядами для живых организмов, - они оказывают неблагоприятное биологическое воздействие. В табл. 3 приведены эти элементы в соответствии с Периодической системой Д.И. Менделеева. Таблица 3.
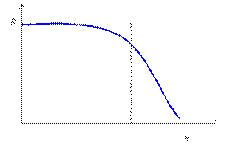
За исключением бериллия и бария, эти элементы образуют прочные сульфидные соединения. Существует мнение, что причина действия ядов связана с блокированием определенных функциональных групп (в частности, сульфгидрильных) протеина или же с вытеснением из некоторых ферментов ионов металлов, например меди и цинка. Элементы, представленные в табл. 3, называют примесными. Их диаграмма доза – эффект имеет другую форму по сравнению с жизненно необходимыми (рис. 2).
Рис. 2. Зависимость ответной реакции (R) от дозы (n) для примесных химических элементов До определенного содержания этих элементов организм не испытывает вредного воздействия, но при значительном увеличении концентрации они становятся ядовитыми. Встречаются элементы, которые в относительно больших количествах являются ядами, а в низких концентрациях оказывают полезное влияние. Например, мышьяк – сильный яд, нарушающий сердечно-сосудистую систему и поражающий почки и печень, в небольших дозах полезен, и врачи прописывают его для улучшения аппетита. Кислород, необходимый человеку для дыхания, в высокой концентрации (особенно под давлением) оказывает ядовитое действие. Из этих примеров видно, что концентрация элемента в организме играет весьма существенную, а порой и катастрофическую роль. Среди примесных элементов имеются и такие, которые в малых дозах обладают эффективными лечащими свойствами. Так, давно было замечено бактерицидное (вызывающее гибель различных бактерий) свойство серебра и его солей. Например, в медицине раствор коллоидного серебра (колларгол) применяют для промывания гнойных ран, мочевого пузыря, при хронических циститах и уретитах, а также в виде глазных капель при гнойных конъюктивитах и бленнорее. Карандаши из нитрата серебра применяют для прижигания бородавок, грануляций. В разбавленных растворах (0,1-0,25%) нитрат серебра используют как вяжущее и противомикробное средство для примочек, а также в качестве глазных капель. Ученые считают, что прижигающее действие нитрата серебра связано с его взаимодействием с белками тканей, что приводит к образованию белковых солей серебра – альбуминатов. Серебро пока не относят к жизненно необходимым элементам, однако уже экспериментально установлено его повышенное содержание в мозгу человека, в железах внутренней секреции, печени. В организм серебро поступает с растительной пищей, например с огурцами и капустой.
В статье приведена Периодическая система, в которой охарактеризована биоактивность отдельных элементов [1]. Оценка основана на проявлении симптомов дефицита или избытка определенного элемента. Она учитывает следующие симптомы (в порядке возрастания эффекта): 1 – снижение аппетита; 2 – потребность в изменении диеты; 3 – значительные изменения состава тканей; 4 – повышенная повреждаемость одной или нескольких биохимических систем, проявляющаяся в специальных условиях; 5 – недееспособность этих систем в специальных условиях; 6 – субклинические признаки недееспособности; 7 – клинические симптомы недееспособности и повышенная повреждаемость; 8 – заторможенный рост; 9 – отсутствие репродуктивной функции. Крайней формой проявления дефицита или избытка элемента в организме является смертельный исход. Оценка биоактивности элемента сделана по девятибальной шкале в зависимости от характера симптома, для которого выявлена специфичность. При такой оценке наиболее высоким баллом характеризуются жизненно необходимые элементы. Например, элементы водород, углерод, азот, кислород, натрий, магний, фосфор, сера, хлор, калий, кальций, марганец, железо и др. Характеризуются суммой балов, равной 9.
Выявление биологической роли отдельных химических элементов в функционировании живых организмов (человека, животных, растений) – важная и увлекательная задача. Минеральные вещества, как и витамины, часто действуют как коферменты при катализе химических реакций, происходящих все время в организме. Усилия специалистов направлены на раскрытие механизмов проявления биоактивности отдельных элементов на молекулярном уровне (см. Статьи Н.А. Улахновича «Комплексы металлов в живых организмах»: Соросовский Образовательный Журнал. 1997. № 8. С. 27-32; Д.А. Леменовского «Соединения металлов в живой природе»: Там же. № 9. С. 48-53). Нет сомнения, что в живых организмах ионы металлов находятся в основном в виде координационных соединений с «биологическими» молекулами, которые выполняют роль лигандов. В статье из-за ограниченности объема приведен материал, относящийся главным образом к организму человека. Выяснение роли металлов в жизнедеятельности растений, несомненно, окажется полезным для сельского хозяйства. Работы в этом направлении широко ведутся в лабораториях различных стран. Весьма интересен вопрос о принципах отбора природой химических элементов для функционирования живых организмов. Не вызывает сомнения, что их распространенность не является решающим фактором. Здоровый организм сам способен регулировать содержание отдельных элементов. При наличии выбора (пищи и воды) животные инстинктивно могут вносить лепту в это регулирование. Возможности растений в данном процессе ограничены. Сознательное регулирование человеком содержания микроэлементов в почве сельскохозяйственных угодий также одна из важных задач, стоящих перед исследователями. Знания, полученные учеными в этом направлении, уже оформились в новую отрасль химической науки – бионеорганическую химию. Поэтому уместно напомнить слова выдающегося ученого XIX века А. Ампера: «Счастливы те, кто развивает науку в годы, когда она не завершена, но когда в ней уже назрел решительный поворот». Эти слова могут быть особенно полезны тем, кто стоит перед выбором профессии.
Контрольные вопросы: 1. Как влияет недостаток жизненнонеобходимых элеметов на организм человека. 2. Какие заболевения развиваются при нехватке и избытке жизненнонеобходимых элементов.
Литература 1. Габриелян О.С. Химия. 9, 10, 11 кл. – М., 2000, 2003. 2. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014. 3. Габриелян О.С. Химия. Практикум: учеб. пособие. — М., 2014. 4. Габриелян О.С. и др. Химия. Тесты, задачи и упражнения: учеб. пособие. — М., 2014. 5. Габриелян О.С. Химия. Пособие для подготовки к ЕГЭ: учеб. пособие. — М., 2014. 6. Ерохин Ю. М. Химия: Задачи и упражнения: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014. 7. Ерохин Ю. М. Сборник тестовых заданий по химии: учеб. пособие для студ. Учреждений сред. проф. образования. — М., 2014. 8. Савинкина Е.В., Логинова Г.П. Химия для школ и классов гуманитарного профиля. 10, 11 кл. – М., 2001-2002. 9. Химия: электронный учебно-методический комплекс. — М., 2014.
Тема 20: «Химия в быту».
План: 1. Химия и чистота. 2. Химия на кухне. 3. Парфюмерно-косметчиеские средства. 4. Химические препараты для борьбы с вредными насекомыми.
Химия - постоянный спутник человека. Сначала она была не наукой, а практикой - ремеслом или искусством. По сути дела между этими двумя понятиями - ремеслом и искусством - трудно установить четкую границу, потому что искусство часто превращалось в ремесло, а ремесло - в искусство. Чтобы деятельность человека стала «наукой», она прежде всего должна обогатиться общей теорией, без которой немыслимо развитие любой науки. Исследователи связывают название «химия» с египетским словом «хам», или «хеми», что означает Египет. А в своих трудах византийские лексикографы называют «химией» искусство превращать обычные металлы в золото, серебро и их сплавы. На современном этапе мы являемся свидетелями бурного развития химии. Трудно перечислить или кратко обобщить ее достижения - от Периодической системы элементов Менделеева к разгадке тайны жизни (нуклеиновые кислоты и белки). Сегодня она находит применение в таких важных областях науки и техники, как электроника, вычислительная техника, космические исследования, транспорт, получение новых источников энергии, сельское хозяйство, медицина и т.д. Дальнейшее развитие химической науки и прикладной химии означает их широкое применение в повседневной жизни, во всех областях деятельности человека, несомненно улучшит быт и повысит благосостояние.
Химия и чистота Из многочисленных химических продуктов моющие средства, и средства чистящие, занимают первое место по своему применению в быту, начиная от традиционного способа - мыла и заканчивая большим количеством современных синтетических моющих препаратов, незаменимых в жизни человека. Мыло, особенно различные виды туалетной, является одним из наиболее распространенных моющих средств. Оно представляет собой щелочные (в основном натриевые, реже калиевые) соли высших жирных кислот - стеариновой, пальмитиновой, олеиновой и др.. Конечный продукт содержит также краски, эссенции, добавки. Обычное натриевое мыло получают путем омыления жиров и масел (свиного и костного жиров, кокосового масла, жидких растительных масел, твердых жиров и др.). каустической содой (натриевым щелоком). В процессе реакции жир представляет собой эфир высших жирных кислот с глицерином под действием гидроокиси натрия омилюеться, есть связь между глицерином и высшими жирными кислотами разрушается, при этом глицерин переходит в свободное состояние, а жирные кислоты - в натриевую соль - мыло. При использовании свободных жирных кислот, синтетических или полученных путем гидролиза жиров, омыления (в данном случае нейтрализация) производится карбонатом натрия (кальцинированной содой). Туалетное мыло получают из высококачественного сырья. По технологии производства различают мыло холодного приготовления (кокосовое), прозрачное (глицериновое) и полированное. Последнее наиболее качественное и широко используется в быту. Синтетические моющие средства выпускаются в порошкообразном, жидком и пастообразном виде. Наиболее распространены порошкообразные и гранулированные (75%) моющие средства. Все синтетические моющие Препарат представляет собой сложную композицию из нескольких компонентов, взятых в определенном соотношении, каждый из которых имеет свое предназначение. Главной составной частью любого моющего средства являются синтетические поверхностно-активные вещества (ПАВ). Они бывают двух видов - ионогенные и неионогенные. Наиболее широко применяются ионоактивни синтетические моющие средства, обладающие свойствами солей типа алкилсульфатов, аминосульфатив и т.п., которые диссоциируют на ионы в водном растворе. Неионогенные поверхностно-активные вещества не диссоциируют в воде на ионы. Это сложные органические соединения, молекулы которых содержат гидроксильную группу, способствует их частичной растворимости в воде. Лучшие моющие свойства имеют препараты, включающие два вида поверхностно-активных веществ. Иногда к ним добавляют мыло. Стиральные и моющие препараты, кроме ЮАР, содержат так называемые активные добавки. К ним относятся вещества типа кальцинированной соды (карбоната натрия), питьевой соды и фосфата натрия, устраняют жировые загрязнения. Одной из наиболее важных добавок является полифосфаты. Порошкообразные, гранулированные и пастообразные моющие средства содержат триполифосфат натрия. Триполифосфат калия или двойную соль триполифосфата добавляют к жидким моющим средствам. Полифосфаты связывают ионы кальция и магния жесткой воды, образуя растворимые в воде соединения. Они препятствуют взаимодействия этих ионов с поверхностно-активными веществами, то есть образованию нерастворимых соединений, откладываются на поверхности ткани во время стирки. Таким образом, повышается моющая способность поверхностно-активных веществ. Наличие полифосфатов в синтетических препаратах позволяет использовать их для стирки в жесткой и морской воде. При этом следует увеличивать дозы препарата. К некоторых препаратов, применяемых в основном для стирки хлопчатобумажных и льняных тканей, добавляют химические отбеливатели. К ним относятся различные неорганические и органические соединения, выделяющие при разложении активный кислород или хлор. Часто используется препарат натрия, при высокой температуре выделяет активный кислород, который окисляет и отбеливает цветные органические соединения. Естественно, не следует применять для стирки цветного белья и тканей препараты, содержащие отбеливающие добавки. В последнее время широко применяются препараты, содержащие энзимы (ферменты). Энзимами является биокатализаторы с белковой структурой, ускоряющие расщепление молекул белка. Преимущество этих препаратов заключается в том, что в мягкой воде они быстро и легко устраняют загрязнения органического происхождения. Количество ферментов в растворе незначительна, и они не раздражают кожу рук. Стиральные препараты, содержащие энзимы, следует хранить в сухом прохладном месте. Они имеют срок годности, в течение которого сохраняется необходимое активность энзимов. В быту часто на одежде появляются пятна от жиров, пищевых продуктов, шариковых ручек и т.д. Их можно легко удалить в домашних условиях. Для успешного выведения пятен на одежде и тканях необходимо соблюдать определенные правила. К сожалению, не существует универсальных средств для выведения всех видов пятен на одежде из разных тканей. Важным условием успешного удаления пятен является определение типа волокна, из которого сделана вещь, и происхождение пятна. Для выведения пятен широко применяются органические растворители: бензин, ацетон, спирт и другие легковоспламеняющиеся вещества. Поэтому при работе с ними следует соблюдать осторожность. Кроме того, ацетон растворяет ацетатного волокна, а уксусная кислота его разрушает. Не следует выводить пятна уксусной кислотой из нейлоновых вещей. Изделия из шерсти и натурального шелка отбеливают 3%-ным перекисью водорода с добавлением небольшого количества аммиака. После отбеливания изделие следует обильно прополоскать в теплой, затем в холодной воде. Химия на кухне Кухня - это лаборатория, в которой постоянно происходят химические и биохимические процессы. Не осознавая этого, мы почти каждый день работаем в химической лаборатории. Домохозяйки, да и не только они, боятся вторжения химии в кулинарии. Это вполне естественно. Мы не будем пытаться создавать искусственную пищу. В нашей кухне достаточно продуктов природного происхождения. Проблема заключается в том, как наиболее рационально их использовать и подобрать, чтобы обеспечить сочетание вкусовых и питательных качеств, упростить процесс приготовления пищи. Для этого необходимо хорошо знать свойства пищевых продуктов. Кухня полная химических реактивов: хлорид натрия, глицериды и соли высших жирных кислот, уксусная, лимонная, винная кислоты, полипептиды и белки и т.д. Эти реактивы мы называем просто: соль, растительное масло, уксус, сахар, крахмал, масло, мясо и др..
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 208; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.168.56 (0.038 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||