
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Различают электролиз расплавов и растворов электролитов.
Электролиз расплавов солей Катодные процессы. 1) Все катионы металлов восстанавливаются на катоде: К(-): Zn2+ + 2e- → Zn0; Na+ + 1e- → Na0
Анодные процессы. 1) Анионы бескислородных кислот окисляются на аноде: А(+): 2Cl¯ - 2e-→Cl2
2) Анионы кислородсодержащих кислот образуют соответствующий кислотный оксид и кислород: А(+): 2SO42ˉ - 4e- → 2SO3 + O2
Электролиз водных растворов электролитов Катодные процессы. При прочих равных условиях ионы металлов восстанавливаются на катоде тем легче, чем менее активен металл, чем дальше вправо он расположен в ряду напряжений.
1) Катионы металлов, имеющие электродный потенциал более высокий, чем у ионов водорода Н+ (в ряду напряжений эти металлы стоят после Н2), при электролизе практически полностью восстанавливаются на катоде: Cu2+ + 2e- → Cu0
2) Катионы металлов, имеющие низкую величину электродного потенциала (от начала ряда напряжения по алюминий включительно), не восстанавливаются на катоде и остаются в растворе, на катоде идет процесс электрохимического восстановления водорода из молекул воды: 2H2O + 2e- → H2 + 2OH¯
3) Катионы металлов, имеющие электродный потенциал ниже, чем у ионов водорода (Н+), но выше, чем у ионов алюминия (Al3+), т.е стоящих между Zn2+→ Men+ ← H2, при электролизе восстанавливаются на катоде одновременно с водородом. Fe3+ + 3e- → Fe0 2H2O + 2e- → H2 + 2OH¯
Анодные процессы. При электролизе веществ используется инертные, не изменяющиеся в процессе электролиза аноды (графитовые, платиновые) и растворимые аноды, окисляющиеся в процессе электролиза легче, чем анионы (из цинка, никеля, серебра, меди и других металлов).
1) Анионы бескислородных кислот (S2ˉ, I¯, Br¯, Cl¯) при их достаточной концентрации легко окисляются до соответствующих простых веществ.
2) При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также плавиковой кислоты и фторидов происходит электрохимическое окисление воды с выделение кислорода:
в щелочных растворах: 4OH¯ - 4e- → O2 + 2H2O
в кислых и нейтральных растворах: 2H2O - 4e- → O2 + 4H+
15.3. Количественно процессы электролиза оцениваются законами Фарадея: масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Закон выражается уравнением где m - масса образовавшегося или подвергшегося превращению вещества; М - мольная масса этого вещества; n - число молей электронов, участвующих в процессе образования 1 моля вещества; I - сила тока, А; t - время электролиза, с; F - постоянная Фарадея, (96500 Kл/моль); Э - эквивалентная масса вещества; Для вычисления объема выделяющегося газа (V) уравнение имеет вид: где V э = При нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, а кислорода 5,6 л/моль. Выходом по току называют ту долю от общего количества электричества (Q = I * t), которая расходуется на данную электродную реакцию или отношение массы выделившегося вещества m практ к теоретически возможной m теор по уравнению Фарадея Примеры решения задач. П р и м е р 1. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 часа при силе тока 4А? Р е ш е н и е. Согласно законам Фарадея: m = ЭIt/96500, (1) где m – масса вещества, окисленного или восстановленного на электроде; Э – эквивалентная масса вещества; I – сила тока, А; t – продолжительность электролиза, с. Эквивалентная масса меди в CuSO4 равна 63,54
П р и м е р 2. Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880Кл электричества и на катоде выделяется 11,742г металла. Р е ш е н и е. Из формулы (1): Э = 11,742 где m = 11,742г; It = Q = 3880Кл. П р и м е р 3. Чему равна сила тока при электролизе раствора в течение 1ч 40мин 25с, если на катоде выделилось 1,4л водорода (н.у.)?
Р у ш е н и е. Из формулы (1): I = m Так как дан объем водорода, то отношение m/Э заменяем отношением VH Эквивалентный объем водорода при н. у. равен половине молярного объема 22,4/2 = 11,2л. Подставив в приведенную формулу значения VH П р и м е р 4. Какая масса гидроксида калия образовалась у катода при электролизе раствора К2SO4, если на аноде выделилось 11,2л кислорода (н. у.)? Р е ш е н и е. Эквивалентный объем кислорода (н. у.) 22,4/4 = 5,6л. Следовательно, 11,2л содержат две эквивалентные массы кислорода. Столько же эквивалентных масс KOH образовалось у катода, или 56,11 Задания для контрольных работ. 281. Электролиз раствора К2SO4 проводили при силе тока 5А в течение 3ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н. у.), выделившихся на катоде, аноде? Ответ: 5,03г; 6,266л; 3,133л. 282. При электролизе соли некоторого металла в течение 1,5ч при силе тока 1,8А на катоде, выделилось 1,75г этого металла. Вычислите эквивалентную массу металла. Ответ: 17,37г/моль. 283. При электролизе раствора CuSO4 на аноде выделилось 168см3 (н. у.) газа. Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде. Ответ: 0,953г. 284. Электролиз раствора Na2SO4 проводили в течение 5ч при силе тока 7А. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н. у.), выделившихся на катоде и аноде? Ответ: 11,75г; 14,62л; 7,31л. 285. Электролиз раствора нитрата серебра проводили при силе тока 2А в течение 4ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде и каков объем газа (н. у.), выделившегося на аноде? Ответ: 32,20г; 1,67л. 286. Электролиз раствора сульфата некоторого металла проводили при силе тока 6А в течение 45мин, в результате чего на катоде выделилось 5,49г металла. Вычислите эквивалентную массу металла. Ответ: 32,7г/моль. 287. Насколько уменьшится масса серебряного анода, если электролиз раствора AgNO3 проводить при силе тока 2А в течение 387мин 20с? Составьте электронные уравнения процессов, происходящих на графитовых электродах. Ответ: 4,47г. 288. Электролиз раствора сульфата цинка проводили в течение 5ч, в результате чего выделилось 6л кислорода (н. у.). Составьте уравнения электродных процессов и вычислите силу тока. Ответ: 5,74А. 289. Электролиз раствора CuSO4 проводили с медным анодом в течение 4 ч при силе тока 50А. При этом выделилось 224г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Ответ: 94,48%. 290. Электролиз раствора NaI проводили при солее тока 6А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу вещества, выделившегося на катоде и аноде. Ответ: 0,56г; 71,0г. 291. Составите электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора AgNO3. Если электролиз проводить с серебряным анодом, то его масса уменьшается на 5,4г. Определите расход электричества при этом. Ответ: 4830Кл.
292. Электролиз раствора CuSO4 проводили в течение 15мин при силе тока 205А. Выделилось 0,72г меди. Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Вычислите выход по то. Ответ: 97,3% 293. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплавов и водных растворов NaCl и KOH. Сколько литров (н. у.) газа выделится на аноде при электролизе гидроксида калия, если электролиз проводить в течение 30мин при силе тока 0,5А? Ответ: 0,052л. 294. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора KBr. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1ч 35мин при силе тока 15А? Ответ: 0,886г; 70,79г. 295. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора CuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н. у.). Ответ: 1,588г. 296. При электролизе соли трехвалентного металла при силе тока 1,5А в течение 30мин на катоде выделилось 1,071г металла. Вычислите атомную массу металла. Ответ: 114,82. 297. При электролизе растворов MgSO4 и ZnCl2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25г водорода. Какая масса вещества выделится на другом катоде? на анодах? Ответ: 8,17г; 8,86г. 298. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора Na2SO4. Вычислите массу вещества, выделившегося на катоде, если на аноде выделяется 1,12л газа (н. у.). Какая масса H2SO4 образуется при этом возле анода? Ответ: 0,2г; 9,8г. 299. При электролизе раствора соли кадмия израсходовано 3434Кл электричества. Выделилось 2г кадмия. Чему равна эквивалентная масса кадмия? Ответ: 56,26г/моль. 300. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора KOH. Чему равна сила тока, если в течение 1ч 15мин 20с на аноде выделилось 6,4 газа? Сколько литров газа (н. у.) выделилось при этом на катоде? Ответ: 17,08А; 8,96л.
ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. 16.1. Металлами являются большинство элементов периодической системы Д.И. Менделеева. Физические, механические и химические (восстановительные) свойства металлов в основном обусловлены содержанием в них «свободных» электронов. В твердом состоянии металлы отличаются от остальных веществ высокой теплопроводностью и электрической проводимостью, полной непрозрачностью, высокой отражательной способностью по отношению к видимому свету (металлическим блеском).
Металлы обладают специфическими механическими свойствами: куются, прокатываются, вытягиваются, некоторые имеют большую прочность при натяжении или сжатии. При взаимодействии металлов с атомами неметаллов химическая активность металлов определяется его энергией ионизации. Мерой восстановительной способности металла в реакциях с растворами электролитов является электродный потенциал металла. Металлы проявляют сильные восстановительные свойства, то есть, способны отдавать электроны, переходя в положительно заряженные ионы. По степени химической активности металлы располагают в ряд напряжений. CuSO4 + Fe ® FeSO4 + Cu красный цвет Сu2+ + Fe ® Fe2+ + Cu
1) Ca + H2 ® Ca2+ + H–12 гидриды 2) W + C ® WC карбиды 3) 2Fe + O2 ® 2FeO оксиды 4) Fe + S ® FeS сульфид 5) Fe + Cl2 ® FeCl2 хлорид 6) 2Na + 2H2O ® 2NaOH + H2 с водой Ca + 2H2O ® Ca(OH)2 + H2 7) Mg + 2HCl ® MgCl2 + H2 с кислотой 3H2SO4 + 2Al ® Al2(SO4)3 + 3H2
H2S+6O4 Zn S0 S+6 восстанавливается Ca H2S–2
Тяжелые металлы NO2 HNO3 Щелочные N2O
щелоч. щ – з. Sn, Fe NH3 (NH4NO3)
HNO3 тяжелые металлы NO разб.
|
||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 81; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.200.197 (0.053 с.) |
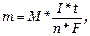 или
или 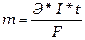 , (6)
, (6)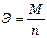 . (7)
. (7)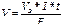 , (8)
, (8)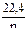 ; V э - эквивалентный объем газа.
; V э - эквивалентный объем газа.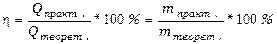 . (9)
. (9) 2 = 31,77г/моль. Подставив в формулу (1) значения Э = 31,77; I = 4А; t = 60
2 = 31,77г/моль. Подставив в формулу (1) значения Э = 31,77; I = 4А; t = 60  60 = 3600с, получим:
60 = 3600с, получим: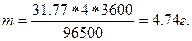

 − объем водорода, л; VЭ(H
− объем водорода, л; VЭ(H  ) – эквивалентный объем водорода, л. Тогда I = VH
) – эквивалентный объем водорода, л. Тогда I = VH  Cu SO2
Cu SO2 Fe, Cl пассивируют
Fe, Cl пассивируют



