
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Идеальный газ. Уравнение клапейрона – менделеева. Основное Уравнение молекулярно-кинетической теории (мкт) газов. Молекулярно-кинетическое толкование температуры. Средняя квадратичная скорость
Молекулярная физика (МФ) и термодинамика (ТД) изучают строение и свойства вещества. Вещество – это макроскопическая система, состоящая из большого числа частиц: от В молекулярно-кинетической теории (МКТ) используется модель идеальный газ, согласно которой 1) суммарный объем молекул мал по сравнению с объемом сосуда, 2) молекулы движутся хаотически и не взаимодействуют друг с другом, 3) соударения мол-л между собой и со стенкой сосуда – абсолютно упругие. Реальные газы при низких давлениях (до Уравнение состояния ид. газа – это уравнение Клапейрона–Менделеева:
где p Связь физических постоянных:
где Введем параметр состояния газа
Мол-лы газа, совершая хаотическое движение, в соударениях изменяют свою скорость, поэтому в газе есть молекулы с различными скоростями в интервале от 0 до Эта ф-ла показывает, что температура газа где i – суммарное число степеней свободы молекулы газа:
Для молекул при невысоких температурах (
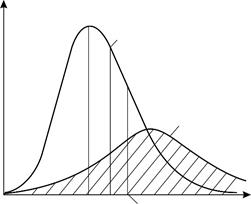
Средняя квадратичная скорость молекулы определяется по средней кинетической энергии поступательного дв-я мол-лы: 28. Понятие вероятности, функция распределения Закон Максвелла описывается функцией
Здесь
 или или  , ,
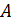 – постоянная, не зависящая от скорости; m – масса молекулы. На графике функция имеет вид кривой с максимумом. – постоянная, не зависящая от скорости; m – масса молекулы. На графике функция имеет вид кривой с максимумом.
Площадь под кривой функции
 , ,
 – наиболее вероятная скорость молекулы, она соответствует максимуму кривой распределения. Из условия максимума функции – наиболее вероятная скорость молекулы, она соответствует максимуму кривой распределения. Из условия максимума функции 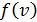 получена величина получена величина
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-28; просмотров: 171; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.215.75 (0.007 с.) |
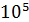 до
до  и более.
и более.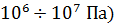 и высоких температурах (T
и высоких температурах (T 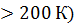 по своим свойствам близки к ид. газу. Наиболее точно модели ид. газа соответствуют разреженные газы, особенно в вакууме.
по своим свойствам близки к ид. газу. Наиболее точно модели ид. газа соответствуют разреженные газы, особенно в вакууме. ,
,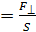 – давление газа, равное силе
– давление газа, равное силе 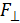 , с которой молекулы при ударах действуют по нормали на стенку сосуда площадью
, с которой молекулы при ударах действуют по нормали на стенку сосуда площадью 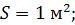 V – объем сосуда; m и M – масса газа и молярная масса (масса одного моля);
V – объем сосуда; m и M – масса газа и молярная масса (масса одного моля); 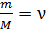 – количество вещества, оно измеряется числом молей
– количество вещества, оно измеряется числом молей 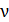 , которое равно также
, которое равно также 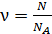 , где N – число молекул газа;
, где N – число молекул газа; 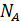 – число Авогадро;
– число Авогадро;  – молярная газовая постоянная; T – термодинамическая температура, измеряется в кельвинах (К),
– молярная газовая постоянная; T – термодинамическая температура, измеряется в кельвинах (К),  , где t – температура по Международной практической шкале, измеряется в градусах Цельсия (
, где t – температура по Международной практической шкале, измеряется в градусах Цельсия (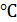 ).
). ,
, – число Авогадро, это число молекул в одном моле вещества;
– число Авогадро, это число молекул в одном моле вещества; 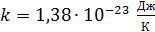 – постоянная Больцмана.
– постоянная Больцмана.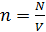 – концентрация молекул (их число в единице объема), и уравнение состояния ид. газа:
– концентрация молекул (их число в единице объема), и уравнение состояния ид. газа: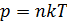 .
. (но следует иметь в виду, что даже большие скорости молекул
(но следует иметь в виду, что даже большие скорости молекул 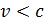 , равной
, равной 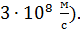 Поэтому вводят средние характеристики молекул. Согласно закону Больцмана о равномерном распределении энергии молекул по степеням свободы, средняя энергия молекулы
Поэтому вводят средние характеристики молекул. Согласно закону Больцмана о равномерном распределении энергии молекул по степеням свободы, средняя энергия молекулы 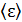 зависит от температуры газа T:
зависит от температуры газа T: .
.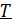 - это мера энергии молекулы.
- это мера энергии молекулы.  .
. ) величина
) величина  .
.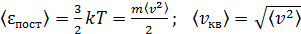 ;
;  .
.  . Распределение молекул по скоростям – распределение Максвелла. Наиболее вероятная скорость молекул
. Распределение молекул по скоростям – распределение Максвелла. Наиболее вероятная скорость молекул
 .
.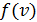 – функция распределения молекул по скоростям; она равна доле молекул, имеющих скорости в единичном интервале
– функция распределения молекул по скоростям; она равна доле молекул, имеющих скорости в единичном интервале 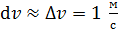 вблизи данной скорости
вблизи данной скорости 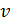 . Закон распределения молекул ид. газа по скоростям:
. Закон распределения молекул ид. газа по скоростям: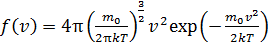 ,
,


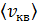
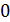
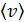
 .
.


