Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рассчитаем состав химических соединений.
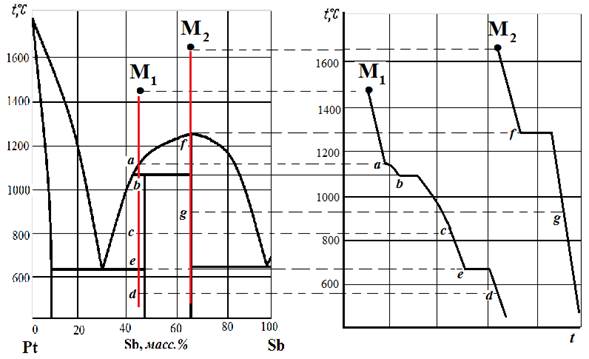
М(Pt) = 195 г/моль; М(Sb) = 121 г/моль. 1) Неустойчивое химическое соединение D 1.
По диаграмме определяем соотношение масс компонентов:
mPt = 5 3 .
Рассчитываем формулу химического соединения: m S b 47 nPt = mPt / M Pt = 53 / 195 = 0, 2 7 » 2 n S b m S b / M S b 47 / 121 0,39 3 Следовательно, формула неустойчивого химического соединения P t 2 Sb 3. 2)Устойчивое химическое соединение D. mPt = 35 По диаграмме определяем соотношение масс компонентов:
Рассчитываем формулу химического соединения: nPt = mPt / M Pt = 35 / 195 = 0, 1 8 » 1
m S b 65. n Sb m S b / M Sb 65 /121 0,54 3 Следовательно, формула устойчивого химического соединения PtSb 3.
Таблица 1
Точка М 2 отвечает составу устойчивого (конгруэнтно плавящегося) химического соединения D. Таблица 2
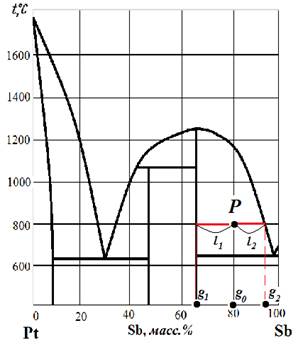
На диаграмме состояния поставим точку Р, соответствующую температуре 800ºС и 80 масс.% Sb. В точке Р в равновесии находятся кристаллы устойчивого химического соединения D и расплав. Опреде- лим соотношение между фазами по правилу рычага: mD = g 2 - g 0 = l 2 = 93 - 80 = 13 m расплава g 0 - g 1 l 1 80 - 65 15 Из условия задачи следует, что m D + m ра с п л а в а = 500 г. Решаем совместно систему двух уравнений: m D = 500 - m р 500 - m p = 13 ; m р 15 15 × (500 - m р) = 13 × m p 6500 - 15 × m р = 13 × m p 6500 = 28 × m p m p аа с п л а в а = 232 г m D = 500 - 232 = 267 г Таким образом, из 500 г первоначального состава масса расплава составит 232 г, а масса кристаллов химического соединения D 267 г. Задачи для самостоятельного решения
На приведенной диаграмме состояния системы (номер рисунка на диаграмме соответствует номеру варианта): 1. Указать смысл всех полей, линий и характерных точек. 2. Рассчитать формулы химических соединений. 3. Рассмотреть процесс охлаждения расплава, заданного точками М 1 и М 2 (определить, что происходит в данной точке, определить число фаз и число степеней свободы в точке). Результаты представить в виде таблицы. 4. Построить кривые охлаждения из точек М 1 и М 2. 5. Определить соотношение фаз по правилу рычага при заданных температуре и составе системы. 6. При заданных температуре и составе системы рассчитать массы равновесных фаз, полученных из 500 г первоначального состава.
69
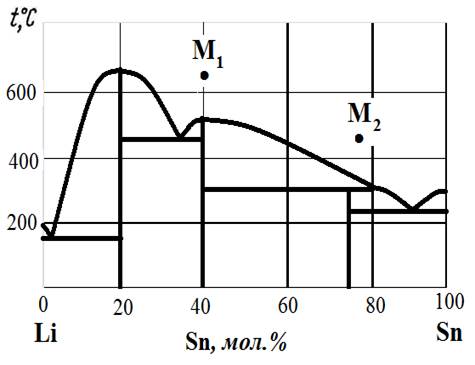
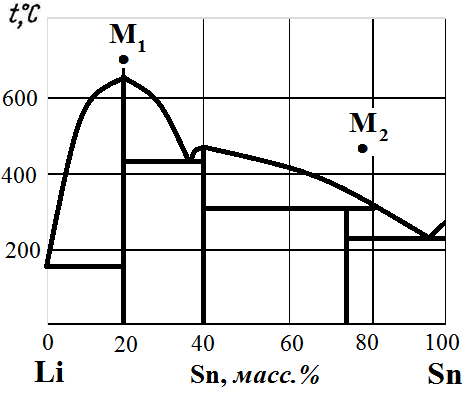
Рис.1. Диаграмма состояния Li – Sn.
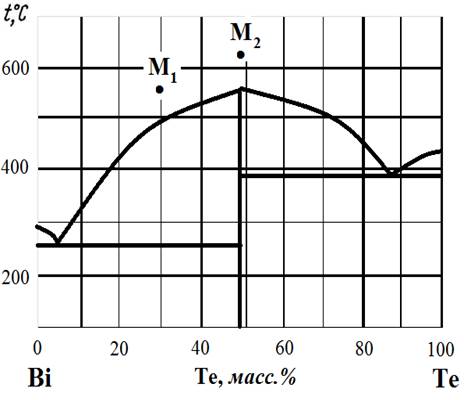
Рис.2. Диаграмма состояния Bi – Te.
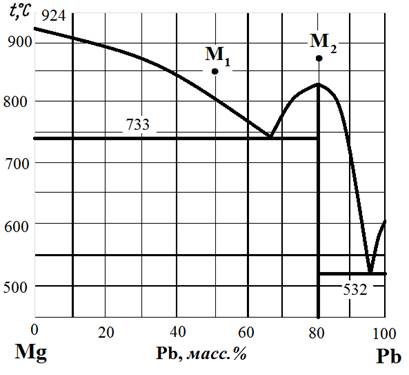
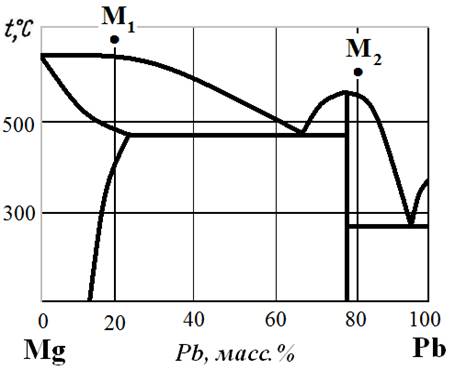
Рис. 3. Диаграмма состояния Mg – Pb
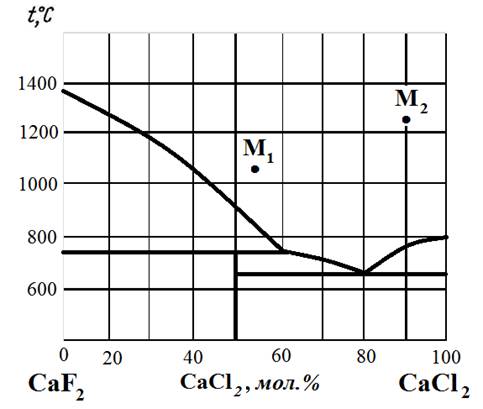
Рис.5. Диаграмма состояния CaF2 – CaCl2.
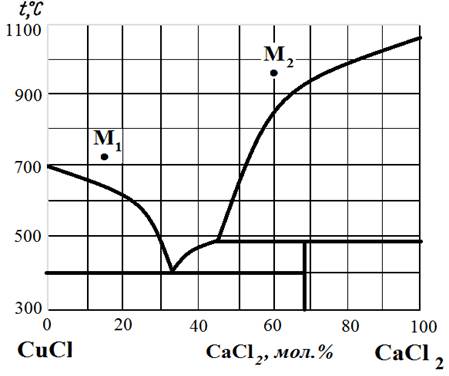
Рис.6. Диаграмма состояния CuCl – CaCl2
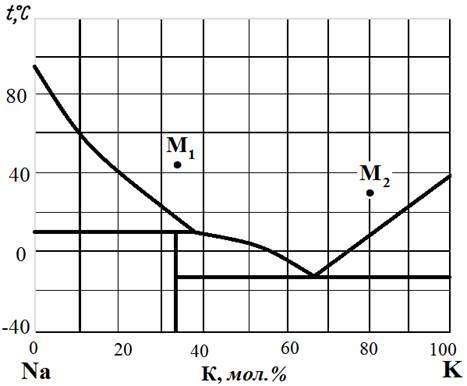
Рис.7. Диаграмма состояния Na – K.
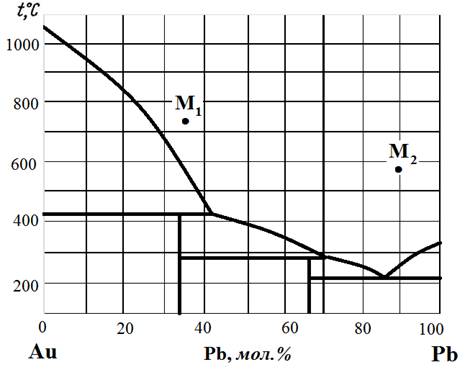
Рис.8. Диаграмма состояния Au – Pb.
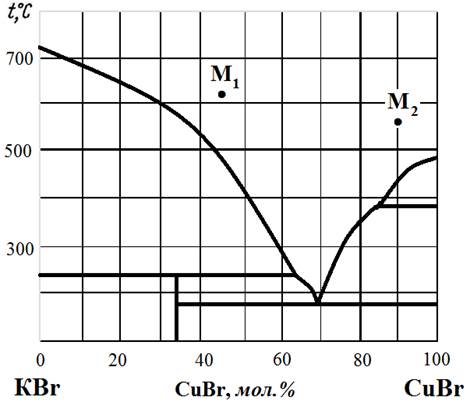
Рис.9. Диаграмма состояния KBr – CuBr.
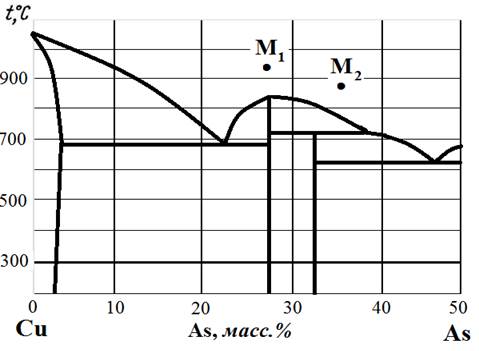
Рис.10. Диаграмма состояния Cu – As.
74
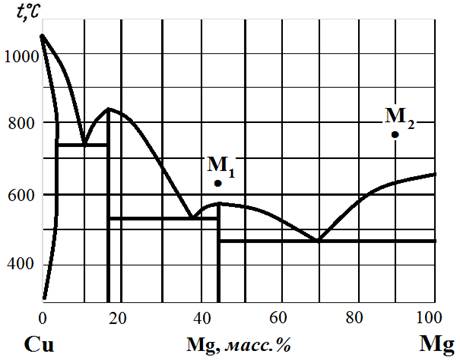
Рис.11. Диаграмма состояния Cu – Mg.
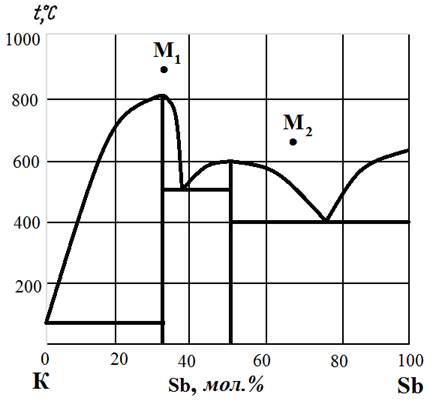
Рис.12. Диаграмма состояния K – Sb.
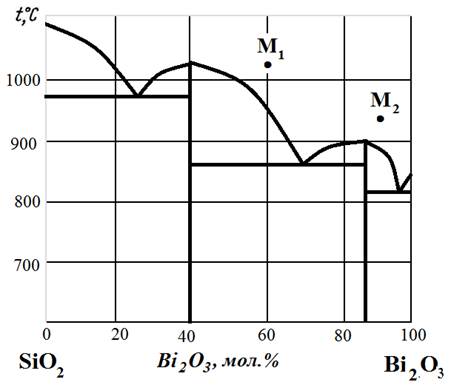
Рис.13. Диаграмма состояния SiO2 – Bi2O3.
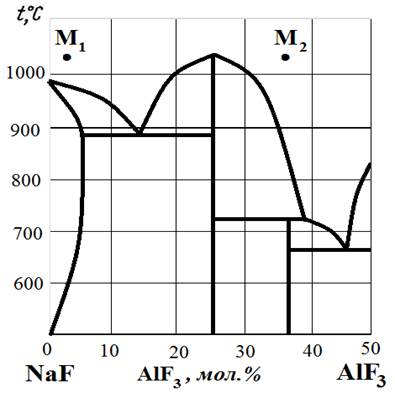
Рис.14. Диаграмма состояния NaF – AlF3.
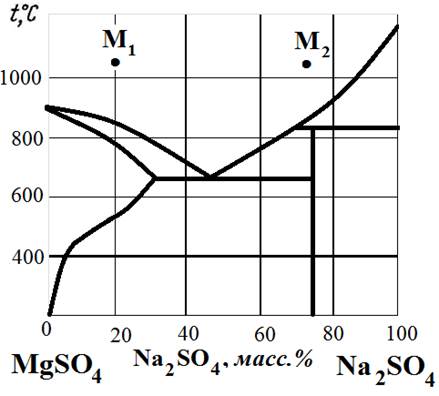
Рис.15. Диаграмма состояния MgSO4 – Na2SO4.
Рис.16. Диаграмма состояния Li – Sn.
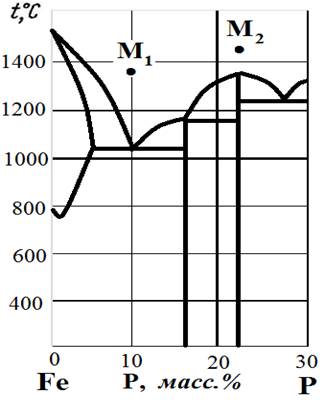
Рис.17. Диаграмма состояния Fe – P.
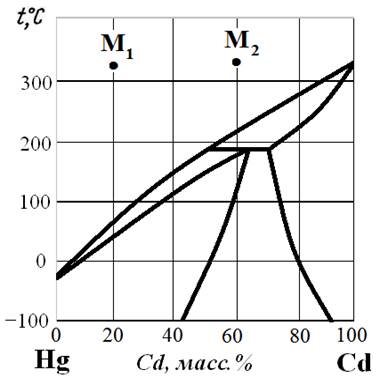
Рис.18. Диаграмма состояния Hg – Cd.
78
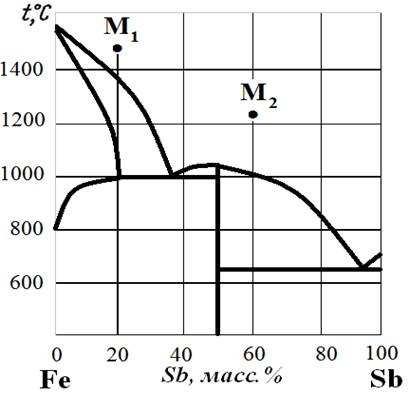
Рис.19. Диаграмма состояния Fe – Sb.
Рис.20. Диаграмма состояния Mg – Pb.
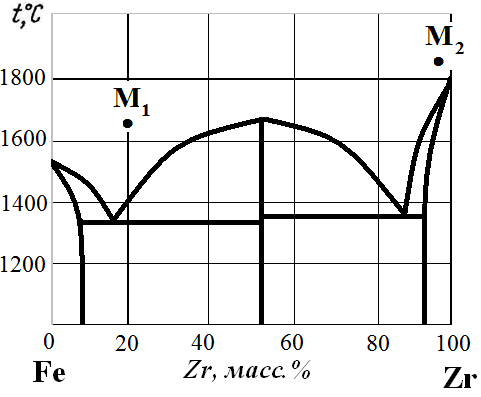
Рис.21. Диаграмма состояния Fe – Zr.
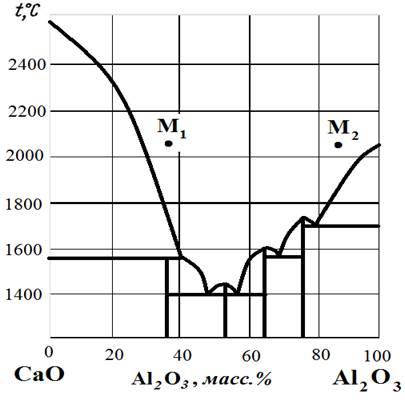
Рис.22. Диаграмма состояния CaO – Al2O3.
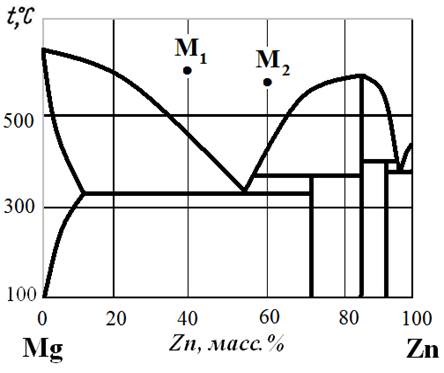
Рис.23. Диаграмма состояния Mg – Zn.
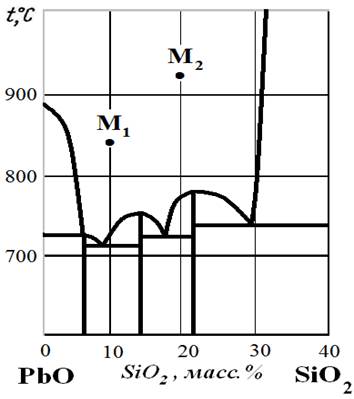
Рис.24. Диаграмма состояния PbO – SiO2.
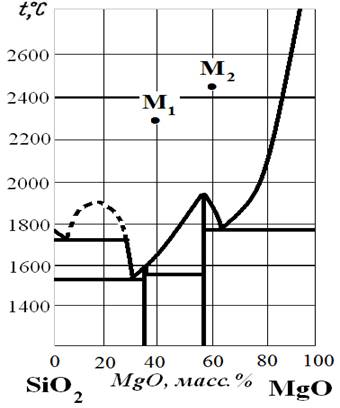
Рис.25. Диаграмма состояния SiO2 – MgO.
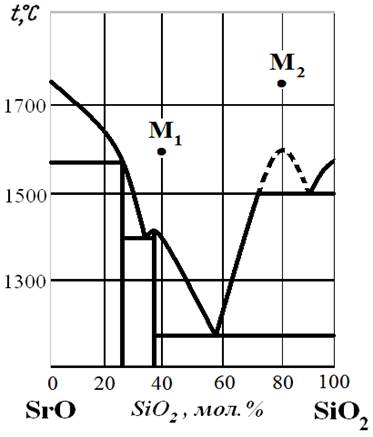
Рис.27. Диаграмма состояния SrO – SiO2.
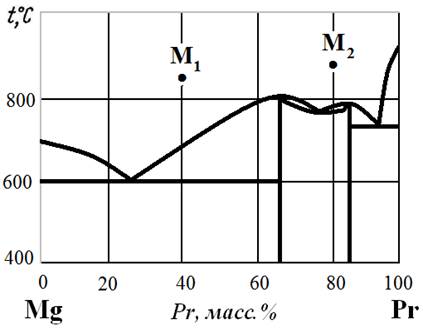
Рис.28. Диаграмма состояния Mg – Pr.
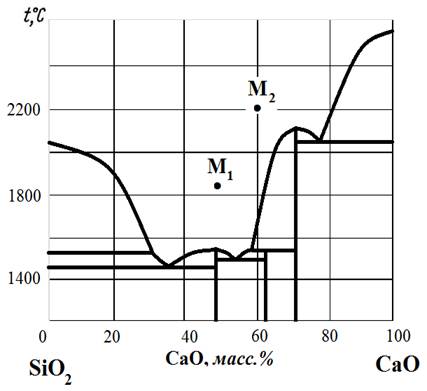
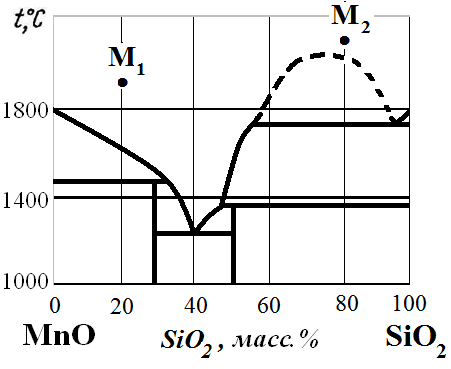
Рис.29. Диаграмма состояния MnO – SiO2.
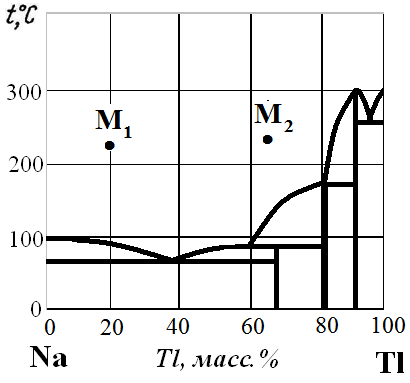
Рис.30. Диаграмма состояния Na – Tl. РАСТВОРЫ
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 1290; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.81.94 (0.039 с.) |