Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства магния и его применениеСтр 1 из 7Следующая ⇒
Свойства магния и его применение Магний - серебристо-белый металл открыт в 1808г. Дэви - химический элемент 2-й группы Периодической системы Д.И.Менделеева. Порядковый номер 12, атомная масса 24. Наличие двух электронов на внешней оболочке магний в соединениях двухвалентен. Основные свойства металла: - плотность твердого Мд (250С), г/см3; жидкого (6500С), г/см3 – 1,59 - Температура плавления, 0С – 651; кипения – 1107 - Теплопроводность при 200С, кал/(см*с*град) – 0,37 - Удельное электрическое сопротивление при 250С, мкОм*см – 4,45 - Нормальный потенциал, В -2,38 - Вязкость при 6510С, сП – 1,228 - Электрохимический эквивалент, г/(А*ч) - 0,454 Магний обладает высокой химической активностью к кислороду, скоторым он взаимодействует по реакциям: Мд ТВ,ж,г + ½ О2 = МдО ТВ Магний в виде чушки, слитка практически не взаимодействует с холодной водой, а с горячей по реакции: Мд + 2Н2О = Мд (ОН)2 + Н2 С водяным паром: Мд ТВ + Н2О г= МдОтв + Н2г Последняя реакция идет с заметной скоростью, начиная при 3800С, и резко ускоряется с повышением температуры. Поэтому тушение горящего магния водой не допустимо. На воздухе при комнатной температуре магний медленно окисляется, покрываясь пленкой оксида. При повышении температуры скорость окисления магния кислородом увеличивается. Порошкообразный магний или в виде тонкой ленты легко поджигается и горит ослепительным белым пламенем. Жидкий магний также легко загорается, а вот в слитках или изделиях магний не огнеопасен. Магний энергично взаимодействует с галогенами – с хлором образуя МдС12 Магний интенсивно растворяется в разбавленных кислотах, с растворами щелочей, особенно разбавленными, Мд практически не взаимодействует. В водных растворах солей металл заметно подвергается коррозии, и особенно это наблюдается в растворах хлоридов. Характер взаимодействия магния с металлами имеет большое разнообразие, что объясняется электронной структурой строения атома, различием валентности металла-растворителя и растворенного металла. Это находит свое применение при создании сплавов на основе Мд с А1, цинком, литием и др. Хорошо растворяются в магнии медь, марганец, не растворяется в расплавленном магнии железо, что используется при для плавке и транспортировки магния и его сплавов в стальных ковшах, плохо растворяется в металле титан.
На практике магний в чистом виде не применяется, а только в виде сплавов с другими металлами. Легирование магния повышают механические, литейные свойства, химическую стойкость одновременно при их невысокой плотности, что находит широкое применение им. Применение магния 1.Машиностроение- сплавы магния хорошо воспринимают ударные нагрузки, они не магнитны и не дают искры при ударе и их используют для изготовлении узлов и деталей автомобилей, транспортных средств, точном машиностроении, приборостроении, текстильной промышленности. 2.В электротехнической промышленности в качества анода в гальванических элементах. 3.Способность магния и его сплавов давать при горении яркий свет и развивать высокую температуру используют в военной технике для изготовления осветительных и зажигательных бомб. 4.В металлургии в качестве раскислителя и очистителя при производстве сталей; в качестве модификатора для получения сверхпрочного чугуна; в качестве восстановителя при производстве титана. 5.В химической промышленности магний применяют для обезвоживания органических соединений. 6.При производстве огнеупорных изделий. 7.Соединения магния находят применение в отраслях народного хозяйства: медицина и косметология (магнезия, бишофит); в резиновых смесях и для очистки нефтепродуктов (МдО), асбест (2МдО*2S1О2*2 Н2О) используется для изготовления теплоизоляционных материалов, огнестойких тканей. 8.Военнаяи космическая техника.
Общая характеристика магниевых электролизеров. Рафинирование магния Примеси в мании – сырце. Жидкий магний-сырец, извлекаемый из электролизера содержит примеси, которые отрицательно влияют на свойства магния. Все примеси можно разделить на: 1. Неметаллические - это хлориды, входящие в состав электролита и оксиды магния, нитриды. Оксид получается при горении магния, при этом он может реагировать с азотом воздуха, образуя нитрид. Силицид магния - это продукт взаимодействия жидкого магния с огнеупорами.
2. металлические примеси – это калий, натрий, кальций, железо и др. металлы. Первые три выделяются на катоде при определенных условиях. Железо попадает в магний при его взаимодействии с хлором и при выделении его на катоде. Железо растворяется в жидком магнии при его соприкосновении со стальными деталями ванны. Примеси ухудшают механические свойства магния и его сплавов, снижают коррозионную стойкость (МдС12 и ВаС12), вкрапленные в поверхностный слой детали эти частицы взаимодействуют с влагой и вследствие гидролиза образуется соляная кислота, разрушающая детали изделия. Металлические примеси никель, медь, кремний, натрий ухудшают пластичность сплавав. По указанным причинам магний-сырец подвергается рафинированию. Способы рафинирования магния. Отстаивание, рафинирование флюсами, металлотермические методы, электролитическое рафинирование, зонная плавка, вакуумная возгонка, фильтрация. Сумма требований к степени чисты металла определяет выбор способа рафинирования. Рафинирование флюсами широко распространен в металлургии Мд. Флюсы используют сразные по составу в зависимости от назначения. Флюсы покровные, расплавляясь на поверхности магния образуют плотный слой, хорошо защищающий металл от взаимодействия с воздухом и парами воды. Плотность флюса д.б. ниже плотности магния. Рафинирующие флюсы имеют плотность выше плотности Мд. Механизм действия флюса заключается в томя. что флюс поглощает (за счет смачивания) твердые включения, взаимодействует с некоторыми металлическими примесями (МдС12 + Ме = МеС12 + Мд) т.е. примесь вытесняет магний из флюса, а сама переходит во флюс и с ним опускается на дно.
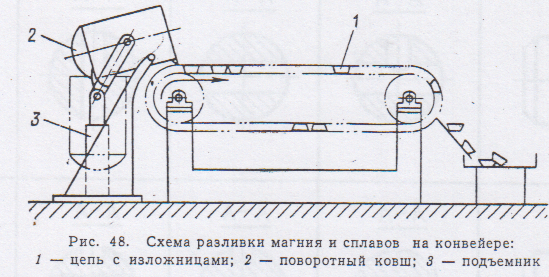
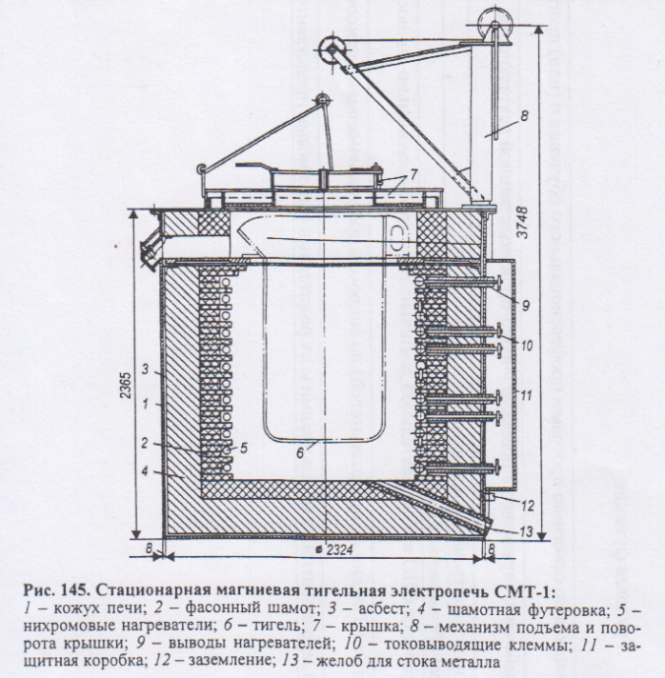
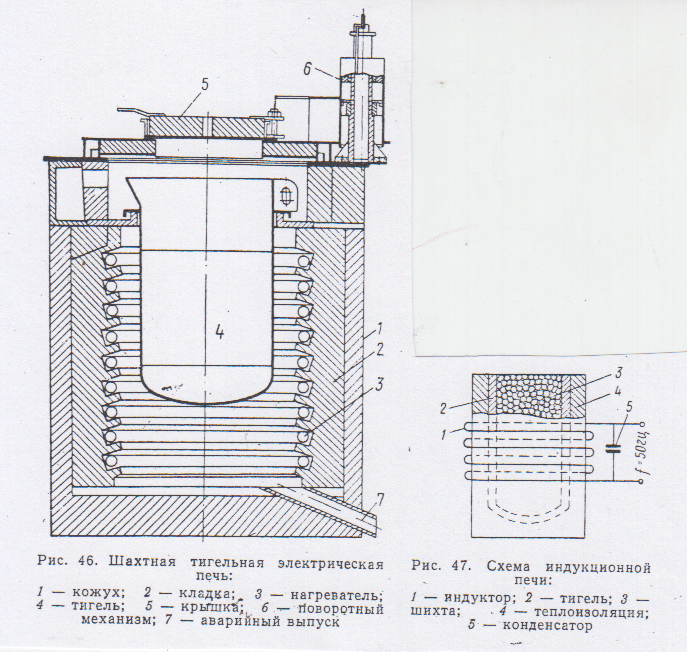
Для рафинирования магния и его сплавов применяют тигельные электропечи сопротивления. В тигель с загруженным флюсом, при 6900С заливают магний вакуум- ковшом. Металл перемешивают вместе с флюсом, нагревают до 7200С и при этой температуре отстаивают 1-2 часа. разливают в чушку
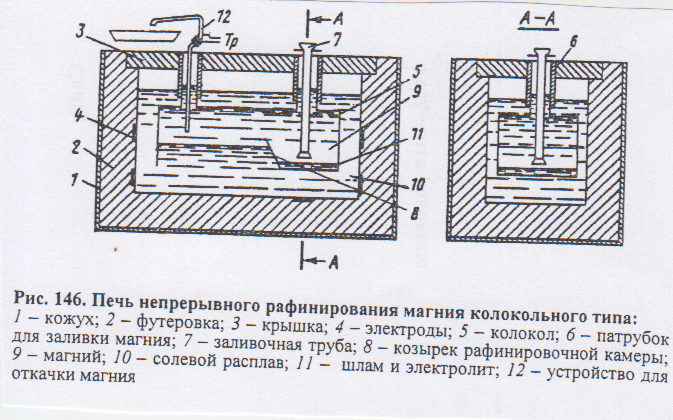
Печи непрерывного рафинирования. Здесь используется рафинирование отстаиванием. Печь состоит из двух камер, разделенных керамической перегородкой, в нижней части которой есть переточное отверстие. Донные части камер имеют коническую форму, заполненную солевым расплавом. Нагрев идет за счет трубчатых солевых нагревателей, опущенных в металл(7200С). Заливка металла в камеру идет через стальную трубу, доходящую почти до дна камеры. Извлечение магния происходит из другой камеры вакуум – ковшом или насосом. Зеркало металла покрывают укрывные флюсы. очищенный металл подают на разливочные машины. Рафинирование возгонкой притеняется для очистки от металлических и солевых примесей. Очистка возгонкой основана на различии давления паров магния и примесей. Процесс ведут в стальных ретортах. Нижняя часть реторты обогревается, верхняя – охлаждается, внутри создается разряжение, температура возгонки 575-6000С, а в конденсаторе 475-5500С. Значения температур (0С) кипения элементов при атмосферном давлении и в вакууме: Мд -1107/516; Fe -2735/1564; Cu -2595/1412; Si-2787/1572, Al – 2560/1110, Ca -1487/688 K-1407/704, Na - 892/340, KCL – 1407/704, NaCl – 1465/743 Пары магния и более летучих компонентов осаждаются в конденсаторе в виде крупных кристаллов. Остальные примеси остаются в нижней части реторты. После окончания процесса Мд из конденсаторы извлекают, переплавляют и разливают в чушку. Метод позволяет получить металл чистотой 99,99 % Мд.
Электролитическое рафинирование магния применяют для очистки от металлических примесей Метод дают такую же чистоту как и возгонка, но процесс непрерывный и более дешевый.
Свойства магния и его применение Магний - серебристо-белый металл открыт в 1808г. Дэви - химический элемент 2-й группы Периодической системы Д.И.Менделеева. Порядковый номер 12, атомная масса 24. Наличие двух электронов на внешней оболочке магний в соединениях двухвалентен. Основные свойства металла: - плотность твердого Мд (250С), г/см3; жидкого (6500С), г/см3 – 1,59 - Температура плавления, 0С – 651; кипения – 1107 - Теплопроводность при 200С, кал/(см*с*град) – 0,37 - Удельное электрическое сопротивление при 250С, мкОм*см – 4,45 - Нормальный потенциал, В -2,38 - Вязкость при 6510С, сП – 1,228 - Электрохимический эквивалент, г/(А*ч) - 0,454 Магний обладает высокой химической активностью к кислороду, скоторым он взаимодействует по реакциям: Мд ТВ,ж,г + ½ О2 = МдО ТВ Магний в виде чушки, слитка практически не взаимодействует с холодной водой, а с горячей по реакции: Мд + 2Н2О = Мд (ОН)2 + Н2 С водяным паром: Мд ТВ + Н2О г= МдОтв + Н2г Последняя реакция идет с заметной скоростью, начиная при 3800С, и резко ускоряется с повышением температуры. Поэтому тушение горящего магния водой не допустимо. На воздухе при комнатной температуре магний медленно окисляется, покрываясь пленкой оксида. При повышении температуры скорость окисления магния кислородом увеличивается. Порошкообразный магний или в виде тонкой ленты легко поджигается и горит ослепительным белым пламенем. Жидкий магний также легко загорается, а вот в слитках или изделиях магний не огнеопасен. Магний энергично взаимодействует с галогенами – с хлором образуя МдС12 Магний интенсивно растворяется в разбавленных кислотах, с растворами щелочей, особенно разбавленными, Мд практически не взаимодействует. В водных растворах солей металл заметно подвергается коррозии, и особенно это наблюдается в растворах хлоридов. Характер взаимодействия магния с металлами имеет большое разнообразие, что объясняется электронной структурой строения атома, различием валентности металла-растворителя и растворенного металла. Это находит свое применение при создании сплавов на основе Мд с А1, цинком, литием и др. Хорошо растворяются в магнии медь, марганец, не растворяется в расплавленном магнии железо, что используется при для плавке и транспортировки магния и его сплавов в стальных ковшах, плохо растворяется в металле титан.
На практике магний в чистом виде не применяется, а только в виде сплавов с другими металлами. Легирование магния повышают механические, литейные свойства, химическую стойкость одновременно при их невысокой плотности, что находит широкое применение им. Применение магния 1.Машиностроение- сплавы магния хорошо воспринимают ударные нагрузки, они не магнитны и не дают искры при ударе и их используют для изготовлении узлов и деталей автомобилей, транспортных средств, точном машиностроении, приборостроении, текстильной промышленности. 2.В электротехнической промышленности в качества анода в гальванических элементах. 3.Способность магния и его сплавов давать при горении яркий свет и развивать высокую температуру используют в военной технике для изготовления осветительных и зажигательных бомб. 4.В металлургии в качестве раскислителя и очистителя при производстве сталей; в качестве модификатора для получения сверхпрочного чугуна; в качестве восстановителя при производстве титана. 5.В химической промышленности магний применяют для обезвоживания органических соединений. 6.При производстве огнеупорных изделий. 7.Соединения магния находят применение в отраслях народного хозяйства: медицина и косметология (магнезия, бишофит); в резиновых смесях и для очистки нефтепродуктов (МдО), асбест (2МдО*2S1О2*2 Н2О) используется для изготовления теплоизоляционных материалов, огнестойких тканей. 8.Военнаяи космическая техника.
|
||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 117; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.222.175 (0.03 с.) |