Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы функциональной оценки обструктивных нарушений вентиляции
Обструктивные расстройства могут быть обнаружены как сложными методами изучения механики дыхания, так и с помощью простейших спирографических и волюмометрических тестов. Как следует из всего изложенного, при обструктивных нарушениях дыхания меняется величина различных легочных объемов, измеренная в динамике, т.е. в единицу времени. Повышенное сопротивление дыхательных путей сокращает динамические величины, хотя статические объемы и емкости могут сохраняться нормальными. Поэтому, при обструктивных нарушениях, остаточный объем легких (ООЛ) и показатель отношения ООЛ к общей емкости легких (ОЕЛ), как правило, увеличиваются; жизненная емкость легких (ЖЕЛ) обычно уменьшена, а дыхательный объем (ДО) смещен в сторону резервного объема вдоха. Для обструктивных расстройств весьма характерно снижение динамических объемов легких – объема форсированного выдоха и максимальной вентиляции легких. Эти изменения могут быть использованы в качестве простейших функциональных тестов для установления нарушений бронхиальной проходимости в случае сохранения статических объемов легких: ДО, ООЛ, ЖЕЛ. Основное место в клинической практике определения нарушений бронхиальной проходимости занимает форсированная спирометрия. Для ее осуществления необходимо определить два показателя: объем односекундного форсированного выдоха и ЖЕЛ. Многочисленные экспериментальные и клинические исследования свидетельствуют о том, что в наибольшей зависимости от прилагаемого усилия для осуществления выдоха находится скорость воздушного потока в начале форсированного выдоха. Именно поэтому принято определять объем газа, выдыхаемый за первую секунду форсированного выдоха (ОФВ1). Этот показатель часто выражают в процентах от ЖЕЛ (ФЖЕЛ1), так называемый индекс Тиффно. Снижение этого отношения до величины 70 % и менее однозначно свидетельствует о нарушении проходимости дыхательных путей. На сегодняшний день наиболее употребимы в клинической практике две скрининговые методики динамических потоковых проб: пикфлоуметрия и пневмотахометрия. Пикфлоуметры – это портативные измерители потока, основанные на принципе преодоления дыхательным потоком пружины цилиндра, который связан с указательной стрелкой. Значение в виде максимального воздушного потока в л/мин считываются непосредственно со шкалы прибора. Пневмотахометрия основана на дифференциальной манометрии перепадов давления в трубке Флейша, представляющей собой цилиндр, разделенный диафрагмой определенного сечения. Значения дыхательного потока отсчитываются по шкале прибора в л/сек.
Для выявления роли бронхоспазма в развитии обструктивного типа патологии, характеризующегося снижением индекса Тиффно, проводят пробу с различными бронхолитическими средствами (эуфиллином, адреналином, эфедрином и др.) или фармакологическую провокацию с бронхосужавающими препаратами (матахолин, бета-адреноблокаторы). ФЖЕЛ1 регистрируется до и после введения этих препаратов. Возрастание данного показателя после введения бронхолитика указывает на наличие явлений бронхоспазма. Снижение потоковых показателей после провокации, указывает на возможное происхождение бронхоспазма. Наиболее точно обструктивные нарушения дыхания выявляются тестами механики дыхания. Показатели механики дыхания определяется методом пневмотахографии, когда в ходе дыхательного цикла синхронно регистрируют изменения объемной скорости дыхания, внутрипищеводного, внутриальвеолярного давления. Специальными интеграторами пневмотахограмма может быть преобразована в спирограмму, а с помощью ротового и пищеводного манометров можно регистрировать транспульмональное, трансторакальное, трансальвеолярное давление и др. На сегодня наиболее точным методом регистрации биомеханики дыхания является плетизмография тела пациента. К рестриктивным нарушениям (от лат. restrictio – ограничение) дыхания относят гиповентиляционные расстройства, возникающие вследствие ограничения расправления легких. Выделяют две группы факторов, приводящих к ограничительным нарушениям вентиляции легких: 1) внутрилегочные; 2) внелегочные. Патогенетическую основу легочной формы рестриктивных расстройств составляет увеличение эластического сопротивления легких. Величина этого сопротивления зависит от растяжимости паренхимы легких. Под растяжимостью понимают изменения объема легких на единицу изменения траспульмонального давления (норма – 250 – 300 мл/см.вод.ст.). Работа по преодолению эластического сопротивления в целом прямо пропорциональна дыхательному объему: чем больше растягиваются легкие, тем больше прилагаемое усилие для их расправления.
Этиология. Рестриктивный легочный тип расстройств наблюдается, например, при обширных пневмониях, пневмофиброзе, ателектазах, интерстициальных отеках легких, избыточном тонусе гладких межальвеолярных мышц и др. Патогенез. Диффузное межальвеолярное и перибронхиальное разрастание соединительной ткани, нередко сопровождающее эти формы патологии, вызывает уменьшение способности легких растягиваться во время инспирации. Вследствие этого, существенно раздражаются ирритантные и юкстаальвеолярные капиллярные рецепторы легких, которые как Вы помните, обеспечивают функцию торможения тормозных постинспираторных нейронов дыхательного центра, т.е. увеличивают центрально-инспираторную активность. При этом значительно усиливается экспираторно-облегчающий рефлекс Геринга-Брейера и, как следствие – глубина вдохов уменьшается, а частота дыхания увеличивается за счет преимущественного укорочения выдоха – это так называемое «короткое» рестриктивное (или поверхностное) дыхание. Большое значение в развитии данного типа расстройств имеет дефицит сурфактанта – антиателектатического фактора легочного происхождения, состоящего из комплекса высокомолекулярных поверхностно-активных веществ липопротеидной природы. Молекулы различных сурфактантных веществ имеют, по крайней мере, две характерные черты: – длинные углеводородные цепи, направленные кнаружи и обеспечивающие создание несмачиваемой (гидрофобной) поверхности; – четвертичный ион азота с положительным зарядом, активно соединяющийся с любой отрицательно заряженной поверхностью, например, с легочной мембраной. Повреждающее действие на сурфактантную систему легких оказывают хлор, табачный дым, этиловый спирт, кислород в повышенных концентрациях, ионизирующая радиация, многие микроорганизмы, в том числе вирус гриппа, нарушения легочной микрогемодинамики и др. Рестриктивные расстройства дыхания внелегочного происхождения могут быть следствием сдавления всего тела, вызванного воздействиями механического характера (сдавление одеждой или предметами производственного оснащения, тяжелыми предметами, землей, песком и т.п. при различных катастрофах), либо возникают вследствие ограничения экскурсий грудной клетки при больших плевральных выпотах, гемо- и пневмотораксе и других патологических процессах, ведущих к компрессии легочной ткани и нарушению расправления альвеол при вдохе. Напомню, что пневмоторакс возникает из-за попадания воздуха в плевральную полость и бывает первичным (спонтанным) – например, кисты бронхов, сообщающиеся с плевральной полостью, и вторичным (опухоли, туберкулез), травматического и искусственного происхождения, а по механизму – открытый, закрытый и клапанный. Гидроторакс – экссудативный плеврит (асептическое воспаление, затем – гнойный плеврит, при отеках – транссудативный плеврит). Гемоторакс – ранения грудной клетки, опухоли плевры с распадом и эррозией сосудов.
Нарушения дыхательных экскурсий в виде поверхностного учащенного дыхания наблюдаются также в связи с чрезмерным окостенением реберных хрящей и малой подвижностью связочно-суставного аппарата грудной клетки. Механизм. В механизме развития поверхностного дыхания при рестриктивных расстройствах определенное значение имеют рефлексы с рецепторов плевры и грудной стенки. В частности, раздражение рецепторов плевры, повышает тонус ретикулярной формации ствола мозга, вызывает стимуляцию ранне-инспираторных нейронов за счет парабрахиальных ядер, что влечет тахипноэ за счет укорочения вдоха. Ограничение дыхательных экскурсий может быть также результатом рефлекторных влияний с ноцерецепторов плевры при ее раздражении, например, плевральным выпотом. Методы функциональной оценки. Наиболее точно рестриктивные нарушения дыхания оцениваются методами изучения механики дыхания, которые мы рассмотрели выше. Для гиповентиляционных нарушений рестриктивного типа характерно уменьшение ООЛ, ЖЕЛ, а также других легочных объемов и емкостей. Наибольшую диагностическую ценность для выявления рестриктивных расстройств имеет измерение ЖЕЛ. По уменьшению ЖЕЛ определяют степень выраженности рестриктивных нарушений, так как этот показатель непосредственно характеризует пределы возможного расправления легких. Лекция № 25 Нарушения регуляции дыхания. НАРУШЕНИЯ РЕГУЛЯЦИИ ДЫХАНИЯ Под регуляцией дыхания понимается приспособление деятельности дыхательных механизмов к обеспечению газовых потребностей организма в условиях изменяющегося действия факторов внешней и внутренней среды. Например, при физической работе, метаболизм, а, следовательно, и потребление кислорода и выделение углекислоты возрастают многократно по сравнению с покоем. В самом деле, количество крови, переносящей кислород и углекислоту, выбрасываемой сердцем в одну минуту, может во время напряженной работы возрасти с 5 – 6 до 20 – 25 л (т.е. в 4 – 5 раз); объем же воздуха, вентилируемый легкими – с 6-8 до 100 – 150 литров, т.е. в 15 – 20 раз. При этом каждое состояние организма требует оптимальное количество кислорода, углекислоты и рН внутренней среды организма – т.е. такое их содержание, которое обеспечивает обмен веществ, в точности характерный для данного состояния. Главная структура, управляющая дыханием – дыхательный центр (ДЦ).
В функциональном отношении понятие дыхательного центра можно определить в узком и широком смысле. В узком смысле слова под ДЦ надо понимать весьма ограниченную нейронную структуру, которая определяет ритмическое дыхание и без которой дыхание невозможно. Такая нейронная организация расположена в продолговатом мозге на уровне задвижки. В широком смысле слова под дыхательным центром понимают совокупность структур мозга, так или иначе участвующих в управлении дыханием и в наиболее совершенном приспособлении к изменяющимся дыхательным потребностям организма. Среди этих структур – все этажи ЦНС, начиная от коры больших полушарий и кончая мотонейронами спинного мозга. Почему правомерно такое неоднозначное понимание дыхательного центра? Чтобы разобраться в этом, нам необходимо сделать небольшой экскурс в историю развития представлений о структуре и функциях дыхательного центра. Где находится дыхательный центр? Вопрос этот совсем не праздный. Несмотря на два столетия упорных поисков (пожалуй, они начались даже гораздо раньше – еще во 2 веке н.э., с К. Галена, который показал, что дыхание после отделения головного мозга от спинного у животного прекращается), местоположение его до сих пор окончательно не определено. Если рассматривать головной мозг «в профиль», заметно деление его на ствол и надстволовые отделы. Стволовая часть представляет собой продолжение спинного мозга. Она, в свою очередь, состоит из продолговатого мозга и моста. Именно здесь находится ряд важных центров. Еще в XVII в. ученые смогли убедиться, что разрушение продолговатого мозга ведет к прекращению дыхания. А в первой половине следующего столетия французские ученые Ц. Легаллуа и М. Флоуранс уточнили локализацию «жизненного узла». Оказалось, что достаточно буквально укола в определенную точку продолговатого мозга, чтобы дыхательные движения подопытного животного прервались. В опытах на животных также выяснилось, что эта небольшая (всего каких-нибудь 10 мм в поперечнике) область продолговатого мозга, если ее изолировать от других структур, обеспечивает лишь короткие, судорожные вдохи (гаспы). Чтобы дыхательные движения были правильными, регулярными («эйпное», что означает «хорошее дыхание»), необходимо участие ряда нейронных образований, в частности, расположенных выше, в варолиевом мосту (т.н. пневмотаксический центр). Большой вклад в изучение дыхательного центра внесли крупные отечественные ученые – Н.А. Миславский, М.В. Сергиевский. Они пришли к мнению, что важнейшая часть дыхательного центра лежит у самой средней линии ретикулярной формации ствола мозга: если разрушить эту «медиальную» (т.е. срединную) зону дыхательного центра, дыхание прекращается. Далее, раздражая отдельные точки данной области, исследователи получили сокращение мышц-вдыхателей или выдыхателей.
Следовательно, здесь можно различить «инспираторный» и «экспираторный» отделы дыхательного центра. Особенно убедительно показал это известный авторитет в данном вопросе – американский нейрофизиолог Р.Ф. Питс. Итак, к середине XX века сложилась довольно стройная и, казалось бы, полная картина устройства дыхательного центра: он расположен в медиальной зоне ретикулярной формации продолговатого мозга и состоит из двух групп нейронов, управляющих мышцами – вдыхателями и – выдыхателями. Но наука не стоит на месте. Внедрение в исследовательскую практику современных электрофизиологических методов вызвало настоящий переворот в представлениях о локализации ДЦ. Оказалось, что в этом «дыхательном центре»... нет дыхательных нейронов! Зато они оказались в латеральной (боковой) зоне той же ретикулярной формации. Вводя микроэлектроды, соединенные с усилителем, ученые показали, что в т.н. дорсальном дыхательном ядре, оказались главным образом инспираторные нейроны. Их аксоны идут в шейный отдел спинного мозга, где импульсация переключается на двигательные нейроны, а те в свою очередь передают возбуждение на диафрагму. В другом, вентральном дыхательном ядре, находят как инспираторные, так и экспираторные нейроны. Их проводящие пути доходят до грудного отдела спинного мозга, где переключаются на мотонейроны межреберных мышц. А как же работают дыхательные нейроны? Хочу сразу подчеркнуть, что это самый запутанный вопрос физиологии дыхания. До сих пор считалось (и так еще многие считают) что в дыхательном центре есть группа клеток – водителей ритма (как в сердце), способных возбуждаться самопроизвольно, под действием собственных обменных процессов. Следует заметить, что в очень сложно устроенном дыхательном центре теплокровных животных клетки-пейцмеккеры ищут уже которое десятилетие – и все безуспешно. А может их там вообще нет? Тогда кто же запускает этот нейронный маятник? В последнее время крупнейшие физиологи дыхания (Бредли, Ойлер, Черняк, Бреслав, Глебовский) склоняются к мысли, что ДЦ не обладает автоматизмом. Отдельные популяции нейронов каким-то образом возбуждают друг друга – это напоминает часовой механизм. Чтобы понять, как это происходит, стали разрабатывать модели ДЦ, точнее – дыхательного ритмогенеза, т.е. происхождения ритмической активности этого центра. Рассмотрим эти модели. Самой распространенной из известных моделей является реципрокная. Суть ее состоит в том, что инспираторные нейроны, возбуждаясь, затормаживают экспираторные, а когда возбуждаются последние – тормозятся инспираторные. Однако когда математики стали строить модель этого реципрокного механизма, оказалось, что она не работает: колебания маятника в виде поочередного возбуждения и торможения инспираторных и экспираторных нейронов неизбежно должны затухать. Значит, дело не так просто. Значительно успешнее были попытки построения моделей генераторов дыхательного ритма в виде замкнутых контуров, по которым возбуждение циркулирует по кольцу (стековые модели). Одной из них является модель московского физиолога В.А. Сафонова (1993) который предположил, что каждый цикл начинается с активации раннего инспираторного нейрона. Затем возбуждение переходит на поздний инспираторный ранний и поздний экспираторный нейроны, и, наконец, снова на ранний инспираторный, после чего все повторяется вновь. При этом, возбуждаясь, каждый нейрон затормаживает два предшествующих ему по фазе. В этой модели полные инспираторный и экспираторный нейроны служат «выходными»: через них циклический возбудительный процесс из микрокомплекса направляется по эфферентным нервным путям и реализуется в конечном итоге в сокращениях соответствующих дыхательных мышц. Но мы недаром сравнили работу дыхательного центра с часовым механизмом, куда входит, в частности, маятник. И, поскольку, в составе самих нейронов самовозбуждающегося водителя ритма найти не удается, неизбежно встает вопрос о «пружине» в этих часах, т.е. каких-то внешних источниках энергии. А такие источники действительно существуют. Это, прежде всего известная Вам ретикулярная формация, чьими полноправными членами и являются дыхательные нейроны. Польские исследователи В.Каржевский и Х.Громыш (1982) считают, что ДЦ может генерировать ритмическую активность только в том случае, если в ретикулярной формации оказывается «критическая масса» возбужденных нейронов. А это возможно лишь при условии поступления возбуждающих стимулов, как с периферии, так и от вышележащих центров. Так появились наиболее обоснованные на сегодня т.н. трансформаторные модели ДЦ. Познакомимся с наиболее известной из них – моделью американских авторов Бредли и Кларка (1987). Под влиянием хеморецептивной стимуляции возбуждается определенная группа инспираторных нейронов (рис. 27). Это – т.н. центральная инспираторная активность (ЦИА). Чем сильнее афферентация – а эта импульсация зависит главным образом от напряжения СО2 в ликворе – тем быстрее происходит нарастание ЦИА, тем резче, происходит вдох. Но тем скорее этот вдох и прекратится.
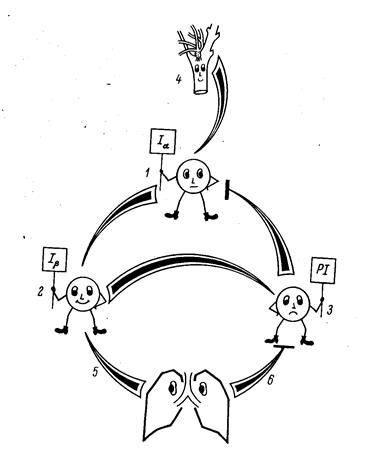
Рис. 27. Трансформаторная модель ритмогенеза
Дело в том, что одновременно возбуждается другая группа нейронов, активность которой, достигнув определенной величины (порога) затормаживает, выключает ЦИА. Обрыву вдоха, переходу его в выдох способствуют также рецепторы растяжения легких. Вспомогательную роль в этом механизме играют влияния, поступающие сверху, прежде всего из пневмотаксического центра варолиева моста. Эти влияния способствуют более плавным переходам между инспираторной и экспираторной фазами и обратно. Эта модель иллюстрируется приведенной схемой. Здесь возбуждение инспираторных нейронов Ia (1) обеспечивает вдох. Одновременно активирующаяся другая популяция инспираторных нейронов (Ib) – 2 передает свое возбуждение, когда оно достигает пороговой величины постинспираторным нейронам (PI) – 3, которые, в свою очередь, затормаживают нейроны Ia, прекращая вдох и поддерживая некоторое время состояние выдоха. Активация нейронов Ia поддерживается и стимулами из хеморецептров (4). Раздражение рецепторов растяжения легких (5) способствует прерыванию вдоха, а ирритантных рецепторов (6) – прерыванию выдоха. Итак, мы можем констатировать: ДЦ, получая от хеморецептров информацию о химизме внутренней среды, преобразует ее в ритмический выходной сигнал (подобно трансформатору), обеспечивающий требующийся уровень вентиляции. Мы подробно разобрали нейрофизиологические механизмы работы ДЦ для того, чтобы понять конкретные звенья нарушений регуляции дыхания. Расстройства регуляции в системе внешнего дыхания включают в себя: 1) центральные механизмы нарушений дыхательного ритмогенеза; 2) изменения в афферентном звене регуляции дыхательного центра (ДЦ); 3) нарушения проведения сигналов из ДЦ к респираторным мышцам. Познакомимся с некоторыми терминами, отражающими изменения характера дыхательного рисунка: 1) гиперпное – увеличение глубины дыхательных движений, независимо от частоты; 2) тахипное – частое дыхание; 3) (полипное) – частое и глубокое дыхание; 4) брадипное – редкое дыхание; 5) апное – остановка дыхания; 6) диспное – одышка, некоординированное дыхание. 7) ортопное – выраженная одышка при застое в левом желудочке. В положении сидя ее переносить легче, застой уменьшается. Расстройства центральной регуляции вентиляции легких возникают в основном вследствие нарушений функций дыхательного центра (ДЦ). Исходя из изложенных выше представлений о структуре и функциях ДЦ, возможно выделить несколько механизмов расстройств регуляции дыхания, связанных с отклонениями в афферентной регуляции ДЦ и характеризующихся развитием гиповентиляционных и апноетических состояний. а) Дефицит возбуждающей афферентации. Дефицит импульсов из хеморецепторов приводит к т.н. периодическим формам дыхания.
Рис. 28. Типы периодического дыхания
К ним относятся дыхание типа Чейн-Стокса – характеризуется постепенным нарастанием амплитуды дыхательных движений, сменяющегося их снижением и возникновением периода апное. Возникает при уменьшении чувствительности центрально-мозговых хеморецепторов к углекислому газу. Дыхание Биота – характеризуется чередованием серии частых и высоких дыхательных движений, сменяющихся периодами апное. Возникает при воспалительных и травматических поражениях мозга, опухолях задней черепной ямки. Кроме хеморецептивной стимуляции ранних инспираторных нейронов, большое значение имеют импульсы, поступающие из нейронов ретикулярной формации и парабрахиальных ядер пневмотаксического центра Люмсдена. Наблюдается при снижении тонической импульсации, например, нередко встречающегося в акушерской практике синдрома асфиксии новорожденных. Вследствие незрелости хеморецепторного аппарата ребенок, чаще недоношенный, может рождаться в состоянии асфиксии. Для активации ДЦ в таких случаях обычно используют дополнительные стимулирующие воздействия на кожные экстерорецепторы (похлопывание по ножкам и ягодицам ребенка, обрызгивание тела холодной водой и т.д.), ликвидируя тем самым дефицит возбуждающей афферентации через неспецифическую активацию ретикулярной формации. Уменьшение возбуждающей информации возникает при перерыве самого пневмотаксического центра (нижняя – средняя треть – возникает дыхание типа «айпнезиз»). Наконец, уменьшение притекающих импульсов наблюдается при ваготомии (двухсторонняя вагосимпатическая блокада) – при этом может возникать т.н. вагусная одышка (механизм компенсации – полисинаптические связи между ранними и поздними инспираторными нейронами в модели Бредли-Кларка). Альвеолярная гиповентиляция и остановка дыхания, возникающие при угнетении ДЦ средствами для наркоза и обезболивания, также является следствием дефицита стимулирующих воздействий, необходимых для запуска генератора дыхательного ритмогенеза. б) Избыток возбуждающей афферентации. «Перевозбуждение» ДЦ может характеризоваться развитием очень частого, но поверхностного дыхания. Альвеолярная гиповентиляция при тахипное (от греч. tachys-быстрый, скорый; pnoe – дыхание) является следствием увеличения функционального мертвого пространства. Причинами чрезмерной активации ДЦ могут быть стрессорные воздействия, приводящие к генерализованному возбуждению ЦНС, неврозы (например, приступы истерии), некоторые поражения структур среднего мозга, нарушения кровообращения, острое воспаление, механическая травма и др. Избыток афферентации, возбуждающей ДЦ, может быть рефлекторного происхождения. Тахипноэ, сопровождаемое значительным уменьшением глубины дыхания, иногда возникает при раздражении брюшины, термических или болевых воздействиях на кожные покровы. Как отмечалось ранее, в механизме развития частого поверхностного дыхания (например, при крупозной пневмонии) существенное значение имеет раздражение ирритантных и юкстакапиллярных рецепторов легких. Кашель может вызываться раздражением чувствительных окончаний плевры. Кашель состоит из короткого вдоха – затем немедленно смыкается голосовая щель и одновременно развивается экспираторное усилие дыхательных мышц. Резко повышается давление в дыхательных путях, голосовая щель немедленно раскрывается и воздух с большой силой выходит из дыхательных путей, вынося раздражающие слизью частицы. При чихании форсированный выдох происходит не через рот, а через нос. в) Избыток тормозной афферентации. Этот механизм угнетения ритмической активности ДЦ включается, например, при раздражении слизистой оболочки верхних дыхательных путей в условиях развития острого респираторного заболевания воспалительного характера. Интенсивное раздражение слизистой оболочки полости носа и носоглотки химическими или механическими агентами может вызывать рефлекторную остановку дыхания на вдохе, повышение системного кровяного давления, брадикардию и даже кратковременное прекращение сердечных сокращений. Этот тормозной тригеминовагусный рефлекс Кречмера возможно полностью предотвратить анестезией слизистой оболочки верхних дыхательных путей или в эксперименте – перерезкой ветвей тройничного нерва. НАРУШЕНИЯ ЭФФЕРЕНТНЫХ ПУТЕЙ Прерывание путей, связывающих ДЦ с дыхательными мышцами, может приводить к грубым нарушениям экскурсий грудной клетки и диафрагмы, сопровождающимся развитием альвеолярной гиповентиляции. Известно, что повреждения шейного отдела спинного мозга, прерывающие связь ДЦ с мотонейронами межреберных мышц, не вызывают значительных изменений характера дыхания. Если же прерываются проводящие пути, связывающие ДЦ с диафрагмальными мотонейронами, то дыхание утрачивает автоматизм. Больной в таком случае дышит только произвольно: дыхание становится неравномерным, а при засыпании прекращается (так называемый синдром «проклятия Ундины»). Причинами развития этого синдрома могут быть сирингомиелия, рассеянный склероз, травма или нарушения кровообращения спинного мозга, полиомиелит. Миогенные расстройства дыхания. Нарушения функции дыхательных мышц возникают не только при поражениях проводящих путей спинного мозга, мотонейронов и нервов, иннервирующих респираторные мышцы, но также при расстройствах нервно-мышечной проводимости. Типичным примером такой патологии является миастения, характеризующаяся стойким снижением лабильности нервно-мышечных синапсов. Развивающиеся при этом слабость и патологическая утомляемость респираторных мышц приводят к снижению газообменной функции внешнего дыхания и могут приобрести угрожающий для жизни характер. Альвеолярная гиповентиляция и даже прекращение дыхания из-за блокады нервно-мышечных синапсов наблюдаются как осложнения в период после оперативных вмешательств с использованием миорелаксантов в результате чрезмерно пролонгированного их действия или развития явления так называемой рекураризации. Альвеолярная гиповентиляция миогенного происхождения может наблюдаться у практически здоровых людей с недостаточно развитой дыхательной мускулатурой в условиях выполнения ими значительной физической нагрузки. Особенно легко наступает утомление дыхательных мышц при болезнях мышечной системы (например, при мышечной дистрофии Дюшена). Тяжелая степень альвеолярной гиповентиляции может возникать при воспалительных процессах в дыхательных мышцах, сопровождающихся мышечной слабостью и миалгией. Самостоятельное значение в возникновении альвеолярной гиповентиляции иногда имеют врожденная или приобретенная атрофия, пороки развития, опухоли и кисты диафрагмальной мышцы.
|
|||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 66; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.26.90 (0.049 с.) |