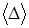Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теория метода и описание установки
2.2.1 Приборы и материалы: баллон с кранами, манометр, насос. Для определения отношения теплоемкостей в данной работе используется метод, предложенный Клеманом и Дезормом. Величина
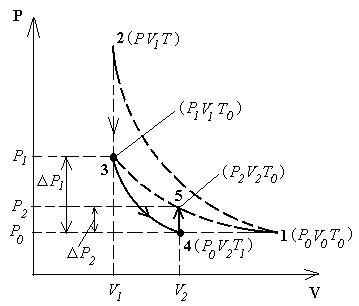
Рисунок 2.1 дополнительную порцию воздуха m. Давление в баллоне повышается до Р, так как масса газа увеличивается Температура воздуха увеличивается до T потому, что внешние силы совершают работу по сжатию газа массы m0 при накачивании воздуха где r× g × h 1 – избыточное давление воздуха в баллоне, Это состояние 3 с параметрами (P 1 V1T 0), где V 1 – объем массы газа m 0. Затем кран С открывается на короткое время, при этом часть воздуха выходит из баллона, и давление сравнивается с атмосферным P 0. Оставшаяся часть адиабатически расширяется, совершая работу против атмосферного давления; внутренняя энергия газа уменьшается, и температура понижается до T 1 < T 0, состояние 4 (P 0 V2T 1). Затем кран С быстро закрывают, и воздух в баллоне начинает медленно нагреваться до температуры окружающей среды T 0 – состояние 5 (P 2 V2T 0), давление при этом увеличивается до P 2.
Понятие адиабатического процесса является идеализацией, так как невозможно полностью исключить обмен теплом между газом и окружающей средой. Но процесс теплообмена идет довольно медленно, поэтому быстрое расширение газа можно рассматривать приближенно адиабатическим. Давление в баллоне станет равным P 2:
где r × g × h 2 – избыточное давление после расширения и установления температуры T 0, По величине измеренных на опыте давлений P 0, P 1 и P 2 можно определить соотношение теплоемкостей:
Рисунок 2.2
Запишем параметры для различных состояний воздуха внутри «оболочки». Первое состояние – после накачки воздуха и выравнивания температур (на диаграмме P – V это точка (3) рисунка 2.2): I состояние – параметры – P 1, V 1, T 0. Второе состояние (точка (4)) – после адиабатического расширения: I I состояние – параметры – P 0, V 2, T 1. Третье состояние – после закрытия крана и выравнивания температуры до T 0 – (точка (5)): III состояние– параметры – P 2, V 2, T 0. Разность давлений P 1– P 0 и P 2– P 1 в сотни и тысячи раз меньше атмосферного P 0, поэтому для упрощения вычислений с этими разностями можно обращаться как с бесконечно малыми величинами. То же относится и к соответствующим изменениям объема выделенной массы газа. Переход газа из состояния I (3 – P 1 V 1 T 0) в состояние II (4 – P 0 V 2 T 1) происходит адиабатически (2.27):
В состояниях I (точка 3) и III (точка 5) на диаграмме P – V воздух имеет одинаковую температуру T 0, поэтому применяем закон Бойля-Мариотта (PV = const), запишем его в дифференциальной форме: или Решая совместно (2.33) и (2.34), имеем: Подставим в это соотношение Так как в рабочей формуле (2.36) g выражена через отношение избыточных давлений, то измерять его можно в любых единицах. Удобнее всего выразить его в миллиметрах водяного столба по манометру. Для определения отношения
Порядок выполнения работы
Открыть кран С и проверить разность уровней в манометре – она должна быть равна нулю. 2. Закрыть кран С и открыть кран Д так, чтобы баллон был соединен с насосом. 3. Накачать некоторое количество воздуха в баллон, чтобы разность уровней в манометре составила 15 ¸ 20 см (150 ¸ 200 мм). 4. Повернуть кран Д так, чтобы отсоединить насос от баллона, при этом разность уровней в манометре сначала несколько убывает, а затем устанавливается неизменной. Подождав несколько минут (2 ¸ 3 минуты), записать эту разность уровней h 1. 5. Открыть снова кран Д, сообщающий баллон с наружным воздухом, на очень короткое время (1 ¸ 2 секунды), необходимое для того, чтобы уровни в манометре выровнялись, и сразу же его закрыть. 6. После закрытия крана разность уровней жидкости в манометре начинает медленно расти и через несколько минут (2 ¸ 3 минуты) устанавливается неизменная разность уровней h 2 – записать это значение в таблицу 2.1. 7. Повторить измерения 5 – 7 раз. 8. Вычислить отношение теплоемкостей по формуле (2.36). 9. Рассчитать среднее значение g, абсолютную и относительную погрешности. 10. Сравнить опытное значение Таблица 2.1
2.4 Контрольные вопросы
1. Первое начало термодинамики и его применение к изопроцессам. 2. Что такое внутренняя энергия и как она определяется для газов? 3. Почему теплоемкость газа зависит от способов (условий) нагревания? 4. Дать определение cP и сV и СP и CV. 5. Какая из теплоемкостей больше и почему? 6. Как связаны молярные теплоемкости СP и CV? Уравнение Майера. 7. Какой процесс называют изотермическим и адиабатическим? 8. Вывод уравнения адиабаты (Пуассона). 9. Как изменяется энергия газа при изотермическом и адиабатическом процессах?
Техника безопасности 1. Не применять больших усилий при повороте крана на баллоне. 2. При накачивании избыточного газа в баллон следить, чтобы не вылилась жидкость из манометра.
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 159; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.154.171 (0.014 с.) |
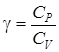 зависит от структуры молекул газа.
зависит от структуры молекул газа.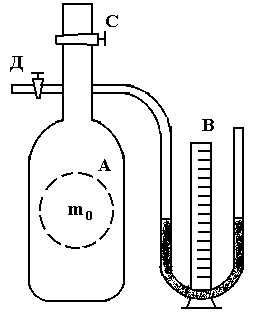 Установка для выполнения работы этим методом состоит из стеклянного баллона А (рисунок 2.1) емкостью 15 ¸ 20 литров, соединенного с манометром В и насосом (на рисунке не показан). Через кран С баллон А соединяется с атмосферой. С помощью крана Д баллон сообщается с насосом. При открытом кране С баллон заполнен воздухом при атмосферном давлении P 0 и комнатной температуре T 0 и массой m 0, состояние 1. На диаграмме P – V (рисунок 2.2) представлена последовательность процессов при выполнении работы. Кран С закрывают и насосом накачивают
Установка для выполнения работы этим методом состоит из стеклянного баллона А (рисунок 2.1) емкостью 15 ¸ 20 литров, соединенного с манометром В и насосом (на рисунке не показан). Через кран С баллон А соединяется с атмосферой. С помощью крана Д баллон сообщается с насосом. При открытом кране С баллон заполнен воздухом при атмосферном давлении P 0 и комнатной температуре T 0 и массой m 0, состояние 1. На диаграмме P – V (рисунок 2.2) представлена последовательность процессов при выполнении работы. Кран С закрывают и насосом накачивают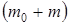 , состояние 2 (PTV 1) (рисунок 2.2).
, состояние 2 (PTV 1) (рисунок 2.2).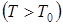 . Вследствие теплообмена воздуха с окружающей средой через некоторое время (2 ¸ мин.) температура воздуха, находящегося в баллоне,сравняется с температурой внешней среды T 0. При этом по манометру можно отметить уменьшение давления воздуха. Когда температура воздуха в баллоне будет равна комнатной (показания манометра перестанут меняться), давление в баллоне станет равным
. Вследствие теплообмена воздуха с окружающей средой через некоторое время (2 ¸ мин.) температура воздуха, находящегося в баллоне,сравняется с температурой внешней среды T 0. При этом по манометру можно отметить уменьшение давления воздуха. Когда температура воздуха в баллоне будет равна комнатной (показания манометра перестанут меняться), давление в баллоне станет равным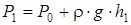 , (2.31)
, (2.31)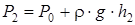 , (2.32)
, (2.32)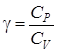 .
. Для этого мысленно выделим внутри баллона произвольную массу воздуха m 0, ограниченную замкнутой поверхностью, которая играет роль «оболочки». На рисунке 2.1 «оболочка» изображена пунктирной линией в рассмотренных выше процессах воздух внутри нее будет расширяться и сжиматься, совершая работу против давления окружающего воздуха и обмениваясь с ним теплом.
Для этого мысленно выделим внутри баллона произвольную массу воздуха m 0, ограниченную замкнутой поверхностью, которая играет роль «оболочки». На рисунке 2.1 «оболочка» изображена пунктирной линией в рассмотренных выше процессах воздух внутри нее будет расширяться и сжиматься, совершая работу против давления окружающего воздуха и обмениваясь с ним теплом.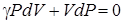 . Учитывая, что в условиях опыта изменения объемов и давлений газа малы, уравнение адиабаты (2.27) можно записать:
. Учитывая, что в условиях опыта изменения объемов и давлений газа малы, уравнение адиабаты (2.27) можно записать: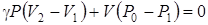 . (2.33)
. (2.33)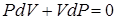
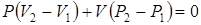 . (2.34)
. (2.34)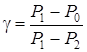 . (2.35)
. (2.35)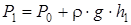 и
и 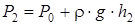 , получим:
, получим: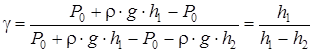 . (2.36)
. (2.36)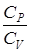 опытным путем необходимо измерить разности уровней h 1 и h 2 и, пользуясь формулой (2.36), произвести вычисления.
опытным путем необходимо измерить разности уровней h 1 и h 2 и, пользуясь формулой (2.36), произвести вычисления. с теоретическим по формуле (2.30).
с теоретическим по формуле (2.30).