
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Таким образом, первичным стимулом, запускающим активацию тромбоцитов, является связывание мембраны тромбоцитов с коллагеном.Стр 1 из 5Следующая ⇒
ФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
1. В обычных физиологических условиях кровь циркулирует по организму и не склонна к тромбообразованию. Почему?
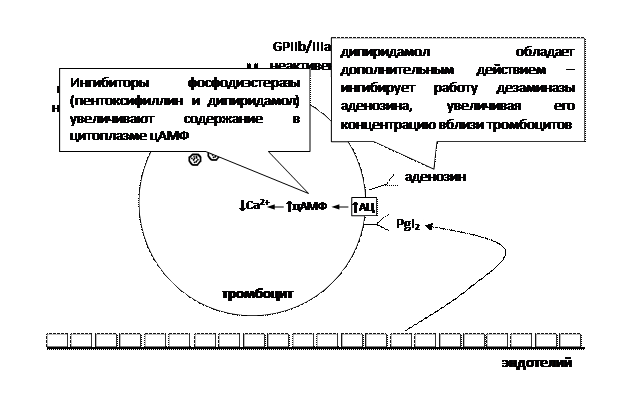
Внимание! Далее вы увидите, что выделение из везикул ряда веществ и активация гликопротеина GPIIb/IIIa имеют важное значение для агрегации тромбоцитов. Внимание! Аденилатциклаза и фосфолипаза С – это ферменты, которые расположены в клеточной мембране. Поэтому, начиная с этой распечатки, мы будем изображать их именно там (рис. 1). Кроме того, PgI2 воздействует на свои рецепторы, расположенные в стенке сосудов → ↑АЦ → ↑цАМФ → ↓Са2+ → ухудшение взаимодействия актина и миозина → расслабление мышечных клеток сосудистой стенки → расширение сосудов → затруднение образования тромбов (влияние PgI2 на сосудистую стенку на рис. 1 не показано). Аналогичным действием на тромбоциты и сосудистую стенку обладает аденозин, поскольку в перечисленных структурах он воздействует на аденозиновые рецепторы 2 типа (А2-рецепторы), которые также сопряжены с аденилатциклазой (АЦ).
Рис. 1. Физиологические механизмы, препятствующие тромбообразованию. Гемостаз
Кровь является важной частью соединительной ткани, поскольку обеспечивает поддержание обмена веществ между клетками. Потеря избыточного количества крови приводит к гибели организма. Чтобы этого не произошло, в поврежденном сосуде образуется тромб. Гемостаз протекает в два этапа: а) первичный гемостаз: спазм сосуда + агрегация тромбоцитов б) вторичный гемостаз: поддержание спазма сосуда + стабилизация тромба (образованного тромбоцитами) за счет образования нитей фибрина
Давайте более подробно остановимся на каждом из видов гемостаза.
А) Первичный гемостаз (агрегация тромбоцитов)
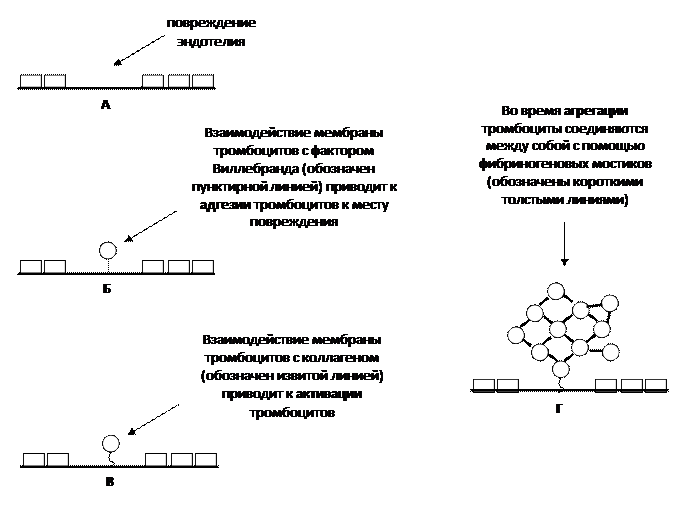
Давайте сначала посмотрим более крупным планом на те процессы, которые происходят во время первичного гемостаза. А уже затем углубимся в молекулярные взаимодействия, сопровождающие эти процессы. При повреждении эндотелия (рис. 2А) в кровь начинают быть видны молекулы гликопротеина, называемого фактором Виллебранда. Некоторое его количество находится в подэндотелиальном пространстве, некоторое количество выделяется из поврежденных эндотелиоцитов. Мембрана тромбоцитов взаимодействует с фактором Виллебранда, что обеспечивает адгезию – прилипание тромбоцитов к месту повреждения в эндотелии (рис. 2Б). Теперь мембрана тромбоцитов имеет возможность взаимодействовать с коллагеном, находящимся в месте повреждения (как вы помните их курса гистологии, коллаген находится, например, в базальной мембране) (рис. 3В). Связывание с коллагеном приводит к активации тех тромбоцитов, которые прилипли к зоне повреждения в эндотелии. А это, в свою очередь, приводит к развитию цепной реакции и активированию тех тромбоцитов, которые находятся в крови вблизи места повреждения в свободном состоянии. В результате происходит агрегация – соединение всех активированных тромбоцитов между собой с помощью фибриногеновых мостиков (рис. 2Г). В результате образуется тромб, состоящий, преимущественно, из тромбоцитов.
Внимание! Во время первичного гемостаза тромбоциты соединяются между собой именно с помощью фибриногена (не с помощью фибрина!). На рис. 2 в месте повреждения эндотелия показан один прилипший тромбоцит. В реальных условиях к месту повреждения прилипает, конечно же, несколько тромбоцитов.
Рис. 2. Взгляд крупным планом на первичный гемостаз.
Давайте теперь более детально изучим те молекулярные механизмы, которые происходят во время активации и агрегации тромбоцитов. Итак, выше мы писали, что мембрана тромбоцита связывается с коллагеном в месте повреждения эндотелия. Это служит стимулом, который а) заставляет везикулы высвобождать свое содержимое (АДФ, серотонин, тромбин и пр.) из тромбоцита в плазму крови, и б) активирует ЦОГ-1, расположенную в тромбоцитах, которая из арахидоновой кислоты образует тромбоксан ТХА2; поскольку ТХА2 является липофильной молекулой, он без особых затруднений проходит через мембрану тромбоцита и тоже оказывается в плазме крови. Важно также отметить, что из поврежденного эндотелия в плазму крови высвобождается брадикинин.
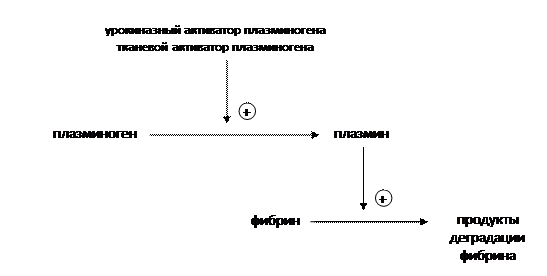
Лизис тромбов После того, как стенка сосуда подвергнется репаративным процессам и восстановит свою целостность, тромб должен быть растворен. Для этого плазминоген (профибринолизин) должен превратиться в плазмин (фибринолизин) – реакция, осуществляемая урокиназным и тканевым активатором плазминогена. Образующийся плазмин (фибринолизин) расщепляет нити фибрина, тем самым способствуя рассасыванию тромба (рис. 5).
Рис. 5. Механизм реакции, приводящие к расщеплению фибрина.
Антиагреганты Антиагреганты – лекарственные вещества, препятствующие агрегации тромбоцитов.
Лекарственные вещества 1. Ингибиторы ЦОГ-1 - кислота ацетилсалициловая 2. Блокаторы АДФ-рецепторов - клопидогрел 3. Блокаторы брадикининовых рецепторов - пармидин 4. Блокаторы GPIIb/IIIa рецепторов - абциксимаб 5. Ингибиторы фосфодиэстеразы (ФДЭ) - пентоксифиллин (трентал) - дипиридамол
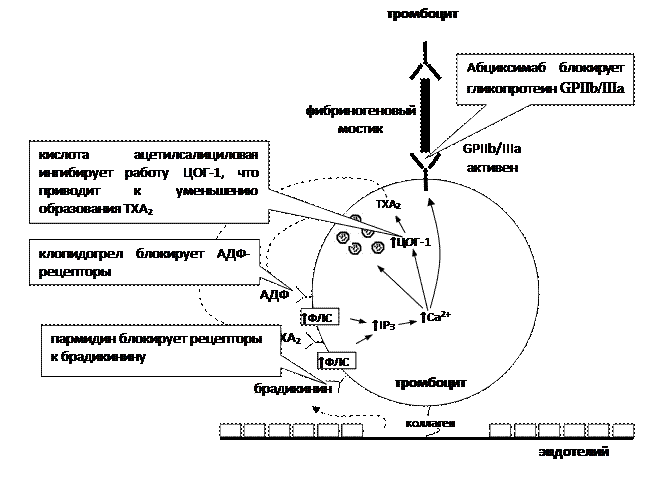
Механизм действия Если вы внимательно разобрались с физиологией, касающейся агрегации тромбоцитов, то описываемые здесь механизмы должны быть вам понятны. Кислота ацетилсалициловая блокирует работу ЦОГ-1 (рис. 6), что приводит к уменьшению образования ТХА2 → он не выбрасывается из тромбоцита и не оказывает влияния на свои рецепторы, расположенные в мембране тромбоцитов → ↓ФЛС → ↓IP3 → ↓Са2+ → уменьшение выброса из тромбоцитов биологически активных веществ (АДФ, серотонина, тромбина), переход гликопротеина GPIIb/IIIa в неактивное состояние → торможение агрегации тромбоцитов, расширение сосудов → нарушение тромбообразования. Кислота ацетилсалициловая блокирует также работу ЦОГ-1 в стенке сосудов, поэтому, казалось бы, должна была уменьшить образование PgI2, тем самым способствуя агрегации тромбоцитов. Однако на практике этого не происходит. Дело в том, что в ответ на ингибирование ЦОГ-1 в эндотелиоцитах активируются гены, ответственные за синтез данного фермента → образуются новые молекулы ЦОГ-1 → активность ЦОГ-1 восстанавливается → восстанавливается синтез PgI2. В тромбоцитах образование новых молекул ЦОГ-1 невозможно, поскольку тромбоциты – это безъядерные клетки, и в них нет генов, ответственных за синтез этого фермента. Поэтому уровень ТХА2 снижается надолго и восстанавливается лишь с созреванием новых тромбоцитов. Клопидогрел блокирует АДФ-рецепторы, а пармидин блокирует брадикининовые рецепторы (рис. 6) → ↓ФЛС → ↓IP3 → ↓Са2+ → уменьшение выброса из тромбоцитов биологически активных веществ (АДФ, серотонина, тромбина), переход гликопротеина GPIIb/IIIa в неактивное состояние → торможение агрегации тромбоцитов, расширение сосудов → нарушение тромбообразования.
Абциксимаб блокирует гликопротеин GPIIb/IIIa, который является, по сути, рецептором для связывания фибриногена (рис. 6). В результате нарушается агрегация тромбоцитов. Пентоксифиллин и дипиридамол ингибируют фосфодиэстеразу (фермент, который в норме разрушает избыток цАМФ; рис. 7) → ↑цАМФ → ↓Са2+ → уменьшение выброса из тромбоцитов биологически активных веществ (АДФ, серотонина, тромбина), переход гликопротеина GPIIb/IIIa в неактивное состояние → торможение агрегации тромбоцитов, расширение сосудов → нарушение тромбообразования. Дипиридамол обладает также дополнительным действием – ингибирует работу дезаминазы аденозина (фермент, в норме расщепляющий избыток аденозина; рис. 7) → увеличение концентрации аденозина вблизи тромбоцитов → ↑АЦ → ↑цАМФ → ↓Са2+ → ….. (см. выше).
Показания для применения антиагрегантов Антиагреганты применяют для профилактики тромбообразования.
Рис. 6. Механизм действия антиагрегантов (начало).
Рис. 7. Механизм действия антиагрегантов (окончание). Антикоагулянты
Антикоагулянты – лекарственные вещества, которые нарушают свертывание крови.
Лекарственные вещества 1. Антикоагулянты прямого действия: - гепарин - фраксипарин - эноксапарин 2. Антикоагулянты непрямого действия - неодикумарин - фенилин
Антикоагулянты прямого действия Гепарин - естественный антикоагулянт, являющийся по химической природе мукополисахаридом с молекулярным весом около 15 кДа, который образуется в тучных клетках. В медицинских целях его получают из печени и легких крупного рогатого скота и из кишечника свиней. Выше, при разборе физиологии системы крови, мы говорили, что в норме в ней присутствуют антитромбины, которые препятствуют свертыванию крови. Однако, они медленно работают. После соединения с гепарином антитромбины меняют свою
Исследования свидетельствуют о том, что гепарин ускоряет работу антитромбина III и, возможно, антитромбина II, что приводит к инактивации IIa (тромбин), IXa, Xa, XIa и XIIa факторов свертывания крови. Гепарин – мукополисахарид, поэтому при пероральном приеме он разрушается в желудке. Вследствие этого его вводят подкожно или внутривенно. Действие гепарина развивается через 5 – 10 мин и длится 2 – 6 ч, обычно его вводят 3 раза в день.
Недостатки гепарина: кратковременность действия, способность вызывать геморрагии (кровотечения) и тромбоцитопению. Фраксипарин, эноксапарин – низкомолекулярные гепарины, получаемые путем фрагментации природного гепарина. Их молекулярная масса около 5 кДа. Механизм действия у фраксипарина и эноксапарина такой же, как у природного гепарина – ускорение работы антитромбинов.
Исследования показывают, что способность гепаринов инактивировать те или иные факторы свертывания крови сильно зависит от длины молекулярной цепочки гепаринов. У природного гепарина молекула длинная, поэтому он мог инактивировать IIa (тромбин), IXa, Xa, XIa и XIIa факторы свертывания крови. Фраксипарин и эноксапарин – это фрагментированный природный гепарин, поэтому длина у их молекул небольшая. Она позволяет инактивировать только один из пяти упомянутых факторов – Xa. Фраксипарин и эноксапарин также, как и природный гепарин, не принимают внутрь – обычно их вводят подкожно. Действие развивается через 5 – 10 мин и длится не менее 8 – 12 ч, поэтому часто их вводят 1 раз в день. Угроза развития геморрагий и тромбоцитопении минимальна. Тем не менее, их не рекомендуют применять при склонности к кровотечениям, нарушениях мозгового кровообращения и тромбоцитопении.
Внимание! Действие гепаринов проявляется за счет ускорения работы антитромбинов. Поскольку антитромбины находятся в самой плазме крови, то гепарины будут нарушать свертываемость крови как в организме, так и в пробирке.
Антикоагулянты непрямого действия Неодикумарин и фенилин нарушают восстановление эпоксидной формы витамина К в его активную гидрохиноновую форму, в результате чего нарушается синтез в печени II (протромбина),VII, IX и X факторов свертывания крови. Как следствие, концентрация этих факторов в плазме крови снижается, что приводит к нарушению свертывания крови. Эффекты данной группы антикоагулянтов развиваются после значительного латентного периода и нарастают во времени. Максимальное снижение свертывания крови на фоне приема этих препаратов наблюдается через 24 – 48 ч, длительность действия 2 – 4 дня.
Понятно, что раз непрямые антикоагулянты нарушают образование факторов свертывания крови в печени, то они активны в организме, но неактивны в пробирке.
Показания к применению антикоагулянтов Антикоагулянты прямого действия можно использовать для профилактики тромбозов, а также в неотложной медицине для остановки прогрессирования начавшегося тромбоза. Антикоагулянты непрямого действия из-за медленного развития эффекта можно использовать только для профилактики тромбоза.
Фибринолитические средства
Фибринолитики – лекарственные средств, лизирующие образовавшиеся тромбы.
Лекарственные средства - фибринолизин - стрептокиназа - актилиза
Фибринолизин Из плазмы крови человека выделяют плазминоген (профибринолизин), затем обрабатывают его трипсином, тем самым превращая в плазмин (фибринолизин). Для медицинского применения его выпускают в виде порошков для инъекций. При необходимости его разводят изотоническим раствором натрия хлорида и вводят внутривенно. Механизм действия плазмина (фибринолизина) мы обсуждали при рассмотрении физиологии системы крови (рис. 5): плазмин (фибринолизин) прямо расщепляет нити фибрина, тем самым способствуя лизису тромба. Фибринолизин растворяет тромбы снаружи вовнутрь, действует на свежеобразованные тромбы (в течение 1 суток), причем быстрее и полнее лизируются венозные тромбы. В связи с дороговизной получения и рядом недостатков (например, растворение только свежих тромбов) фибринолизин в настоящее время используется редко.
Стрептокиназа Стрептокиназа не обладает ферментативной активностью в отношении плазминогена, как можно было бы подумать исходя из ее названия. Стрептокиназа соединяется с плазминогеном, в результате чего образуется активный комплекс, превращающий свободные (не связанные в комплекс) молекулы плазминогена в плазмин (рис. 9). Затем плазмин, как и полагается расщепляет фибрин, приводя к лизису тромбов. Стрептокиназа хорошо проникает внутрь свежих тромбов, растворяя их не только снаружи, но и изнутри. Данное лекарственно средство эффективно при свежих тромбах (в течение 1 – 3 суток при артериальных тромбозах и до 5 – 7 суток при венозных тромбозах). Хорошо растворяет любые тромбы, содержащие большое количество плазминогена.
Актилиза Актилиза – это рекомбинантный человеческий тканевой активатор пзазминогена (тканевой активатор плазминогена мы рассматривали при обсуждении физиологии системы крови, см. рис. 5). Соответственно, механизм действия актилизы достаточно прост: она переводит плазминоген в плазмин, а плазмин разрушает фибрин, тем самым приводя к растворению тромба (рис. 5). Однако, у актилизы есть особенность – для ее активации необходим предварительный контакт с фибрином (что может произойти только в тромбе). Поэтому она не влияет на свободный плазминоген, циркулирующий в плазме крови, но активирует лишь тот плазминоген, который находится в тромбе. Вывод: актилиза ускоряет фибринолиз только в ткани тромба, не затрагивая остальное сосудистое русло, что уменьшает риск развития кровотечений.
Рис. 9. Механизм действия стрептокиназы
Внимание! Антикоагулянты и фибринолитические средства используют для купирования тромбоэмболического синдрома, который имеет место при флебитах (воспаление вен), артериитах (воспаление артерий), инфаркте миокарда, ишемическом инсульте и т.д. Лечение начинают с введения гепаринов (для предотвращения прогрессирования тромбоза) и фибринолитических средств (для растворения уже имеющегося тромба). Параллельно внутрь назначают антикоагулянты непрямого действия, поскольку гепарин через 2 дня будет отменен, а непрямые антикоагулянты к этому времени как раз начнут действовать и будут продолжать осуществлять профилактику тромбообразования вместо гепарина. Фибринолитические средства вводят 2 – 3 суток. При передозировке перечисленных средств возникают кровотечения. Что делать? Нужно использовать антагонисты или ингибиторы данных веществ. Если была передозировка гепарина, используют протамина сульфат (гепарин за счет остатков серной кислоты имеет отрицательный заряд, протамин за счет аминогрупп обладает положительным зарядом; за счет ионных взаимодействий гепарин связывается с протамином сульфатом и утрачивает свою активность). При передозировке непрямых антикоагулянтов используют витамин К (что логично, ведь непрямые антикоагулянты нарушали синтез активной формы витамина К). Для ослабления эффекта фибринолитических средств используют контрикал или аминокапроновую кислоту (контрикал, как вы помните, относится к ингибиторам протеолиза, и он может прямо угнетать активность плазмина (фибринолизина); аминокапроновая кислота также угнетает активность плазмина (фибринолизина) и тормозит его образование из плазминогена (профибринолизина)).
Стимуляторы эритропоэза
Всасывание железа осуществляется преимущественно в двенадцатиперстной кишке с помощью транслоказы железа – апоферритина. После прохождения кишечного барьера железо в плазме крови связывается с другим белком – трансферритином и в таком виде транспортируется в тканевые депо (костный мозг, печень, селезенка) При дефиците железа нарушается синтез гемма, входящего в состав гемоглобина, что ведет к развитию железодефицитных анемий. Это может быть связано либо с нарушением всасывания железа (при заболеваниях желудка и кишечника), либо с возрастанием потребности в железе (беременость, лактация), либо с усилением выведения железа (хронические кровопотери). Для лечения гипохромных анемий назначают препараты железа. Если всасывание железа не нарушено, назначают препараты для приема внутрь – лактат железа или его комбинацию с сухим гемоглобином (таблетки ”Haemostimulinum”). Если всасывание железа нарушено, назначают парентеральные препараты – фербитол и ферковен.
Внимание! Название очень «ферковен» очень легко запомнить, поскольку в его состав входят фер рум (железо), ко бальт, и он предназначен для внутри вен ного введеия. При дефиците фолиевой кислоты (витамин В9) и цианокобаламина (витамин В12) нарушается образование тетрагидрофолиевой кислоты (ТГФК), необходимой для синтеза ДНК и РНК. Вследствие нарушения образования ДНК и РНК нарушается образование зрелых эритроцитов. Поэтому в кровь из костного мозга начинают выходить крупные незрелые предшественники эритроцитов (мегалобласты). При дефиците фолиевой кислоты говорят о развитии гиперхромной макроцитарной анемии, при дефиците цианокобаламина – о развитии гиперхромной мегалобластической анемии Аддисона-Бирмера. Соответственно, фолиевую кислоту используют для лечения макроцитоарных анемий. При мегалобластической анемии фолиевая кислота нормалиует картину крови, но не кстраняет патологических изменений со стороны центральной нервной системы, а иногда даже усиливает их Поэтому при мегалобластической анемии фолиевую кислоту назначают в комбинации с цианокобаламином.
Стимуляторы лейкопоэза Лекарственные средства - метилурацил - пентоксил - нуклеинат натрия
Нуклеинат натрия получают из дрожжей. Он богат пиримидиновыми основаниями. Пентоксил и метиурацил получают синтетически, они являются производными одного из пиримидиновых оснований – урацила. Студенты, должно быть, помнят, что урацил является одним из азотистых оснований, входящих в состав РНК. Соответственно, прием метилурацила, пентоксила и нуклеината натрия приводит к усилению образования РНК, что, в свою очередь, приводит к усилению синтеза белка в клетках. Учитывая это, перечисленные препараты усиливают созревание Т-лимфоцитов, В-лимфоцитов и макрофагов (соответственно, будет усиливаться клеточный, гуморальный и неспецифический иммунитет), усиливают лейкопоэз и эритропоэз, проявляют анаболические эффекты в других клетках. Показания для применения метилурацила, пентоксила и нуклеината натрия: - агранулоцитоз (=лейкопения), вызванный приемом цитостатиков, развившийся вследствие лучевой болезни, агранулоцитарной ангины, алиментарно-токсической алейкии. - хроническое течение инфекций, в том числе гнойных (в легких, печени, мягких тканях) - вялозаживающие раны и язвы Тромбоэмболический синдром Носовое кровотечение Гипохромная анемия Лейкоз
Гепарин Начальная доза гепарина, вводимого в лечебных целях, обычно составляет 5 тыс. МЕ и вводится в/в инъекционно (за один раз), после чего лечение продолжают, используя в/в инфузии. Поддерживающие дозы определяются в зависимости от способа применения: - при непрерывной в/в инфузии назначают по 1-2 тыс. МЕ/ч (24-48 тыс.МЕ/сут), разводя гепарин в 0.9% растворе NaCl; - при периодических в/в инъекциях назначают по 5-10 тыс. МЕ гепарина каждые 4 - 6 ч.
Аминокапроновая кислота Для быстрого эффекта вводят внутривенно капельно 5% раствор препарата в объеме 100 мл. Поддерживающая терапия — по 1 г (50 мл) каждый час до полной остановки кровотечения, но не более 8 ч.
Викасол В/м, разовая доза для взрослых - 10-15 мг, суточная - 30 мг. Внутрь, суточная доза для взрослых - 15-30 мг. Продолжительность лечения - 3-4 дня, после 4-дневного перерыва курс повторяют.
Адреналина гидрохлорид Смочить ватный тампон в 0,1% растворе и ввести в носовой ход
Перекись водорода Смочить ватный тампон в 3% растворе и ввести в носовой ход
Ферковен В/в медленно (в течение 8-10 мин), 1 раз в день, ежедневно, в течение 10-15 дней: первые 2 инъекции - по 2 мл, затем - по 5 мл.
Цианокобаламин
Метилурацил Внутрь: во время или после еды, по 500 мг 4 раза в сутки
Циклофосфан В/в, в/м по 200-400 мг ежедневно. Для приготовления раствора 200 мг растворяют в 10 мл, 400 мг - в 20 мл воды для инъекций (нельзя использовать 0.9% раствором NaCl).
ФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
1. В обычных физиологических условиях кровь циркулирует по организму и не склонна к тромбообразованию. Почему?
Внимание! Далее вы увидите, что выделение из везикул ряда веществ и активация гликопротеина GPIIb/IIIa имеют важное значение для агрегации тромбоцитов. Внимание! Аденилатциклаза и фосфолипаза С – это ферменты, которые расположены в клеточной мембране. Поэтому, начиная с этой распечатки, мы будем изображать их именно там (рис. 1). Кроме того, PgI2 воздействует на свои рецепторы, расположенные в стенке сосудов → ↑АЦ → ↑цАМФ → ↓Са2+ → ухудшение взаимодействия актина и миозина → расслабление мышечных клеток сосудистой стенки → расширение сосудов → затруднение образования тромбов (влияние PgI2 на сосудистую стенку на рис. 1 не показано). Аналогичным действием на тромбоциты и сосудистую стенку обладает аденозин, поскольку в перечисленных структурах он воздействует на аденозиновые рецепторы 2 типа (А2-рецепторы), которые также сопряжены с аденилатциклазой (АЦ).
Рис. 1. Физиологические механизмы, препятствующие тромбообразованию. Гемостаз
Кровь является важной частью соединительной ткани, поскольку обеспечивает поддержание обмена веществ между клетками. Потеря избыточного количества крови приводит к гибели организма. Чтобы этого не произошло, в поврежденном сосуде образуется тромб. Гемостаз протекает в два этапа: а) первичный гемостаз: спазм сосуда + агрегация тромбоцитов б) вторичный гемостаз: поддержание спазма сосуда + стабилизация тромба (образованного тромбоцитами) за счет образования нитей фибрина Давайте более подробно остановимся на каждом из видов гемостаза.
А) Первичный гемостаз (агрегация тромбоцитов)
Давайте сначала посмотрим более крупным планом на те процессы, которые происходят во время первичного гемостаза. А уже затем углубимся в молекулярные взаимодействия, сопровождающие эти процессы. При повреждении эндотелия (рис. 2А) в кровь начинают быть видны молекулы гликопротеина, называемого фактором Виллебранда. Некоторое его количество находится в подэндотелиальном пространстве, некоторое количество выделяется из поврежденных эндотелиоцитов. Мембрана тромбоцитов взаимодействует с фактором Виллебранда, что обеспечивает адгезию – прилипание тромбоцитов к месту повреждения в эндотелии (рис. 2Б). Теперь мембрана тромбоцитов имеет возможность взаимодействовать с коллагеном, находящимся в месте повреждения (как вы помните их курса гистологии, коллаген находится, например, в базальной мембране) (рис. 3В). Связывание с коллагеном приводит к активации тех тромбоцитов, которые прилипли к зоне повреждения в эндотелии. А это, в свою очередь, приводит к развитию цепной реакции и активированию тех тромбоцитов, которые находятся в крови вблизи места повреждения в свободном состоянии. В результате происходит агрегация – соединение всех активированных тромбоцитов между собой с помощью фибриногеновых мостиков (рис. 2Г). В результате образуется тромб, состоящий, преимущественно, из тромбоцитов.
Внимание! Во время первичного гемостаза тромбоциты соединяются между собой именно с помощью фибриногена (не с помощью фибрина!). На рис. 2 в месте повреждения эндотелия показан один прилипший тромбоцит. В реальных условиях к месту повреждения прилипает, конечно же, несколько тромбоцитов.
Рис. 2. Взгляд крупным планом на первичный гемостаз.
Давайте теперь более детально изучим те молекулярные механизмы, которые происходят во время активации и агрегации тромбоцитов. Итак, выше мы писали, что мембрана тромбоцита связывается с коллагеном в месте повреждения эндотелия. Это служит стимулом, который а) заставляет везикулы высвобождать свое содержимое (АДФ, серотонин, тромбин и пр.) из тромбоцита в плазму крови, и б) активирует ЦОГ-1, расположенную в тромбоцитах, которая из арахидоновой кислоты образует тромбоксан ТХА2; поскольку ТХА2 является липофильной молекулой, он без особых затруднений проходит через мембрану тромбоцита и тоже оказывается в плазме крови. Важно также отметить, что из поврежденного эндотелия в плазму крови высвобождается брадикинин.
Таким образом, первичным стимулом, запускающим активацию тромбоцитов, является связывание мембраны тромбоцитов с коллагеном.
А дальше развиваются процессы, представленные на рис. 3. Молекулы АДФ, ТХА2 и брадикинина действуют на свои рецепторы, расположенные в мембране тромбоцитов. Это приводит к активации фосфолипазы С (ФЛС), которая разрушает фосфолипиды мембраны и образует из них инозитолтрифосфат (IP3). За счет того, что в цитоплазме растет концентрация IP3, увеличивается внутриклеточная концентрация ионов Са2+. Ионы Са2+ способствуют тому, что: - гликопротеин GPIIb/IIIa меняет свою конформацию и переходит в активное состояние. Теперь гликопротеин GPIIb/IIIa может соединяться с фибриногеном – ключевая реакция, необходимая для агрегации тромбоцитов. - ЦОГ-1 начинает работать еще интенсивнее, и за пределы тромбоцита выбрасывается еще большее количество ТХА2. Из везикул усиливается выброс содержащихся в них веществ – АДФ, серотонина, тромбина и пр. За счет того, что в плазме крови в районе повреждения эндотелия увеличивается содержание ТХА2 и АДФ (не стоит забывать и о брадикинине, высвобождаемом из поврежденных эндотелиоцитов), происходит вовлечение в процесс все большего количества тромбоцитов – в них тоже увеличивается концентрация ионов Са2+, что ведет к активации гликопротеина GPIIb/IIIa. В результате огромная масса тромбоцитов оказывается способной связать фибриноген, что, собственно, и приводит к агрегации тромбоцитов
Следовательно, вторичным (и главным!) стимулом, запускающим агрегацию тромбоцитов, является выделение из тех тромбоцитов, которые первыми прилипли к месту повреждения, биологически активных веществ (ТХА2 и АДФ). Вещества, выделяемые из тромбоцитов - ТХА2, АДФ, серотонин – воздействуют на свои рецепторы, расположенные в стенке сосудов → ↑ФЛС → ↑IP3 → ↑Са2+ → улучшение взаимодействия актина и миозина → сокращение мышечных клеток сосудистой стенки → сужение сосудов → облегчение образования тромбов (влияние всех перечисленных веществ на сосудистую стенку на рис. 3 не показано).
Рис. 3. Молекулярные механизмы, обеспечивающие первичный гемостаз. Б) Вторичный гемостаз (свертывание крови)
Тромб, образованный из тромбоцитов, является мягким и нестабильным. Вторичный гемостаз необходим для того, чтобы сделать тромб твердым и стабильным. Суть вторичного гемостаза (свертывания крови) сводится к тому, что поврежденный эндотелий активирует каскад реакций, в ходе которых одни факторы крови активируют другие (рис. 4). Последними реакциями данного каскада являются: - образование из протромбина (II фактор) тромбина (IIa фактор); - под влияние тромбина (IIa фактор) фибриноген (I фактор) превращается в фибрин (Ia фактор), который затем под влиянием XIIIa фактора полимеризуется в фибриновые нити, хаотично располагающиеся между тромбоцитами и охватывающие их снаружи. В таком состоянии тромб становится плотным и стабильным. Дополнительная стабилизация тромба достигается за счет того, что в мелких ячейках, образованных фибриновыми нитями, застревают другие форменные элементы крови (эритроциты и пр.). Когда мы с вами рассматривали первичный гемостаз, то говорили, что в нормальных условиях существуют факторы, препятствующие агрегации тромбоцитов – например, PgI2, аденозин. Точно также существуют факторы, которые в нормальных условиях препятствуют свертыванию крови. Например, антитромбин II, антитромбин III угнетают активность XIIa, XIa, Xa, IXa и IIа факторов свертывания крови, тем самым нарушая тромбообразование.
Внимание! Рис. 4 дан скорее для общего ознакомления, чем для тщательного запоминания.
|
|||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.70.157 (0.136 с.) |
 Дело в том, что циклооксигеназа 1 типа (ЦОГ-1), расположенная в клетках эндотелия, образует из арахидоновой кислоты простациклин PgI2. Некоторое количество простациклина выделяется в кровь и оказывает влияние на свои рецепторы, расположенные в тромбоцитах. Это приводит к активации аденилатциклазы (АЦ), которая из АТФ образует большое количество циклического аденозинмонофосфата (цАМФ). Чем больше в цитоплазме цАМФ, тем большее количество ионов Са2+ уходит в эндоплазматический ретикулум. В результате в цитоплазме снижается концентрация ионов Са2+. В этих условиях везикулы ничего не секретируют за пределы тромбоцитов, а гликопротеин GPIIb/IIIa находится в неактивном состоянии (рис. 1).
Дело в том, что циклооксигеназа 1 типа (ЦОГ-1), расположенная в клетках эндотелия, образует из арахидоновой кислоты простациклин PgI2. Некоторое количество простациклина выделяется в кровь и оказывает влияние на свои рецепторы, расположенные в тромбоцитах. Это приводит к активации аденилатциклазы (АЦ), которая из АТФ образует большое количество циклического аденозинмонофосфата (цАМФ). Чем больше в цитоплазме цАМФ, тем большее количество ионов Са2+ уходит в эндоплазматический ретикулум. В результате в цитоплазме снижается концентрация ионов Са2+. В этих условиях везикулы ничего не секретируют за пределы тромбоцитов, а гликопротеин GPIIb/IIIa находится в неактивном состоянии (рис. 1).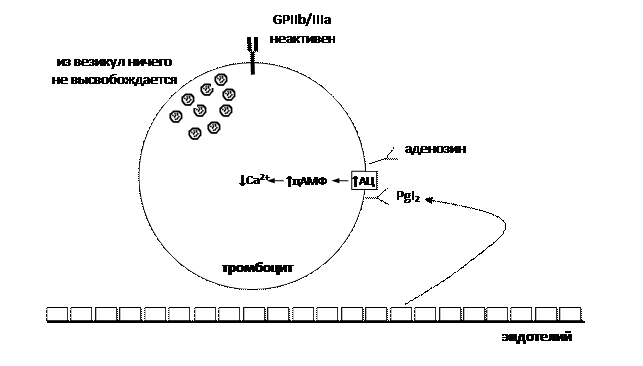
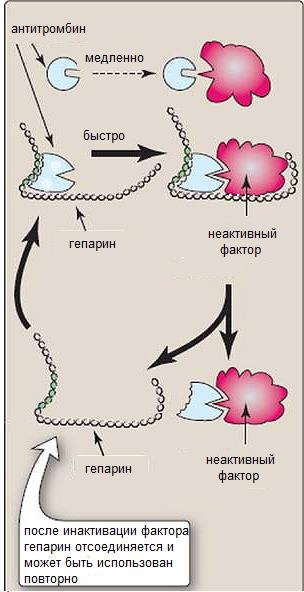 конформацию, что приводит к ускорению их работы. В результате они очень быстро инактивирует факторы свертывания крови, препятствуя свертыванию крови (рис. 8).
конформацию, что приводит к ускорению их работы. В результате они очень быстро инактивирует факторы свертывания крови, препятствуя свертыванию крови (рис. 8).







