Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сколько циклов пцр необходимо провести, чтобы получить 1024 копий амплифицируемого фрагмента днк.⇐ ПредыдущаяСтр 16 из 16
1. 12 2. 10 3. 25 4. 31 5. 9 10. Метод "горячий старт" необходим для: 1. Денатурации белка в образцах выделяемой ДНК 2. Достижения оптимальной температуры действия ДНК-полимеразы 3. Предотвращения неспецифического отжига праймеров 4. Для понижения температуры плавления ДНК 5. Для предотвращения неспецифической амплификации 11. "Горячий старт" можно осуществить с помощью: 1. Добавления к реакционной смеси солей тяжелых металлов. 2. При помощи нагревания реакционной смеси до температуры выше 100 °С 3. Разделив компоненты реакционной смеси парафиновым барьером 4. Посредством присоединения термо- или рН-лабильных химических групп к некоторым аминокислотам ДНК-полимеразы 5. Увеличив концентрацию dNTP 12. Выберите утверждения, правильно характеризующие ПЦР в реальном времени: 1. Позволяет получать ответ о присутствии искомого фрагмента ДНК по принципу "да - нет" 2. Позволяет регистрировать накопление ДНК непосредственно в ходе ПЦР с целью количественного определения исходного числа ДНК-матриц 3. Позволяет избежать неспецифической амплификации 4. Требует проведения электрофореза для детекции продуктов ПЦР 5. Требует присутствия флуоресцентных красителей в составе реакционной смеси. 13. ПЦР в реальном времени позволяет сравнивать количества субстрата при условии, что: 1. Эффективность реакции и заданный уровень пороговой флуоресценции различаются для каждой из сравниваемых реакций. 2. Пороговый уровень флуоресценции обратно пропорционален логарифму количества ДНК-матрицы 3. Пороговый уровень флуоресценции пропорционален концентрации ДНК-полимерразы 4. Пороговый уровень флуоресценции пропорционален логарифму количества ДНК-матрицы 5. Эффективность реакции и заданный уровень пороговой флуоресценции одинаковы для каждой из сравниваемых реакций. 14. Выберите утверждение, правильно характеризующие гены домашнего хазяйства: 1. Являются индуцируемыми генами 2. Ответственны за регуляцию экспрессии генов 3. Являются конститутивными генами 4. Используются для нормировки результатов ПЦР в реальном времени 5. Регулируют клеточный цикл 15. К неспецифическим системам детекции продуктов ПЦР в реальном времени относятся: 1. Праймеры-скорпионы
2. TaqMan 3. ИКП 4. Амплифлюры 5. Интеркалирующие красители 16. Для создания клональных библиотек фрагментов ДНК с последующим NGS можно использовать следующие варианты метода ПЦР: 1. ПЦР в реальном времени 2. Мостиковая ПЦР 3. Эмульсионная ПЦР 4. Классическая ПЦР 5. ПЦР в реальном времени с обратной транскрипцией (ОТ-ПЦР) 17. Последовательность нуклеотидов в нуклеиновой кислоте (ДНК или РНК) можно определить с помощью методов: 1. Цифровой капельной ПЦР 2. Метода Сэнгера 3. ПЦР в реальном времени 4. Метода Максама-Гилберта 5. Эмульсионной ПЦР 18. Выберите выражения, правильно характеризующие метод секвенирования ДНК по Сэнгеру: 1. Требует обработки ДНК химическими реагентами 2. Может быть использован для секвенирования ДНК, богатой палиндромными последовательностями 3. В основе метода лежит ферментативная реакция, катализируемая ДНК-полимеразой 4. Не нуждается в присутствии ферментов 5. Требует использования модифицированных нуклеозидтрифосфатов 19. Обязательными компонентами при пиросеквенировании являются: 1. Тимидинкиназа 2. Гипоксантинфосфорибозилтрансфераза 3. Люцифераза 4. Гуанилатциклаза 5. Сульфурилаза 20. В качестве систем переноса экзогенных ДНК при генотерапии могут использоваться: 1. Белки-шапероны 2. Прионы 3. Ретровирусы 4. Липосомы 5. Пероксисомы Часть II 1. Метод пиросеквенирования основан на использовании ферментов: 1. Циклооксигеназа 2. Апираза 3. Тиолаза 4. Люцифераза 5. Сульфурилаза 2. К специфическим методам детекции ПЦР в реальном времени относятся: 1. Линейные разрушаемые пробы (TaqMan) 2. Меченные праймеры с адаптерной последовательностью 3. Интеркалирующие красители 4. Пробы с инвертированными концевыми повторами (ИКП) 5. Флуоресцентный резонансный перенос энергии (FRET) 3. Выберите утверждения, правильно характеризующие метод пиросеквенирования: 1. Метод основан на расщеплении ДНК с помощью химических реагентов 2. Метод основан на встраивании в растущую цепь ДНК терминирующих нуклеотидов 3. Метод основан на регистрации образующегося пирофосфата 4. В ходе анализа используются ферменты люцифераза, сульфурилаза и апираза
5. Регистрация акта присоединения нуклеотида производится по квантам хемилюминесценции 4. Клональные библиотеки фрагментов ДНК можно получить с помощью: 1. Классической ПЦР 2. Цифровой капельной ПЦР 3. ПЦР в реальном времени 4. Эмульсионной ПЦР 5. Мостиковой ПЦР 5. Выберите утверждение, правильно характеризующее метод полупроводникового секвенирования: 1. Метод основан на детекции образующегося в ходе реакции пирофосфата 2. Метод основан на лигировании флуоресцентно-меченных зондов 3. Метод основан на регистрации локального изменения рН на чипе 4. Недостатком метода является трудность прочтения гомополимерных участков 5. Метод не требует оптической детекции 6. Установите соответствие между пунктами, обозначенными цифрой и буквой:
7. Выберите утверждения, правильно характеризующие метод "дробовика": 1. Лежит в основе метода пиросеквенирования 2. Основан на секвенировании коротких фрагментов ДНК с последующим восстановлением исходной последовательности на основе анализа перекрываний 3. Может быть применен на сиквенса длинных последовательностей ДНК за одно прочтение 4. Был положен в основу проекта "Геном человека" 5. Недостатком метода является возможность неверной сборки с потерей участков последовательности 8. Экзогенная ДНК может быть доставлена в клетки-мишени с помощью: 1. Лизиса клеточной мембраны 2. Электропорации 3. Обработки клеток детергентами 4. Липосом и/или рецептор-опосредованного переноса 5. Векторов на основе вирусов 9. К физическим методам трансфекции относятся: 1. Трансдукция с помощью векторов на основе вирусов 2. Рецептор-опосредованная трансфекция 3. Электропорация 4. Бомбардировка микрочастицами 5. Микроиньекция 10. Установите соответствие между пунктами, обозначенными цифрой и буквой:
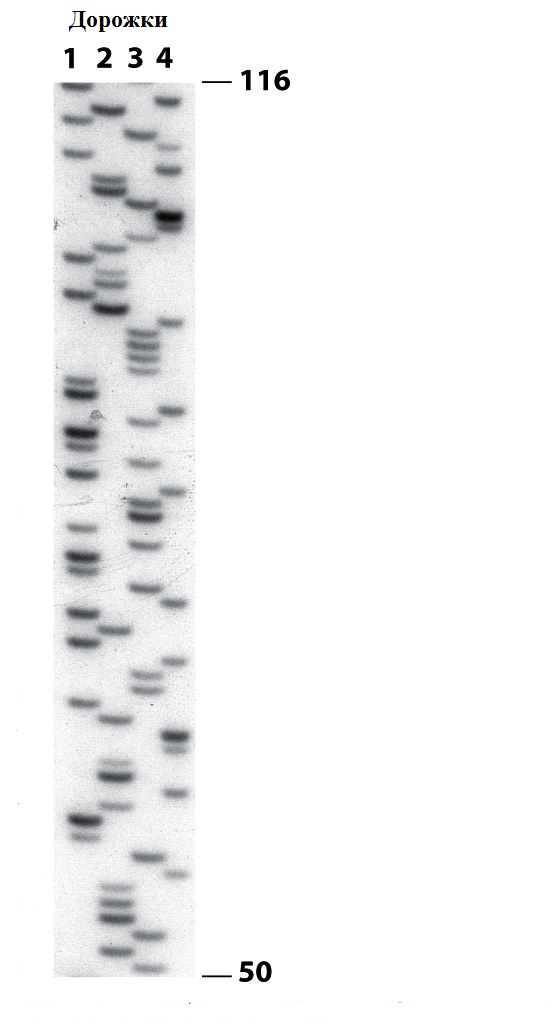
Задача №1 Если реакцию ПЦР, изображенную на Рис. 2 продлить еще на 2 цикла, то сколько образуется фрагментов ДНК, помеченных серым, зелёным, красным и желтым? Если провести еще много циклов, какие фрагменты будут преобладать? Задача №2 Сколько примерно циклов ПЦР потребуется, чтобы получить 100 нг ДНК из одной двухцепочечной молекулы ДНК длиной в 500 п.н.? 100 нг- это количество ДНК, которое легко можно обнаружить в электрофорезе путем окрашивания бромистым этидием. Задача №3 Что произойдет при секвенировании ДНК, если повысить содержание дидезоксинуклеозидтрифосфатов (ddNTP) по сравнению с дезоксинуклеозидтрифосфатами (dNTP)? Что произойдет, если понизить? Задача №4 А) Определите последовательность ДНК, использовавшейся для секвенирования по электрофореграмме:
На 4-х дорожках находятся продукты секвенирования, полученные при использовании ddGTP (дорожка 1), ddATP (дорожка 2), ddTTP (дорожка 3) и ddCTP (дорожка 4). Числа справа показывают положение маркерных молекул ДНК длиной 50 и 116 нуклеотидов. Б) Эта ДНК была получена из середины клонированной кДНК белка одного из видов млекопитающих. Можно ли определить аминокислотную последовательность использованной части белка с помощью таблицы генетического кода? Задача №5 В родильном отделении 4 пары близнецов-мальчиков, родившихся с интервалом около 1 ч, случайно перепутали. Вас вызвали, чтобы навести порядок. Для начала вы хотите объединить близнецов попарно (многие младенцы выглядят на одно лицо, так что вы не хотите полагаться на внешность). Поэтому вы решаете проанализировать взятую у них пробу крови, используя зонд, гибридизующийся с короткими тандемными повторами (STRs), которые разбросаны по разным участкам генома. В результате анализа вы получили следующую картину:
А) Какие из детей - близнецы? Какие из них монозиготные близнецы? Б) Как можно определить, каким родителям принадлежит каждая из пар близнецов? Задача №6 Предположим, что проводится секвенирование ДНК, как показано на рисунке:
К каждому ddNTP ковалентно прикреплены красители разного цвета, что не влияет на их включение в цепь ДНК (G-желтый, А-зеленый, С-синий, Т-красный). Какие продукты образуются, если все эти ddNTP добавить в одну реакционную смесь вместе с 4-мя немеченными dNTP? Как будет выглядеть результат, если продукты реакции разделить в электрофорезе на одной дорожке? Тема: "Использование ДНК-технологий в медицине: методы ПЦР и секвенирования. генная терапия" Часть I |
Часть II | |||||||||||||||||||||||||||||||||||||||||||
| № | ответ | № | ответ | № | ответ | № | ответ | № | ответ | № | ответ | ||||||||||||||||||||||||||||||||||
| 1 | 24 | 6 | 2 | 11 | 34 | 16 | 23 | 1 | 245 | 6 | 451823967 | ||||||||||||||||||||||||||||||||||
| 2 | 35 | 7 | 23 | 12 | 25 | 17 | 24 | 2 | 145 | 7 | 245 | ||||||||||||||||||||||||||||||||||
| 3 | 13 | 8 | 13 | 13 | 45 | 18 | 35 | 3 | 345 | 8 | 245 | ||||||||||||||||||||||||||||||||||
| 4 | 24 | 9 | 2 | 14 | 34 | 19 | 35 | 4 | 245 | 9 | 345 | ||||||||||||||||||||||||||||||||||
| 5 | 35 | 10 | 35 | 15 | 45 | 20 | 34 | 5 | 345 | 10 | 3412 | ||||||||||||||||||||||||||||||||||
Ответы к задачам
Ответ к задаче №1: После дополнительного раунда репликации будет 2 фрагмента, показанных серым, 4 - зеленым, 4 -красным и 22 - желтым цветом. После второго дополнительного раунда - 2 фрагмента серым, 5 - зеленым, 5 - красным и 52 - жёлтым. Таким образом, число фрагментов ДНК, показанных жёлтым, растет экспоненциально и в конце концов сильно превысит количество других продуктов реакции. Их длина равна длине последовательности ДНК, расположенной между двумя праймерами, плюс длине 2-х праймеров.
Ответ к задаче №2 Масса молекулы ДНК длиной 500 п.н. равна 5,5х10-19 г.: (2х500х330 г/моль)/6х1023 (число Авогадро). Если пренебречь сложностями нескольких первых шагов реакции амплификации, во время которых образуются более длинные продукты, в конечном счете вносящие незначительный вклад в общее количество амплифицированной ДНК, то можно считать, что это количество удваивается при каждом шаге амплификации. Поэтому: 100х10-9 г = 2Nх5,5х10-19, где N - число циклов ПЦР. Решение этого уравнения для N = log (1,81x1011)/log 2 = 37,4. Таким образом, требуется всего 40 циклов амплификации, чтобы из одной молекулы ДНК получить ее количество, достаточное для биохимического анализа. Процедура автоматизирована и занимает несколько часов.
Ответ к задаче №3 Если количество ddNTP увеличить по отношению к количеству dNTP, полимеризация ДНК будет прерываться чаще, и начнут образовываться более короткие цепочки ДНК. В таких условиях удобно определять нуклеотидные последовательности, расположенные близко к используемому в реакции ДНК-праймеру. Напротив, при пониженном отношении ddNTP/dNTP образуются более длинные фрагменты ДНК, что позволяет определить нуклеотидные последовательности, более удаленные от праймеров.
Ответ к задаче №4
А)
1)5ʹ TATAAACTGGACAACCAGTTCGAGCTGGTGTTCGTGGTCGGTCGGTTTTCAGAAGATCCTAACGCTGACG 3ʹ
2)3ʹ ATATTTGACCTGTTGGTCAAGCTCGACCACAAGCACCAGCCAGCCAAAAGTCTTCTAGGATTGCGACTGC 5ʹ
Последовательность ДНК, от 5ʹ-конца к 3ʹ-концу, прочитывается начиная с нижней части геля, куда попадают самые короткие фрагменты ДНК. Каждая полоска образуется в результате включения подходящего ddNTP и 2-х полосок с одинаковой подвижностью быть не должно. Это позволяет определить последовательность ДНК, считывая все полоски по очереди, начиная с нижней части геля и определяя правильный нуклеотид в зависимости от того, на какой из 4-х дорожек находится полоска. Нуклеотидная последовательность верхней цепи (1) получена непосредственно из данных электрофореграммы, а нижняя последовательность (2) построена по принципу комплементарности.
|
|
Б) Последовательность нуклеотидов ДНК можно перевести в аминокислотную последовательность, используя генетический код. Однако, имеются 2 цепи ДНК, которые могут транскрибироваться в мРНК, и три рамки считывания для каждой из цепей. Таким образом, существует 6 аминокислотных последовательностей, которые могут быть закодированы в данном отрезке ДНК. Из 3-х рамок считывания, возможных для верхней цепи (1), только одна не прерывается стоп-кодонами (TAA, TGA). Из 3-х рамок считывания для нижней цепи (2) в 2-х также есть стоп-кодоны. Третья рамка дает следующую последовательность:
Ser-Ala-Leu-Gly-Ser-Ser-Glu-Asn-Arg-Pro-Arg-Thr-Pro-Ala-Arg-Thr-Gly-Cys-Pro-Val-Ile
На основе имеющейся информации нельзя точно сказать, какая из 2-х открытых рамок считывания, действительно кодирует белок, закодированный данным участком ДНК.
Ответ к задаче №5 А) Дети 2 и 8 имеют идентичный паттерн STR и поэтому являются монозиготными близнецами. Дети 3 и 6 также имеют идентичный паттерн STR и также являются монозиготными близнецами. Две другие пары близнецов - дизиготные, поскольку их паттерны STR не идентичны. У дизиготных близницов, как и у любых двух потомков одной пары родителей, идентично около половины генома. Поэтому около половины полиморфизмов STR у дизиготных близнецов будут идентичны. Используя это признак, можно установить, что пары дизиготных близнецов - дети (1 и 7) и (4 и 5).
Б) Установить, какие дети каким родителям принадлежат, можно с посощью того же варианта анализа STR-полиморфизма. Каждая полоска на картине STR должна соответствовать полосе одного из родителей. В среднем каждый ребенок будет иметь половину полиморфизмов, характерных для каждого из родителей. Таким образом, уровень сходства между каждым ребенком и каждым родителем будет примерно таким же, как и между дизиготными близнецами.
Ответ к задаче №6
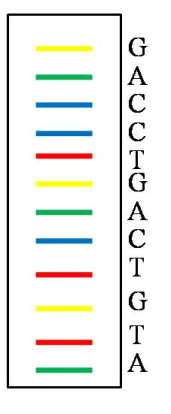
Продукты будут представлять собой большое число различных одноцепочечных фрагментов ДНК, по одной для каждого нуклеотида в последовательности. Однако, каждая молекула ДНК будет одного из 4-х цветов, определяемого тем, какой из 4-х ddNTP останавливает полимеризацию данной цепи. Разделение с помощью электрофореза даст серию полосок, каждая из которых отличается на 1 нуклеотид, и последовательность можно будет определить по порядку расположения цветов. Описанный метод лежит в основе стратегии секвенирования ДНК в большинстве автоматических ДНК-секвенаторов.
Рекомендуемая литература
1. Д. В. Ребриков, Д. О. Коростин, Е. С. Шубина, В. В. Ильинский "NGS: высокопроизводительное секвенирование" - М.: БИНОМ. Лаборатория знаний, 2015.
2. Д. В. Ребриков, Г. А. Саматов, Д. Ю. Трофимов, П. А. Семёнов, А. М. Савилова, И. А. Кофиади, Д. Д. Абрамов "ПЦР в реальном времени" - М.: БИНОМ. Лаборатория знаний, 2015.
3. В. Н. Горбунова, В. С. Баранов "Введение в молекулярную диагностику и генотерапию наследственных заболеваний" - СПб.: "Специальная литература", 1997.
4. Б. Глик, Дж. Пастернак "Молекулярная биотехнология" - М.: Мир, 2002
5. Б. Альбертс, Д. Брей, К. Хопкин, А. Джонсон, Дж. Льюис, М. Рэфф, К. Робертс, П. Уолтер "Основы молекулярной биологии клетки" - М.: БИНОМ. Лаборатория знаний, 2015.
6. B. Alberts, A. Johnson, J. Lewis, M. Raff, K. Roberts, P. Walter "Molecular Biology of the Cell" - Garland Science, 2008.