Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метод обратимых терминирующих нуклеотидов (регистрация каждого присоединенного нуклеотида по отщепляемой метке)
1) за один цикл реакции может быть добавлен только один нуклеотид. Это легко обеспечить с использованием 3ʹ-блокированных dNTP с возможностью снятия блока. 2) метка должна быть отщепляемой. Сначала любым методом создают иммобилизованную на твердой фазе клональную библиотеку одноцепочечных фрагментов ДНК (например, методом мостиковой или эмульсионной ПЦР). Секвенирование начинают с отжига праймера, комплементарного адаптеру на одном из концов библиотеки ДНК. Затем к библиотеке добавляют четыре типа флуоресцентно меченых обратимых терминирующих dNTP (так называемых RT-оснований). ДНК-полимераза присоединяет подходящий нуклеотид к затравке и на этом синтез временно останавливается. Рис. 27 Принцип секвенирования синтезом клональной библиотеки одноцепочечных фрагментов ДНК на твердой фазе Невключившиеся нуклеотиды смывают, и оптическая система считывает флуоресценцию каждой ДНК-колонии библиотеки. Каждая колония высвечивает при этом кванты флуоресценции, соответствующие включившемуся на данном этапе нуклеотиду. После этого флуорофор, наряду с 3ʹ-концевым блокатором, химически удаляют из синтезированной цепи, что позволяет повторить весь цикл сначала (Рис. 27). В отличие от пиросеквенирования в данном подходе сигнал флуоресценции можно регистрировать в течение длительного времени после присоединения очередного нуклеотида, что позволяет производить анализ очень большого количества ДНК-колоний. На данном принципе секвенирования основаны коммерческие технологии компаний Illumina и Pacific Bioscience. 2.8 Полупроводниковое секвенирование (регистрация акта присоединения нуклеотида по образующимся ионам водорода)
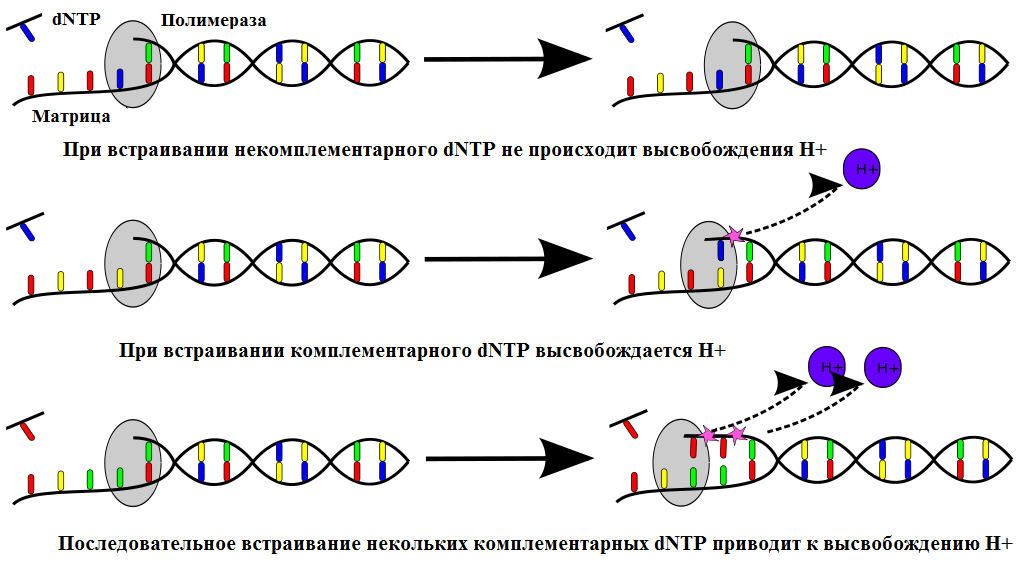
Рис. 28 Полупроводниковое секвенирование Как и в случае пиросеквенирования, у полопроводникового секвенирования есть трудности с детекцией гомополимерных участков. В случае протяженного мононуклеотида, например ТТТТТТТТ, сигнал теряет дискретность и определить, сколько именно нуклеотидов присутствует в последовательности становится затруднительно. Важным отличием полупроводникового секвенирования от других методов является отсутствие оптического детектора сигнала, что значительно упрощает и удешевляет конструкцию прибора. Кроме того, отсутствие необходимости оптической детекции снимает ограничение по количеству микроцентров секвенирования, которые можно разместить на чипе. На принципе полупроводникового секвенирования основана коммерческая технология IonTorrent, предоставляемая компанией Life Technologies Thermo Fisher Scientific. Разработки в данном направлении ведутся также компанией Roche.
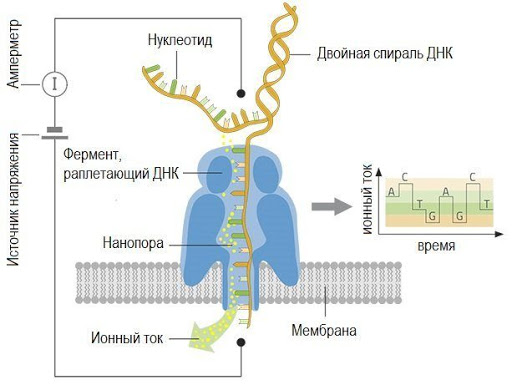
Нанопоровое секвенирование
Рис. 29 Принцип нанопорового секвенирования. Проходящая через пору молекула одноцепочечной ДНК или РНК меняет потенциал на мембране. Поры могут быть естественного биологического происхождения. Например, можно использовать биологическую мембрану с какой-либо порой. Также могут использоваться искусственные поры. Например, поры в виде сенсора для фиксации изменения какой-либо характеристики: туннельного тока, емкости, ионного тока или флуоресценции. При переходе через пору, каждый тип азотистых оснований по-своему "закупоривает" пору и влияет на ток. В настоящее время данная технология реализована компанией Oxford Nanopore (Великобритания) в устройствах MinION, GridION и PromethION (Рис. 30).
Рис. 30 Приборы для нанопорового секвенирования: секвенаторы MinION (А), GridION (Б) и PromethION В настоящее время, технологии Nanopore позволяют осуществлять: - Прямое прочтение нуклеотидных последовательностей цепей ДНК и РНК - Длина прочтения ограничена только длиной фрагмента. - Наблюдение за ходом секвенирования в реальном времени дает возможность остановки процесса в любой момент при достаточном накоплении данных, при очевидных ошибках пробоподготовки или других сбоях в работе; интерпретацию сигналов (base calling) и анализ данных можно проводить непосредственно в процессе секвенирования. Технология обеспечивает простой алгоритм сборки, полученных буквенных последовательностей. В секвенаторе MinION используется ячейка с 512 нанопоровыми каналами, каждый из которых предназначен для анализа отдельной молекулы нуклеиновой кислоты. В сумме прибор позволяет получить до 20 Гб информации о последовательности ДНК. Длина прочтения, ограничена только длиной фрагмента нуклеиновой кислоты и составляет сотни тысяч нуклеотидов. GridION, в отличие от MinION, состоит из пяти проточных ячеек с нанопоровыми каналами, что позволяет проводить пять параллельных независимых экспериментов. Общий объём информации о последовательности ДНК, полученный с помощью секвенатора GridION, может быть до 100 Гб. Методика характеризуется простой пробоподготовкой и возможностью анализировать последовательности любой длины. Секвенатор PromethION пердназначен для высокопроизводительного секвенирования. Прибор включает 24 независимые ячейки, каждая из которых содержит 3000 каналов. При анализе можно задействовать любое количество этих ячеек, в каждой из которых будет проводиться отдельный эксперимент. Анализ результатов происходит с помощью встроенного процессора.
|
||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 350; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.244.201 (0.007 с.) |
 Данная концепция была предложена Баласубрамяном и Кленерманом на химическом факультете Кембриджского университета. Также как и при пиросеквенировании, принцип метода состоит в регистрации факта присоединения очередного нуклеотида, но не по побочным продуктам реакции, а непосредственно по сигналу от присоединенного основания. При этом должны выполняться два требования:
Данная концепция была предложена Баласубрамяном и Кленерманом на химическом факультете Кембриджского университета. Также как и при пиросеквенировании, принцип метода состоит в регистрации факта присоединения очередного нуклеотида, но не по побочным продуктам реакции, а непосредственно по сигналу от присоединенного основания. При этом должны выполняться два требования: