
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
C оотношение между объемными и массовыми долями.
Учитывая (2.7), получаем
Поскольку Разделив числитель и знаменатель этой формулы на массу смеси М, получим
Аналитическое выражение первого закона термодинамики. Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям. В соответствии с уравнением Эйнштейна E=mc2 надо рассматривать единый закон сохранения и превращения массы и энергии. Однако в технической термодинамике мы имеем дело со столь малыми скоростями объекта, что дефект массы равен нулю, и поэтому закон сохранения энергии можно рассматривать независимо. Закон сохранения и превращения энергии является фундаментальным законом природы, который получен на основе обобщения огромного количества экспериментальных данных и применим ко всем явлениям природы. Он утверждает, что энергия не исчезает и не возникает вновь, она лишь переходит из одной формы в другую, причем убыль энергии одного вида дает эквивалентное количество энергии другого вида. В числе первых ученых, утверждавших принцип сохранения материи и энергии, был наш соотечественник М. В. Ломоносов (1711 — 1765 гг.). Пусть некоторому рабочему телу с объемом V и массой М, имеющему температуру Т и давление р, сообщается извне бесконечно малое количество теплоты δQ. В результате подвода теплоты тело нагревается на dT и увеличивается в объеме на dV. Повышение температуры тела свидетельствует об увеличении кинетической энергии его частиц. Увеличение объема тела приводит к изменению потенциальной энергии частиц. В результате внутренняя энергия тела увеличивается на dU. Поскольку рабочее тело окружено средой, которая оказывает на него давление, то при расширении оно производит механическую работу δL против сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии
δQ=dU+δL
т. е. теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы. Полученное уравнение является математическим выражением первого закона термодинамики. Каждый из трех членов этого соотношения может быть положительным, отрицательным или равным нулю. Рассмотрим некоторые частные случаи.
1. δQ=0 — теплообмен системы с окружающей средой отсутствует, т. е. теплота к системе не подводится и от нее не отводится. Процесс без теплообмена называется адиабатным. Для него уравнение (2.8) принимает вид:
δL= - dU.
Следовательно, работа расширения, совершаемая системой в адиабатном процессе, равна уменьшению внутренней энергии данной системы. При адиабатном сжатии рабочего тела затрачиваемая извне работа целиком идет на увеличение внутренней энергии системы. 2. δL=0 — при этом объем тела не изменяется, dV=0. Такой процесс называется изохорным, для него
δQ=dU,
т. е. количество теплоты, подведенное к системе при постоянном объеме, равно увеличению внутренней энергии данной системы. 3. dU=0 – внутренняя энергия системы не изменяется и δQ=δL, т.е. сообщаемая системе теплота превращается в эквивалентную ей внешнюю работу. Для системы, содержащей 1 кг рабочего тела
δq=du+δ1.
Проинтегрировав уравнения и для некоторого процесса, получим выражение первого закона термодинамики в интегральной форме:
Q=ΔU+L; q=Δu+1.
4. Вычисление параметров состояния смеси, определение кажущейся молекулярной массы и газовой постоянной смеси, определение парциальных давлений компонентов. Вычисление параметров смеси · При определении молярной массы и газовой постоянной обратить внимание на способ задания смеси. · Теплоемкости компонентов смеси рассчитать с использованием закона Майера. · Для расчета параметров состояния использовать уравнение состояния идеального газа. · Правильность вычисления энергетических параметров контролировать по выполнению первого закона термодинамики.
|
|||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 119; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.198.43 (0.004 с.) |
 .
. , то
, то 
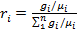 .
.


