
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сущность титриметрического анализа
Титриметрический анализ заключается в измерении объема титранта (раствора точно известной концентрации), затраченного на реакцию с определяемым веществом. Процесс постепенного добавления титранта к анализируемой пробе называется титрованием, а момент завершения реакции – точкой эквивалентности. Расчет в титриметрическом анализе основан на законе эквивалентности. Условимся в дальнейшем любое анализируемое вещество обозначать «Х», а любой титрант «Т». тогда закон эквивалентности можно записать следующей формулой:
с(1/z Х) – молярная концентрация эквивалента вещества, V – объем раствора. Выделим три основных задачи, которые необходимо решить для успешного проведения титриметрического анализа. 1. Необходимо знать точную концентрацию титранта (понятие «точная концентрация» здесь условно; ясно, что опрерируя экспериментальными данными, имеющими приблизительный характер, мы лишь оговариваем степень точности. Точной будем называть такую концентрацию, которая в числовом выражении имеет три значащих цифры, например: 1,38; 0, 0138; 0,400). 2. Необходимо знать точные объемы растворов реагирующих вещестьв, т. е. титранта и анализируемого вещества. 3. Необходимо правильно выбирать реакцию для определения и надежно фиксировать точку эквивалентности. В титриметрическом анализе могут использоваться не все химические реакции, а только те, которые отвечают определенным требованиям. Перечислим основные: 1. реакция должна быть практически необратимой; 2. реакция должна протекать в строгом соответствии с уравнением химической реакции, без побочных продуктов (это требование часто формулируется как «стехеометричность процесса»); 3. реакция должна протекать достаточно быстро; 4. должен существовать способ фиксирования точки эквивалентности. Многие кислотно-основные реакции удовлетворяют этим требованиям, которые были перечислены выше. Использование в качестве титрантов только сильных кислот и сильных оснований обеспечивает практическую необратимость многих реакций. Реакции между кислотами и основаниями не сопровождаются, как правило, какими-либо внешними эффектами, поэтому для фиксирования точки эквивалентности приходится использовать специальные вещества-индикаторы.
Кислотно-основные индикаторы – слабые кислоты или основания, степень ионизации которых определяется концентрацией Н+-ионов в растворе. Для индикатора-кислоты НInd существует равновесие:
Чем больше будет концентрация Н+-ионов, тем меньше будет степень ионизации индикатора. Молекулярная HInd и ионная Ind- -формы индикатора имеют разные окраски. Таким образом, концентрация ионов Н+ влияет на соотоношение концентраций HInd и ионная Ind-, что, в свою очередь, определяет характер или яркость окраски. Для характеристики растворов в химии широко пользуются водородным показателем, рН. В первом приближении: рН=-lg с(Н+). (в дальнейшем определение будет уточнено). В кислых растворах рН<7, в щелочных рН>7, в нейтральных рН=7. Все индикаторы изменяют свою окраску не скачкообразно, а плавно, т. е. в определенном интервале значений рН, называемом интервалом перехода. Поскольку индикаторы как кислоты или основания отличаются друг от друга по силе, они имеют разные интервалы перехода (см.справочник). Значение рН раствора в процессе титрования постоянно меняется, вблизи точки эквивалентности наблюдается так называемый скачок титрования – резкое изменение рН раствора при незначительном добавлении титранта. Для надежного фиксирования точки эквивалентности надо подобрать такой индикатор, интервал перехода окраски которого попадал бы в скачок титрования. В аналитической практике из индикаторов чаще других применяют метилоранж (МО, интервал перехода 3,1 – 4,4) и фенолфталеин (ФФ, интервал перехода 8,0 – 9,6). При титровании сильной кислоты сильным основанием скачок титрования находится в диапазоне рН от 4 до 10 (при концентрации реагирующих веществ, равной 0,1 моль·дм-3). В данном случае могут использоваться метилоранж и фенолфталеин. При титровании слабой кислоты сильным основанием точка эквивалентности смещается с линии нейтральности в щелочную область вследствие гидролиза образующейся в точке эквивалентности соли (рН>7). Скачок титрования сужается и будет тем уже, чем слабее титруемая кислота. В этом случае в качестве индикатора может быть использован из двух упомянутых индикаторов только фенолфталеин.
При титровании слабого основания сильной кислотой по завершении реакции образуется соль, гидролизирующаяся по катиону; точка эквивалентности смещается в кислую область. Для фиксирования точки эквивалентности можно использовать метилоранж, нельзя – фенолфталеин. При уменьшении концентрации реагирующих веществ скачок титрования сужается. Что усложняет проблему выбора индикатора. При титровании многоосновных кислот или солей могут наблюдаться два скачка титрования.
|
||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 125; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.10.246 (0.008 с.) |
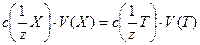 , где
, где НInd H+ + Ind-
НInd H+ + Ind-


