
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Концентрация растворов. приготовление растворов заданной концентрацииСтр 1 из 4Следующая ⇒
Концентрация растворов. приготовление растворов заданной концентрации Методические указания к лабораторной работе Великий Новгород 200 7 Концентрация растворов. Приготовление растворов заданной концентрации. Методические указания к лабораторной работе/ Составители: Олисова Г. Н., Ульянова Н.И.- Великий Новгород, 2007 г. - 16 стр. Введение Растворы играют громадную роль в жизни и практической деятельности человека. Все важнейшие биологические системы (цитоплазма, кровь, лимфа, слюна и др.) являются водными растворами солей, белков, углеводов, липидов. Усвоение пищи, транспорт метаболитов, большинство биохимических реакций в живых организмах протекают в растворах. Производства, в основе которых лежат химические процессы, обычно также связаны с использованием растворов. Они применяются, например, в технологии получения полупроводниковых и проводниковых приборов, в очистке веществ, в гальванических процессах получения и очистки металлов, при травлении металлов и полупроводников и т. д. В практике находят применение как водные, так и неводные растворы.
Общие представления о растворах Понятие «растворы» включает истинные растворы и коллоидные растворы. Различие между ними заключается прежде всего в размерах частиц и однородности систем. Истинные растворы – это термодинамически устойчивые однофазные, однородные гомогенные системы, состоящие из двух или большего числа компонентов с размером частиц на уровне 10-10–10-9 м. Компонентами, составляющими раствор, являются растворитель и растворенные вещества. Растворителем условно принято считать компонент, агрегатное состояние которого не изменяется при образовании раствора, и который содержится в большем количестве. Растворители могут быть жидкими или твердыми, а растворяемые вещества могут находиться в любом из трех агрегатных состояний.
Применение кислотно-основного титрования Кислотно-основное титрование позволяет решать многие задачи, возникающие при клиническом анализе биологических жидкостей как при постановке диагноза, так и при лечении больных. Определение кислотности желудочного сока, буферной емкости крови, спинномозговой жидкости – примеры использования кислотно-основного титрования в повседневной практике.
С помощью этого метода можно анализировать лекарственные вещества, устанавливать доброкачественность продуктов питания (например, молока). Большое значение имеет рассматриваемый метод и при санитарно-гигиенической оценке объектов окружающей среды. Промышленные стоки могут содержать или кислые, или щелочные продукты. Закисление или защелачивание природных водоемов и почвы приводит порой к необратимым последствиям, в связи с чем контроль кислотно-основного баланса весьма важен.
Лабораторная работа «Приготовление растворов заданной концентрации»
Приборы и реактивы: бюретка на 25 мл, воронка, мерные колбы на 50 и 100 мл, пипетки на 10 мл и 2 мл, колбы конические для титрования, колба для слива, резиновая груша, ареометр. Навеска соли, Раствор HCl 0,1 Н (с точно известной концентрацией), Раствор NaOH или КОН (концентрированный) с указанной концентрацией и плотностью, Раствор метилоранжа w =0,1 % и фенолфталеина w =0,1 % в капельницах.
Цель работы: научиться готовить раствор с заданной концентрацией из навески соли и разбавлением концентрированных растворов. Овладеть методикой денсиметрии и кислотно-основного титрования.
Задание: 1) приготовить раствор из навески соли; 2) приготовить раствор КОН (или NaOH) заданной концентрации. Проверить концентрацию полученного раствора методом кислотно-основного титрования.
Ход работы: Оформление опыта 1 1) Название опыта, 2) Расчет массы соли, 3) Расчет погрешности эксперимента.
4) Используя величину плотности раствора – Таблица 2 Экспериментальные результаты
Оформление опыта 2
1) Название опыта, 2) Расчет объема концентрированного раствора щелочи,
3) Обработка экспериментальных данных. По результатам титрований находят средний объем титранта. Концентрацию приготовленного раствора щелочи находят используя закон эквивалентов: γэкв(КОН) = γэкв(HCl) γэкв(Х) = Сэкв(Х) · V(X)
4. Расчет погрешности.
Вывод: 1) проанализировать погрешности эксперимента; 2) указать применение растворов, методов приготовления и определение их состава.
Контрольные вопросы 1. Какой закон лежит в основе титриметрического анализа? Приведите его математическую запись. 2. Какие требования предъявляются к реакциям, используемым в титриметрическом анализе? 3. Какие титранты применяют в ацидиметрии и алкалиметрии? 4. Чем вызвана необходимость стандартизации раствора хлорводородной кислоты? 5. Какие первичные стандарты применяют при определении точной концентрации растворов кислот? 6. Напишите уравнение реакции, лежащей в основе стандартизации раствора НСl. 7. Что из себя представляют индикаторы, применяемые в методе кислотно-основного титрования? Приведите примеры кислотно-основных индикаторов. 8. Что называется интервалом перехода индикатора? От чего он зависит? 9. Какие индикаторы следует выбирать при определении следующих веществ ацидиметрическим титрованием: КОН, NH3, NaHCO3? 10. Какие индикаторы следует выбирать при определении следующих веществ алкалиметрическим титрованием: HNO3, CH3COOH, HCl и CH3COOH в смеси? Литература 1. Ахметов, Н.С. Общая и неорганическая химия: Учеб.для вузов / Н. С. Ахметов. - 7-е изд.,стер. - М.: Высшая школа, 2008. – 742 с. 2. Гельфман, М.И. Неорганическая химия: Учеб.для вузов / М. И. Гельфман, В. П. Юстратов. - 2-е изд.,стер. - СПб.: Лань, 2009. – 527 с. 3. Суворов, А.В. Вопросы и задачи по общей химии: Учеб.пособие для вузов / А. В. Суворов, А. Б. Никольский. - СПб.: Химиздат, 2002. – 304 с. 4. Ахметов, Н.С. Лабораторные и семинарские занятия по общей и неорганической химии: Учеб.пособие для студентов ун-тов,хим.-технол.и пед.вузов / Н. С. Ахметов, М. К. Азизова, Л. И. Бадыгин. - 5-е изд.,испр. - М.: Высшая школа, 2003(2002). – 366 с.
концентрация растворов. приготовление растворов заданной концентрации Методические указания к лабораторной работе Великий Новгород 200 7 Концентрация растворов. Приготовление растворов заданной концентрации. Методические указания к лабораторной работе/ Составители: Олисова Г. Н., Ульянова Н.И.- Великий Новгород, 2007 г. - 16 стр. Введение Растворы играют громадную роль в жизни и практической деятельности человека. Все важнейшие биологические системы (цитоплазма, кровь, лимфа, слюна и др.) являются водными растворами солей, белков, углеводов, липидов. Усвоение пищи, транспорт метаболитов, большинство биохимических реакций в живых организмах протекают в растворах. Производства, в основе которых лежат химические процессы, обычно также связаны с использованием растворов. Они применяются, например, в технологии получения полупроводниковых и проводниковых приборов, в очистке веществ, в гальванических процессах получения и очистки металлов, при травлении металлов и полупроводников и т. д. В практике находят применение как водные, так и неводные растворы.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 108; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.74.227 (0.014 с.) |
||||||||||||||||||||||||||||||||||
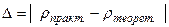 (абсолютная погрешность)
(абсолютная погрешность)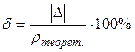 (относительная погрешность)
(относительная погрешность) и
и  (%), вычислите молярную, нормальную, моляльную концентрации полученного раствора, а также его титр и мольную долю соли в растворе. Полученные результаты представьте в виде таблицы 2.
(%), вычислите молярную, нормальную, моляльную концентрации полученного раствора, а также его титр и мольную долю соли в растворе. Полученные результаты представьте в виде таблицы 2.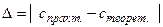 (абсолютная погрешность)
(абсолютная погрешность)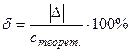 (относительная погрешность)
(относительная погрешность)


