
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворимость в многокомпонентной системе с одноименными ионами ⇐ ПредыдущаяСтр 7 из 7
В этом случае раствор содержит, помимо трудно растворимой соли, другой сильный электролит, как правило, хорошо растворимую соль, имеющий в своем составе одноименные с составом осадка ионы, например: В этом случае при составлении уравнения закона действующих масс следует учитывать, что концентрация катиона или аниона может складываться из нескольких источников. В присутствии одноименного аниона
Например, уравнение закона действующих масс для системы
В присутствии одноименного катиона
Например, уравнение закона действующих масс для системы
В обоих случаях приходится решать степенное уравнение второго или более высокого порядка. Ионную силу раствора в присутствии одноименного иона следует вычислять, ориентируясь на соотношение концентраций в растворе трудно растворимой соли и соли, содержащей одноименный ион. Если разница между ними не велика, то в уравнении ионной силы следует учитывать все ионные компоненты раствора. Если концентрация электролита, содержащего одноименный ион, в 10 и более раз превышает растворимость осадка, то значением растворимости при расчете ионной силы раствора можно пренебречь. Следует запомнить, что растворимость в присутствии одноименных ионов всегда понижается. Пример 25. Вычислить растворимость сульфата серебра в растворе сульфата натрия концентрацией 0,1 моль/кг, если растворимость сульфата серебра в воде составляет 0,0228 моль/кг. Решение. 1. Вычислить ионную силу раствора, содержащего сульфат серебра и сульфат натрия
2. Вычислить средний ионный коэффициент активности сульфата серебра
3. В уравнении произведения растворимости сульфата серебра концентрация сульфат-ионов будет суммой растворимости сульфата серебра в присутствии сульфата натрия (S) и концентрации Na2SO4
4. Вычислить растворимость сульфата серебра в присутствии сульфата натрия, пренебрегая 4 S 3 как бесконечно малой величиной:
Полученное значение растворимости сульфата серебра в присутствии одноименного иона (0,0157 моль/кг) меньше найденное для бинарной системы сульфат серебра – вода (0,0228 моль/кг). В присутствии одноименного иона растворимость малорастворимого соединения должна уменьшаться, что согласуется с полученными расчетными данными.
Задачи для решения VIII. Вычислить растворимость предложенного малорастворимого соединения в воде, в растворе постороннего электролита и в присутствии одноименного иона при 25°С.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 510; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.9.141 (0.007 с.) |
 или
или  .
. уравнение закона действующих масс
уравнение закона действующих масс . (3.12)
. (3.12) :
: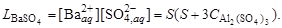

 . (3.13)
. (3.13) :
:







