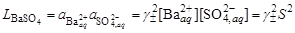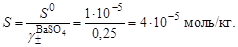Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесия в насыщенных растворах
Общие сведения Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора. Равновесие между солью, состоящей из катионов металла
Константу данного равновесия называют произведением растворимости соли и обозначают L. Согласно закону действующих масс:
где Значения произведений растворимости обычно берут в справочной литературе
Растворимость в бинарной системе соль - вода Растворимость соли соответствует ее концентрации в насыщенном растворе, т.е.
из которого следует уравнение расчета растворимости:
Расчет среднего ионного коэффициента активности следует выполнять по ориентировочному значению растворимости соли S 0, которое высчитывают полагая
Значение S 0 используется в уравнении расчета ионной силы раствора (1.1):
Далее следует вычислить значение коэффициента активности по уравнению (1.2) или (1.3) и произвести уточнение значения растворимости по уравнению (3.9) – S 1. Если значения S 0 и S 1 совпадут (что вполне вероятно при низкой ионной силе раствора), то расчет растворимости считается завершенным. Если совпадение не достигнуто, то следует повторить расчет ионной силы раствора с использованием значения S 1, пересчитать величину среднего ионного коэффициента активности с новым значением ионной силы раствора и снова уточнить величину растворимости. Расчеты следует повторять по тех пор, пока два значения растворимости не совпадут между собой. Пример 22. Рассчитать растворимость Ag2SO4 в воде при 25°С Решение. I. Вычисление растворимости сульфата серебра в воде 1. Составить уравнение диссоциации Ag2SO4, отвечающее равновесному растворению соли:
согласно которому 2. Составить уравнение произведения растворимости Ag2SO4:
3. Вычислить ориентировочное значение растворимости Ag2SO4 принимая при этом значение
4. По найденному ориентировочному значению S0 вычислить ионную силу раствора
5. Вычислить средний ионный коэффициент активности
6. Вычислить растворимость сульфата серебра, учтя найденное значение среднего ионного коэффициента активности
7. По найденному ориентировочному значению SI вычислить ионную силу раствора
8. Вычислить средний ионный коэффициент активности
9. Уточнить растворимость сульфата серебра, учтя найденное значение среднего ионного коэффициента активности
10. Проверить правильность вычислений растворимости сульфата серебра. Для этого выполнить еще один цикл расчетов ионной силы раствора, среднего ионного коэффициента активности и значения растворимости
11. Так как значения S II и S III не совпали, следует проделать еще один цикл вычислений
Значения S III и S IV совпали, следовательно, расчеты можно остановить. В дальнейших вычислениях следует использовать растворимость сульфата серебра в воде, равную 0,0228 моль/кг.
Растворимость в многокомпонентной системе с индифферентным электролитом В этом случае расчет растворимости сводится к влиянию ионной силы раствора на растворимость трудно растворимого соединения. Ионную силу раствора следует вычислять, ориентируясь на соотношение концентраций в растворе трудно растворимой соли и соли, содержащей одноименный ион. Если разница между ними не велика, то в уравнении ионной силы следует учитывать все ионные компоненты раствора. Если концентрация электролита, содержащего одноименный ион, в 10 и более раз превышает растворимость осадка, то значением растворимости при расчете ионной силы раствора можно пренебречь. Пример 23 Рассчитать растворимость Ag2SO4 в растворе нитрата натрия, концентрацией 0,1 моль/кг, если его растворимость в воде составляет 0,0228 моль/кг. Решение. 1. Вычислить ионную силу раствора, содержащего сульфат серебра и нитрат натрия
2. Вычислить средний ионный коэффициент активности сульфата серебра
3. Вычислить растворимость сульфата серебра в присутствии нитрата натрия
4. Пересчитать ионную силу раствора с учетом растворимости сульфата серебра, вычисленной в п. 3
средний ионный коэффициент активности сульфата серебра
и растворимость сульфата серебра в присутствии нитрата натрия
5.
6. Полученное значение растворимости сульфата серебра в присутствии постороннего электролита превышает найденное для бинарной системы сульфат серебра – вода (0,0228 моль/кг). При повышении ионной силы раствора растворимость малорастворимого соединения должна увеличиваться, что согласуется с полученными расчетными данными. Пример 24. Вычислить растворимость сульфата бария (L = 10–10) в растворе хлорида кальция концентрацией 0,1 моль/кг. Решение. 1. Составить уравнение растворимости сульфата бария
его произведение растворимости
и вычислить ориентировочное значение растворимости сульфата бария в воде
2. Вычислить ионную силу раствора, содержащего сульфат бария и хлорид кальция. Очевидно, что ионная сила раствора будет определяться только концентрацией индифферентного электролита
3. Вычислить средний ионный коэффициент активности сульфата бария
4. Рассчитать растворимость сульфата бария в присутствии хлорида кальция
|
||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 1158; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.93.210 (0.015 с.) |
 и анионов кислотного остатка
и анионов кислотного остатка  , и ее насыщенным раствором описывается уравнением:
, и ее насыщенным раствором описывается уравнением: . (3.1)
. (3.1) , (3.2)
, (3.2) – средний ионный коэффициент активности.
– средний ионный коэффициент активности. . Согласно уравнению растворимости:
. Согласно уравнению растворимости:  и
и 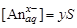 . Уравнение закона действующих масс (3.2) можно записать в следующем виде:
. Уравнение закона действующих масс (3.2) можно записать в следующем виде: , (3.8)
, (3.8)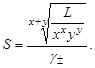 (3.9)
(3.9) :
: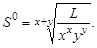 (3.10)
(3.10) (3.11)
(3.11) ,
, .
. .
. = 1
= 1 моль/кг.
моль/кг.






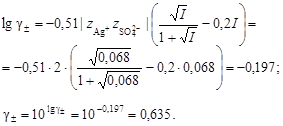









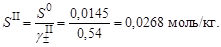
 , следовательно, следует повторить пересчет ионной силы раствора, коэффициента активности и растворимости
, следовательно, следует повторить пересчет ионной силы раствора, коэффициента активности и растворимости


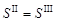 и окончательное значение растворимости сульфата серебра в растворе нитрата натрия составляет 0,0268 моль/кг.
и окончательное значение растворимости сульфата серебра в растворе нитрата натрия составляет 0,0268 моль/кг. ,
,