Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Чем обусловлено разнообразие молекул белка. Какие связи и взаимодействия обеспечивают стабилизацию различных типов пространственной организации белка.
Белки – биологические полимеры, мономерами которых являются аминокислоты. В ходе образования белка аминокислоты взаимодействуют между собой, образуя пептидные связи, в результате чего формируется длинная полипептидная цепь. Разнообразие белковых молекул обеспечивают следующие факторы: 1.Виды аминокислот, входящих в состав белка 2. Количество аминокислот 3. Последовательность соединения аминокислот
Последовательность аминокислот закодирована в ДНК и называется первичной структурой белка. Первичная структура – определенная последовательность α -аминокислотных остатков в полипептидной цепи. Большинство полипептидов состоит из 100...150 аминокислотных остатков (сокращенно – а.о.). Однако существуют также дипептиды (состоят из двух а.о.), олигопептиды (от трех а.о. до нескольких десятков а.о.) и гигантские белки (длиной свыше 300 а.о.).
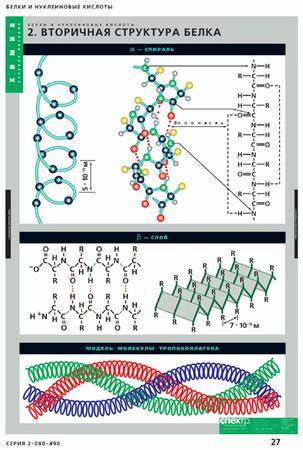
Вторичная структура белков представлена правозакрученной альфа--спиралью, а также складчатыми структурами – бетта-слоями. Алфа -спираль характерна для миоглобина,кератина, бетта- с кладки – для иммуноглобулинов, фиброина шелка. У многих белков вторичная структура представлена чередованием альфа-спиралей, бетта--складок и нерегулярных участков. Иногда встречается левая спираль, например, у коллагена. Вторичная структура белков поддерживается за счет водородных связей, возникающих между группами СО и NH. Вторичная структура – конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. Одна из моделей вторичной структуры – α-спираль, обусловленная кооперативными внутримолекулярными Н-связями. Другая модель – b-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи
Третичная структура (конформация) – это общая форма белковой молекулы в пространстве. По общей форме различают два типа белков: глобулярные (в виде шара) и фибриллярные (в виде нити). Третичная структура поддерживается за счет гидрофобных и бисульфидных связей между аминокислотными радикалами Третичная структура - форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий
Белки или протеины (что в переводе с греческого означает первые или важнейшие), количественно преобладают над всеми другими макромолекулами, присутствующими в живой клетке, и составляют более половины сухого веса большинства организмов. Белки служат теми инструментами, посредством которых генетическая информация получает свое реальное воплощение. В соответствии с тем, что в клеточном ядре содержатся тысячи генов, каждый из которых определяет какой-то один характерный признак живого организма, в клетке существуют тысячи белков и каждый из них выполняет специфическую функцию:
Внутрь клетки должны поступать многочисленные вещества, обеспечивающие ее строительным материалом и энергией. В то же время все биологические мембраны построены по единому принципу - двойной слой липидов, в который погружены различные белки, причем гидрофильные участки макромолекул сосредоточены на поверхности мембран, а гидрофобные хвосты - в толще мембраны. Такая структура непроницаема для таких важных компонентов, как сахара, аминокислоты, ионы щелочных металлов. Их проникновение внутрь клетки осуществляется с помощью специальных транспортных белков, вмонтированных в мембрану клеток. Например, у бактерий имеется специальный белок, обеспечивающий перенос через наружную мембрану молочного сахара - лактозы. Лактоза по международной номенклатуре обозначается -галаткозид, поэтому транспортный белок называют -галактозидпермеазой.
Важным примером транспорта веществ через биологические мембраны против градиента концентрации является Na-K-ый насос. В ходе его работы происходит перенос трех положительных ионов из клетки на каждые два положительных иона в клетку. Эта работа сопровождается накоплением электрической разности потенциалов на мембране клетки. При этом расщепляется АТФ, давая энергию. Молекулярная основа натрийкалиевого насоса была открыта недавно, это оказался фермент, расщепляющий АТФ, - натрий-калийзависимая АТФ-аза. Насос действует по принципу открывающихся и закрывающихся каналов. Связывание молекул "канального" белка с ионом натрия приводит к нарушению системы водородных связей, в результате чего меняется его конформация. Обычная -спираль, в которой на каждый виток приходится по 3,6 аминокислотного остатка, переходит в более рыхлую -спираль (4,4 аминокислотного остатка). В результате образуется внутренняя полость, достаточная для прохождения иона натрия, но слишком узкая для иона калия. После прохождения -спираль переходит в туго свернутую 310-спираль (на один виток 3 аминокислотных остатка, а водородная связь - у каждого 10-го атома). При этом натриевый канал закрывается, а стенки соседнего калиевого канала расширяются, ионы калия проходят по ним в клетку. Натрий-калиевый насос работает по принципу перистальтического насоса (напоминает продвижение пищевого комка по кишечнику), принцип действия которого основан на переменном сжатии и расширении эластичных труб.
У многоклеточных организмов существует система транспорта веществ от одних органов к другим. В первую очередь это гемоглобин. Кроме того, в плазме крови постоянно находится транспортный белок - сывороточный альбумин. Этот белок обладает уникальной способностью образовывать прочный комплексы с жирными кислотами, образующимися при переваривании жиров, с некоторыми гидрофобными аминокислотами (например, с триптофаном), со стероидными гормонами, а также со многими лекарственными препаратами, такими, как аспирин, сульфаниламиды, некоторые пенициллины. В качестве еще одного распространенного примера белка-переносчика можно привести трансферрин (обеспечивает перенос ионов железа) и церуплазмин (переносчик ионов меди).
Наиболее известными примерами таких белков служат белки семян пшеницы, кукурузы и риса. К пищевым белкам относится яичный альбумин - основной компонент яичного белка, и казеин, главный белок молока. В ферритине, встречающимся в животных тканях, запасено железо.
Белками с такой функцией являются актин и миозин, представляющие собой нитевидные белки, функционирующие в сократительной системе скелетной мышцы, а также во многих немышечных тканях (микрофиламенты эукариотических клеток). Миозин представляет собой белок необычного строения, состоящий из длинной нитевидной части (хвост) и двух глобулярных головок. Общая длина одной молекулы составляет порядка 1600 нм, из которых на долю головок приходится около 200 нм. Миозин обычно выделяется в виде гексамера, образованного двумя одинаковыми полипептидными цепями с молекулярной массой 200 000 каждая ("тяжелые цепи") и четырьмя "легкими цепями" с молекулярной массой около 20 000. Тяжелые цепи закручены спиралью одна вокруг другой, образуя хвост, и несут на одном конце глобулярные головки, ассоциированные с легкими цепями. На головках миозина находится два важных функциональных центра - каталитический центр, способный в определенных условиях осуществлять гидролитическое расщепление - -пирофосфатной связи АТФ, и центр, обеспечивающий способность специфично связываться с другим мышечным белком - актином. Актин является глобулярным белком с молекулярной массой 42 000. В таком виде его называют G-актином. Однако он обладает способностью полимеризоваться, образуя длинную структуру, называемую F-актином. В такой форме актин способен взаимодействовать с головкой миозина, причем важной чертой этого процесса является зависимость от присутствия АТФ. При достаточно высокой концентрации АТФ комплекс, образованный актином и миозином, разрушается. После того как под действием миозиновой АТФазы (фермент) произойдет гидролиз АТФ, комплекс снова восстанавливается. Этот процесс легко наблюдать в растворе, содержащем оба белка. В отсутствии АТФ в результате образования высокомолекулярного комплекса раствор становится вязким. При добавлении АТФ вязкость резко понижается в результате разрушения комплекса, а затем начинает постепенно восстанавливаться по мере гидролиза АТФ. Эти взаимодействия играют важную роль в процессе мышечного сокращения. Другим примером таких белков служит тубулин - белок из которого построены микротрубочки, являющиеся важными элементами ресничек и жгутиков, при помощи которых клетки передвигаются. Длинные клетки нервной системы животных также содержат микротрубочки.
Главным компонентом хрящей и сухожилий является фибриллярный белок коллаген, имеющий очень высокую прочность на разрыв. Связки содержат эластин - структурный белок способный растягиваться в двух измерениях. Волосы ногти и перья состоят почти исключительно из прочного нерастворимого белка кератина. Главным компонентом шелковых нитей и паутины служит белок фиброин.
Иммунная система обладает способностью отвечать на появление чужеродных частиц выработкой огромного числа лимфоцитов, способных специфически повреждать именно эти частицы, которыми могут быть чужеродные клетки, например патогенные бактерии, раковые клетки, надмолекулярные частицы, такие как вирусы, макромолекулы, включая чужеродные белки. Одна из групп лимфоцитов - В-лимфоциты, вырабатывает особые белки, выделяемые в кровеносную систему, которые узнают чужеродные частицы, образуя при этом высокоспецифичный комплекс на этой стадии уничтожения. Эти белки называются иммуноглобулины. Чужеродные вещества, вызывающие иммунный ответ называют антигенами, а соответствующие к ним иммуноглобулины - антителами. Если в роли антигена выступает большая молекула, например, молекула белка, то антитело опознает не всю молекулу, а ее определенный участок, называемый антигенной детерминантой. Тот факт, что иммуноглобулины взаимодействуют со сравнительно небольшой частью полимерного антигена, позволяет вырабатывать антитела, специфично узнающие некоторые небольшие молекулы, не встречающиеся в живой природе. Классический пример - динитрофенильный остаток. При введении экспериментальным животным конъюгата динитрофенола с каким-либо белком начинается выработка антител, специфично узнающих различные производные динитрофенола. Но при введении чистого динитрофенола, иммунного ответа нет. Такие вещества, способные служить антигенными детерминантами, но сами не способные вызвать иммунный ответ, называются гаптенами.
Антитела построены из четырех полипептидных цепей, связанных между собой дисульфидными мостиками. Две полипептидные цепи имеют размер порядка 200 аминокислотных остатков и называются легкими цепями (L-цепи). Две другие вдвое больше по размеру и называются тяжелыми цепями (H-цепи). На N-конце обеих цепей имеется вариабельная область размером немногим более 100 аминокислотных остатков, которая различна у иммуноглобулинов, настроенных на разные антигены - именно она определяет специфичность данной популяции лимфоцитов. Вариабелная область формирует центр, непосредственно связывающийся с определенным антигеном или гаптеном остальная часть, составляющая у легкой цепи половину молекулы, а у тяжелой - 3/4, не зависит от вида иммуноглобулина. Эта область называется константной. Согласно современным представлениям, каждый тип иммуноглобулина вырабатывается группой В-лимфоцитов, произошедших от одного общего предшественника. Такую группу лимфоцитов называют клоном. Первые успехи в изучении строения иммуноглобулинов были связаны с изучением иммуноглобулинов, полученных от больных миеломой (патология, связанная со сверхпродукцией определенного вида иммуноглобулинов). У больных, от одного злокачественно разросшегося клона В-лимфоцитов, вырабатывается огромное количество индивидуального иммуноглобулина, который сравнительно легко отделить от остальных. Далее производили слияние клеток миеломы как носителей способности к неограниченному размножению с нормальными В-лимфоцитами как носителями программы выработки антител определенной, задаваемой экспериментатором специфичности. Получающиеся клетки, гибридомы сохраняют способность к неограниченному размножению и вырабатывают при этом только определенные антитела. Так как гибридомы происходят из одной слитой клетки, то они представляют собой единый клон; получающиеся из них антитела поэтому называют моноклональными антителами (МАТ).
Схема строения молекулы иммуноглобулина: Н-цепь - тяжелая цепь, L-цепь - легкая цепь, VH и VL - вариабельные участки тяжелой и легкой цепей.
Регуляторные белки, называемые репрессорами, функционируют как регуляторы биосинтеза ферментов в бактериальных клетках.
Большое значение, в особенности для функционирования многоклеточных организмов, имеют белки-рецепторы, вмонтированные в плазматическую мембрану клеток и служащие для восприятия и преобразования различных сигналов, поступающих в клетку, как от окружающей среды, так и от других клеток. В качестве наиболее исследованных можно привести рецепторы ацетилхолина, находящиеся на мембране клеток в ряде межнейронных контактов, в том числе в коре головного мозга, и у нервно-мышечных соединений. Эти белки специфично взаимодействуют с ацетилхолином и отвечает на это передачей сигнала внутрь клетки. После получения и преобразования сигнала нейромедиатор должен быть удален, чтобы клетка подготовилась к восприятию следующего сигнала. Для этого служит специальный фермент - ацетилхолинэстераза, катализирующая гидролиз ацетилхолина до ацетата и холина.
Многие гормоны не проникают внутрь клеток-мишеней, а связываются со специфическими рецепторами на поверхности этих клеток. Такое связывание является сигналом, запускающим в клетке физиологические процессы. Примером является действие гормона инсулина в аденилатциклазной системе. Рецептор к инсулину представляет собой гликопротеид, пронизывающий плазмалемму. При связывании гормона с рецепторной частью этого сложного белка в нем происходит активация каталитической внутренней части, представляющей фермент аденилатциклазу. Этот фермент синтезирует из АТФ циклическую аденозинмонофосфорную кислоту (цАМФ), которая в свою очередь катализирует ключевую стадию окисления полисахаридов - превращение гликогена в мономерное производное глюкозы глюкозо-1-фосфат, который далее подвергается окислительной деструкции, сопровождающейся фосфорилированием большого количества АДФ.
Так, например, монеллин - белок, содержащийся в одном из африканских растений, имеет очень сладкий вкус. Он стал предметом изучения как нетоксичное и не способствующее ожирению вещество, которое может быть использовано вместо сахара. Плазма крови некоторых антарктических рыб содержит белки со свойствами антифриза, предохраняющие кровь этих рыб от замерзания. Шарниры в местах прикрепления крыльев у ряда насекомых состоят из белка резилина, обладающего почти идеальной эластичностью.
энергетическая ценность белков составляет 17,6 кДж/г; суточная потребность в белке равна 80-100г
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 1196; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.70.93 (0.018 с.) |